гормон шишковидного тела что это
Гормоны в организме человека. За что они отвечают
Гормоны – биологически активные вещества, вырабатывающиеся клетками эндокринных желез (желез внутренней секреции). Оттуда они поступают в кровь и с кровотоком попадают в клетки и ткани-мишени.
Там они связываются со специфическими рецепторами и таким образом регулируют обмен веществ и множество физиологических функций. Так, они отвечают:
Как работает эндокринная система
Разные внешние или внутренние раздражители действуют на чувствительные рецепторы. В результате формируются импульсы, которые действуют на гипоталамус (отдел головного мозга). В ответ на них в гипоталамусе вырабатываются биоактивные вещества, поступающие по локальным сосудам в другой отдел головного мозга – гипофиз.
В ответ на их поступление в гипофизе вырабатываются гормоны гипофиза. Они попадают в кровь и, достигнув с кровотоком конкретной эндокринной железы, стимулируют в ней синтез того или иного гормона. А затем уже этот гормон поступает с кровью к гормональным рецепторам органов-мишеней, как описано выше.
По химическому строению гормоны делят на 4 вида
Стероиды – производные холестерина. Вырабатываются в коре надпочечников (кортикоиды) и половых железах (андрогены, эстрогены). В эту же группу входит кальцитриол.
Производные жирных кислот– эйкозаноиды. К ним относятся простагландины – повышают чувствительность рецепторов к боли и воспалительным процессам, тромбоксаны – участвуют в процессах свертывания крови, лейкотриены – участвуют в патогенезе бронхоспазма.
Производные аминокислот, преимущественно тирозина – гормон стресса адреналин, предшественник адреналина норадреналин и гормоны щитовидной железы.
Белково-пептидные соединения – гормоны поджелудочной железы инсулин и глюкагон, а также гормон роста соматотропин и кортикотропин – стимулятор синтеза гормонов коры надпочечников. В эту же группу входит антидиуретический гормон вазопрессин, «гормон материнства» окситоцин и ТТГ и АКТГ.
По месту образования выделяют гормоны:
По механизму действия различают гормоны:
По биологическим функциям различают гормоны, регулирующие:
Функции основных гормонов в организме
Список по названиям
Тестостерон — вырабатывается и у мужчин, и у женщин. Отвечает:
Эстрогены – женские половые гормоны. Отвечают за формирование первичных половых признаков у женщин. Обеспечивают репродуктивные функции и эмоциональное состояние. У мужчин вырабатываются в жировой ткани живота из тестостерона. Стимулируют синтез коллагена и обеспечивают эластичность кожи. Принимают участие в работе кровеносной системы.
Прогестерон – сохраняет беременность и обеспечивает менструальный цикл у женщин. Кроме этого, и у женщин, и у мужчин он:
Дигидроэпиандростерон – вырабатывается в головном мозге и надпочечниках.
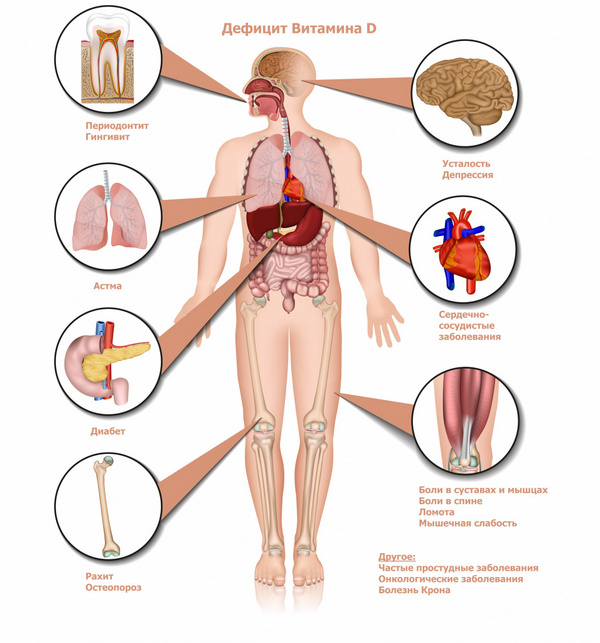
Д-гормон (так называемый витамин Д):
ТТГ — тиреотропный гормон гипофиза. Регулирует выработку гормонов щитовидной железы трийодтиронина Т3 и тироксина Т4. При дисбалансе гормонов щитовидной желез развиваются гипер- и гипотиреоз.
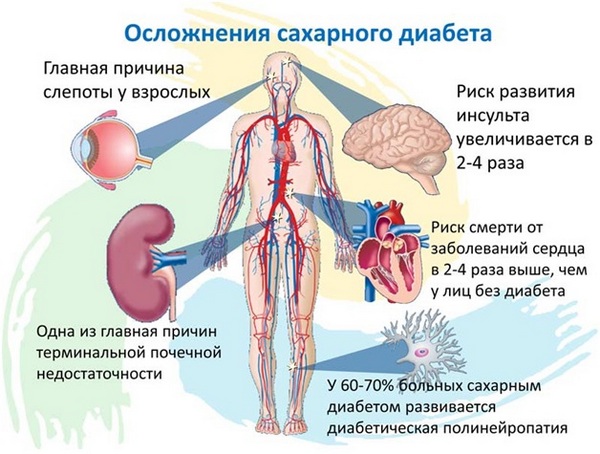
Инсулин – отвечает за усвоение глюкозы клетками. Стимулирует мышечный рост и аппетит. При нехватке инсулина развивается сахарный диабет. Избыток инсулина приводит к инсулинорезистентности (снижение чувствительности инсулинозависимых клеток к действию инсулина с последующим нарушением метаболизма глюкозы и поступления ее в клетки), что ведет к ожирению и развитию сахарного диабета 2 типа.
Дигидротестостерон – влияет на рост волос, образование акне, увеличение простаты у мужчин.
Кортизол – образуется из прогестерона. Адаптирует организм к влиянию стресса, защищает от воспалений, аллергических реакций, поддерживает в норме артериальное давление.
Альдостерон – гормон коры надпочечников; образуется из прогестерона. Отвечает за обмен солей и воды в организме.
СТП (соматотропный гормон) – гормон роста, избыток которого ведет к развитию акромегалии.
В каких случаях нужно сдавать анализы на гормоны
Если баланс эндокринной системы нарушается, в организме развиваются изменения. Нередко достаточно предельно малых отклонений от нормы, чтобы запустить патологический процесс.
Достаточно долго такие патпроцессы могут протекать бессимптомно. Когда же появляется симптоматика, то нередко патогенез уже необратим. Чтобы выявлять бессимптомные гормональные нарушения на ранних стадиях современная доказательная медицина настоятельно рекомендует пакетные проверки. Один раз в 6-12 месяцев достаточно сдать кровь на анализ, чтобы оценить состояние эндокринной системы и не допустить развития гормональных заболеваний.
Кроме этого, о необходимости сдать анализ на гормоны может свидетельствовать ряд признаков:
Также обязательно контролировать уровень гормонов при беременности, чтобы не допустить аномалий развития плода.
При планировании беременности необходимо пройти обследование щитовидной железы: сделать УЗИ щитовидной железы, пройти исследования гормонов ТТГ, Т4 свободный (свободный тироксин) и АТ к ТПО (антитела к тиреопероксидазе)
Во время беременности, если есть нарушение функций щитовидной железы, необходимо 1 раз в триместр проводить скрининг гормона ТТГ и консультироваться у эндокринолога.
Эндокринная система. Норма и патология
Эндокринная система как явление природы
Эндокринная система, она же система нейрогуморальной регуляции (досл. «нервно-жидкостного управления»), чрезвычайно сложна. Ее структура, состав и функционирование находятся, по всей видимости, на пределе того, что в принципе может исследовать и постичь современная наука, вооруженная могучим (как ей кажется) инструментальным, лабораторно-аналитическим и вычислительным арсеналом. Целый раздел медицины, называемый эндокринологией, занимается изучением этой системы, ее нормальной работы, различных ее дисфункций и заболеваний, а также способов лечения последних. Целый сектор фармакологии занят разработкой, синтезом и совершенствованием т.н. гормонсодержащих препаратов; несмотря на хроническую проблему побочных эффектов, обойтись без этой группы лекарственных средств сегодня уже невозможно.
Относящиеся к эндокринной системе органы (железы), ткани или клетки определенного типа, – к примеру, клетки Кульчицкого в слизистой кишечника, – вырабатывают особые органические соединения, которые обычно называют биоактивными регуляторами, нейромедиаторами, сигнальными биохимическими веществами, но чаще всего просто гормонами. Это слово в переводе с греческого означает «возбуждать», «побуждать» или, более современным языком, «активировать». Гормоны поступают непосредственно в кровоток; малейшие колебания их концентрации в живых тканях улавливаются специфическими клетками-рецепторами, чувствительными к той или иной группе гормонов и способными реагировать на гормональные «команды», – например, повышением температуры тела, снижением кровяного давления в сосудах, интенсивным лактогенезом в молочных железах, и мн.др. Таким способом запускаются, форсируются, тормозятся или полностью подавляются, – словом, контролируются, – практически все физиологические и психические процессы в организме. При этом каждая железа секретирует, как правило, несколько гормонов, а каждый гормон в свою очередь влияет на несколько взаимосвязанных процессов.
Синонимический термин «нейрогуморальная регуляция» не случайно содержит корень «нейро-». Согласно современным представлениям, эндокринная система играет важнейшую, исключительную роль в жизнедеятельности организма, но все же не является по отношению к нему «верховной властью». Иерархическое главенство принадлежит центральной нервной системе (ЦНС), т.е. головному и спинному мозгу. Гормоны отвечают за всё, однако секреторной активностью самих эндокринных желез управляют особые церебральные образования и придатки, – прежде всего, связка гипоталамус-гипофиз в нижней области головного мозга, в т.н. промежуточном мозге, – используя для этого сигнальные электрохимические импульсы и целую паутину нейронных каналов связи (в IT такую внутреннюю сеть назвали бы интранетом). Учитывая сказанное, эндокринологию сегодня все чаще отождествляют с нейроэндокринологией (которая полвека назад считалась отдельным направлением), а группу расстройств, ранее традиционно называемых гормональными, интерпретируют как нейроэндокринные заболевания или дисфункции.
Трудно сказать, почему у эволюционирующих млекопитающих возникла столь сложная, многоступенчатая и многоэлементная нейроэндокринная система. Как известно, природа больше всего заботится о целесообразности, и меньше всего – о том, чтобы человеку было удобно ее изучать. Возможных путей и вариантов у природы всегда очень много; скорее всего, бесконечно много. Регулировать жизнедеятельность высших организмов наверняка можно было бы как-нибудь иначе, и желательно – попроще. Однако нельзя отрицать следующее. Человек современный, разумный и технологический, пока еще очень далек от создания искусственной системы, подобной ему самому, – системы столь же компактной, энергетически экономной и эффективной, обладающей сразу пятью автономными сенсорными блоками и двумя универсальными манипуляторами; системы, оптимально сочетающей силу, гибкость и подвижность, безусловные и условные рефлексы, сознание и бессознательное; вдобавок системы самовоспроизводящейся, в какой-то степени самообучающейся и, главное, сохраняющей гомеостаз (постоянство внутренних условий), т.е. самонастраивающейся практически под любые внешние условия. Поэтому сегодня нам остается только восхититься, поблагодарить природу за нашу удивительную эндокринную систему – и продолжить упорное исследование ее бесчисленных загадок.
Основные эндокринные железы
Нередко можно встретить выражение «главная эндокринная железа», причем в разных источниках эта роль отводится то гипофизу, то гипоталамусу. Никто не знает, какие открытия будут сделаны завтра, поэтому ограничимся осторожным повторением вышесказанного: насколько нам известно сегодня, активность нейроэндокринной системы (по крайней мере, большинства желез внутренней секреции) контролируется парой гипоталамус-гипофиз. Кроме того, к важнейшим функциям гипофиза относится продукция соматотропного гормона, регулирующего процессы роста и формирования организма.
Эпифиз (шишковидное тело головного мозга) один из центральных нейроэндокринных регуляторов. Является своеобразным тормозом или ограничителем, который блокирует чрезмерный «разгон» эндокринных желез. В частности, нормализует секрецию соматотропина и половых гормонов, предотвращает опухолевые процессы.
Щитовидная железа участвует в регуляции метаболизма, прежде всего усвоения йода и кальция; влияет на многие зависимые системы и процессы (от общего энергообмена и интеллектуальной продуктивности до регенерации тканей опорно-двигательного аппарата).
Паращитовидные (околощитовидные) железы регулируют состояние костных и мышечных тканей, внутриглазных структур, почек.
Надпочечники вырабатывают, по современным данным, около полусотни сигнальных веществ. Наиболее известные и изученные функции – обеспечение водно-солевого, углеводного, минерального, белкового обмена, продукция мужских и женских половых гормонов (наряду с половыми железами-гонадами). Знаменитые глюкокортикостероидные гормоны, вырабатываемые корой надпочечников, не являются, конечно, панацеей и могут приводить к многочисленным нежелательным эффектам (особенно при пероральном приеме), однако зачастую оказываются единственным «спасательным кругом» благодаря выраженному противовоспалительному, антиаллергическому, иммуномодулирующему, противошоковому и антистрессовому действию. Не менее известны такие биорегуляторы, как адреналин и норадреналин (катехоламиновые гормоны, продуцируемые мозговым веществом надпочечников).
Параганглии особые скопления клеток, которые с полным правом можно назвать нейроэндокринными: отвечают за чувствительность, регулируют обмен хрома и одновременно секретируют катехоламины, подобно надпочечникам.
Поджелудочная железа функционально относится к пищеварительной системе, однако содержит незначительный (1-3% от массы железы) объем эндокринных клеток, сконцентрированных в т.н. островках Лангерганса и продуцирующих инсулин – гормон-регулятор уровня глюкозы в крови.
Яички (у мужчин), яичники (у женщин) – секретируют половые гормоны (андрогены и эстрогены). Эндокринную роль выполняет также плацента при вынашивании беременности.
Вилочковая железа (тимус) производит, в основном, иммунорегулирующие гормоны.
Следует отметить, что к настоящему времени известны далеко не все функции эндокринных желез и вырабатываемых ими гормонов; здесь приводятся лишь наиболее важные и исследованные из них.
Наиболее распространенные эндокринные заболевания
Количество самостоятельных болезней и синдромов, связанных с нарушениями гормонального баланса, сегодня оценивается на уровне примерно шести тысяч. Иными словами, большинство известных современной медицине болезней (около десяти тысяч) действительно являются гормональными. Некоторые из них сегодня грозят приобрести пандемический характер, другие встречаются спорадически редко; одни являются врожденными и генетически обусловленными, другие приобретаются в течение жизни под действием многочисленных этиопатогенетических факторов (травмы, опухоли, воспаления и т.д.).
Наиболее распространенным и известным эндокринно-метаболическим заболеванием следует, по-видимому, считать сахарный диабет. Очень распространена также патология щитовидной железы, в частности, эндемичные йододефицитные состояния, гипертиреоз, тиреоидит и мн. др. Выраженное негативное влияние на весь организм, его формирование, строение, внешний облик, функционирование, – оказывают аномалии и поражения желез, продуцирующих половые гормоны, кортикоиды, соматотропин. Даже известный предменструальный синдром у женщин представляет собой не что иное, как транзиторный, циклически повторяющийся и преходящий гормональный дисбаланс.
В целом, эндокринологии приходится мыслить воистину глобально и системно, имея дело с огромным количеством перекрестно-связанных процессов, нормальных и патологических. Однако заболевания этой группы, некогда бывшие совершенно непостижимыми, в настоящее время успешно диагностируются и лечатся. Важно лишь обратиться к врачу вовремя, – то есть как можно раньше, – пока изменения не приобрели необратимый характер.
Гормон шишковидного тела что это
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Мелатонин (N-ацетил-5-метокситриптамин) – вещество, открытое американским дерматологом А. Лернером. В организме позвоночных животных небольшие количества мелатонина выделяются сетчаткой глаз и значительные – некоторыми клетками слизистой кишечника, но главным источником системного мелатонина является эпифиз. Мелатонин синтезируется из незаменимой аминокислоты триптофана. Ритм его секреции эпифизом носит четко выраженный циркадианный характер. Уровень указанного гормона в крови начинает повышаться в вечернее время, совпадая с уменьшением уровня освещенности, достигает максимума в середине ночи (в 2–3 часа), затем прогрессивно уменьшается к утру. В дневное время секреция мелатонина остается на очень низком уровне. Циркадианный ритм выработки мелатонина эпифизом задается супрахиазматическим ядром таламуса (СХЯ) в зависимости от уровня освещенности 1.
Мелатонин выполняет функцию химического переносчика информации из циркадианного водителя ритма. Центральные мелатониновые рецепторы МТ1 и МТ2 сосредоточены преимущественно в СХЯ, в котором мелатонин действует по принципу обратной негативной связи. Кроме того, наличие МТ1 и МТ2 рецепторов в сосудах, адипоцитах, печени, поджелудочной железе определяет функции мелатонина в регуляции цикла сон-бодрствование и синхронизации наступления сна с изменением метаболических процессов и функционирования внутренних органов. Нарушение циркадианного ритма синтеза мелатонина приводит к развитию десинхроноза, который проявляется в рассогласовании суточных ритмов в работе различных функциональных систем и развитию целого ряда заболеваний.
В среднем, в организме взрослого человека синтезируется за день около 30 мг мелатонина. В крови человека более 80% циркулирующего мелатонина имеет эпифизарное происхождение. Период полужизни мелатонина в организме человека составляет, по разным данным, от 30 до 50 минут. Инактивация мелатонина происходит главным образом в печени, где под воздействием системы микросомальных окислительных ферментов он превращается в 6-оксимелатонин. Большая часть окисленного мелатонина выводится с мочой и калом в виде сульфатного конъюгата 6-сульфатоксимелатонина (6-оксиМТ).
В настоящее время в клинической лабораторной диагностике существуют методы с аналитическими характеристиками, позволяющими определять как содержания мелатонина в плазме и слюне, так и его производного 6-оксиМТ в моче. Вследствие выраженных почасовых колебаний уровня мелатонина в крови и быстром распаде мелатонина (период полувыведения не более 50 минут), объективная оценка содержания мелатонина возможна только при постановке катетера и многократном в течение суток заборе крови, что не может быть рекомендовано для широкого применения в клинической практике. В связи с этим наиболее широко в настоящее время применяется оценка содержания основного метаболита мелатонина 6-сульфатоксимелатонина в моче. Учитывая выраженную зависимость синтеза мелатонина от времени суток, принято оценивать концентрацию или экскрецию 6-оксиМТ отдельно в ночной и дневной порциях мочи.
Стандартизация преаналитического этапа определения метаболитов мелатонина в моче должна стать обязательной процедурой при использовании этого теста в диагностических целях. Данные об экскреции 6-СОМТ могут стать основанием для определения дополнительных показаний к назначению мелатонина при лечении инсомнии и других заболеваний. В оценке метаболизма мелатонина в клинической практике кроме уровня ночной экскреции его метаболитов важным может оказаться уровень дневной, ночной и вечерней экскреции и соотношение этих параметров.
Сложность в интерпретации полученных данных по экскреции мелатонина у пациентов связана с большим разбросом индивидуальных значений. Выраженные индивидуальные колебания уровня мелатонина среди здоровых испытуемых связывают с вариабельностью размеров шишковидной железы. Данные аутопсии выявили значительную вариабельность размеров шишковидной железы, достигающую 20-кратных различий между индивидуумами [3]. Такие же, значительные колебания в уровне секреции мелатонина отмечались многими исследователями у здоровых испытуемых 5. Исследование соотношения размеров шишковидной железы у 122 мужчин в возрасте 75 ± 2,2 лет с помощь МРТ и количеством 6-оксиМТ в утренней порции мочи выявило сильную корреляцию объема паренхимы с уровнем 6-оксиМТ, при значительной вариабельности как объема паренхимы (от 65 до 503 мм 3 ), так и концентрации мелатонина в утренней порции мочи (21 ± 16 нг/мл) [6]. Зависимости между секрецией мелатонина и наличием кист или кальцификатов в шишковидной железе выявлено не было. Единственным значимым для синтеза мелатонина явился объем паренхимы, состоящий из активных пинеалоцитов. В другом исследовании была выявлена значимая связь между объемом паренхимы и количеством 6-оксиМТ в суточной моче [7]. Важным выводом этих исследований явилось доказательство связи уровня секреции мелатонина с объемом паренхимы, а не объемом всей шишковидной железы, которая может включать как кисты, так и кальцификаты. Эта зависимость осталась значимой после исключения влияния возраста, наличия инсомнии, индекса массы тела.
Факторы, определяющие снижение синтеза мелатонина эпифизом
Возраст. Синтез мелатонина шишковидной железой быстро нарастает после рождения ребенка, достигая максимума к 2-4 годам. Резкое снижение синтеза мелатонина происходит в пубертатном периоде и затем отмечается медленное прогрессивное снижение синтеза мелатонина в течение жизни (рис. 1). Прогрессивное снижение синтеза мелатонина при нормальном старении связывают с уменьшением объема функционально активной шишковидной железы в связи с ее кальцифицированием, дегенерацией супрахиазматического ядра, гормональными перестройками в организме. Отмечается преимущественное снижение синтеза ночного мелатонина с достаточно большими индивидуальными колебаниями.
Рис. 1. Снижение синтеза мелатонина с возрастом
( Цит по Journal of anti-aging medicine; Pierpaoli W; 2(4):343-348 (1999)
Вредные привычки. Снижение уровня мелатонина выявлено у активных курильщиков [8]. Употребление алкоголя также снижает синтез мелатонина и вызывает нарушения сна [9].
Лекарственные средства. Многие лекарственные средства, широко используемые в современной медицине, значительно снижают синтез эндогенного мелатонина. В этот перечень входят бета-блокаторы [10, 11], бензодиазепины [12], нестероидные противовоспалительные средства [13,14]. Наиболее значимым для секреции мелатонина является прием бета-блокаторов, которые вызывают снижение секреции мелатонина до 50%. Именно снижение синтеза мелатонина является одной из важнейших причин развития инсомнии при приеме этих лекарственных средств.
Освещенность. Другим важным фактором, определяющим снижение синтеза мелатонина эпифизом является освещенность. При сохранении даже незначительного внешнего освещения в вечернее и ночное время (включенный компьютер, огни наружной рекламы, ночник) секреция мелатонина эпифизом будет нарушена. Оценка концентрации мелатонина в крови во время сна у здоровых волонтеров показала снижение синтеза мелатонина более чем на 50% при сне с сохраненным светом, по сравнению со сном в темноте. Выявлена также значимая разница в синтезе мелатонина в зависимости от интенсивности освещенности комнаты перед сном [15].
Характерная для современной жизни искусственная иллюминация в ночное время тормозит синтез эндогенного мелатонина. По данным многочисленных исследований прогрессивное увеличение освещенности в ночное время наносит серьезную угрозу здоровью жителям Земли. Нарушение циркадианной динамики синтеза мелатонина, связанное с освещенностью и работой в ночное время проявляется десинхронозами, которые повышают риск развития различных соматических, нейродегенеративных заболеваний и рака [1, 16].
Расстройства цикла «сон-бодрствование». Расстройства цикла «сон-бодрствование» включают синдром задержки фазы сна, синдром опережающей фазы сна, расстройство цикла «сон-бодрствование» при сменной работе и при смене часовых поясов (jet lag). Мелатонин играет ведущую роль в лечение этих расстройств сна.
Синдром задержки фазы сна – при этом расстройстве привычное время сна задерживается по отношению к желаемому и принятому в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на невозможность заснуть и трудности при пробуждении в желаемое или назначенное время суток. Позднее засыпание сопровождается мучительным утренним пробуждением и сонливостью в первую половину дня. Распространенность данного состояния максимальна среди подростков и составляет 7-16 %. Показана роль генетических факторов в развитии этого синдрома. Характерным является сдвиг синтеза эндогенного мелатонина на более позднее, чем в норме время. Лечение этого синдрома включает прием мелатонина за час до желаемого сна и использование фототерапии при пробуждении.
Синдром опережающей фазы сна – при этом нарушении привычное время сна наступает раньше, чем желаемое или принятое в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на сильную тягу ко сну в вечернее время и раннее окончательное пробуждение. Распространенность этого синдрома не превышает 1 % среди лиц среднего возраста. В лечении синдрома опережающей фазы сна используется хронотерапевтический подход.
Расстройство цикла «сон-бодрствование» при сменной работе – состояние, характеризующееся симптомами инсомнии и дневной сонливости, возникающее в связи со сменным графиком труда. Проявления расстройства зависят от графика труда. Необходимо соблюдать рекомендации по гигиене сна и организовывать максимально возможную продолжительность сна в условиях сменной работы. Медикаментозная терапия включает использование мелатонина при необходимости спать в дневное время, фототерапию и психостимуляторы для уменьшения сонливости при необходимости работать в ночное время.
Расстройство цикла «сон-бодрствование» при смене часовых поясов (jet lag) – это состояние, проявляющееся инсомнией, избыточной дневной сонливостью и нарушением дневного функционирования которые возникли при быстром перемещении через 2 и более часовых поясов. Причиной развития расстройства является возникшее несоответствие деятельности внутреннего пейсмейкера с локальным временем. Выраженность возникающего после перелета дискомфорта зависит от направления перелета, возраста, хронотипа. При перелете в восточном направлении возникают трудности засыпания, при перелете в западном направлении возникает необходимость ложиться спать позже, что переносится легче. Обычно симптомы держатся не более 2-3 дней, пока происходит адаптация к новому часовому поясу. При недостаточной адаптации к новым условиям рекомендуется использование Z-гипнотиков. Другим средством, облегчающим фазовый сдвиг, является мелатонин.
Заболевания, при которых доказана эффективность лечения мелатонином
Нейродегенерация и мелатонин. Многочисленные нейродегенеративные заболевания, среди которых наибольшее внимание приковано к болезни Паркинсона (БП) и болезни Альцгеймера (БА), сопровождаются различными нарушениями сна. Более того, дефицит сна имеет существенное значение для прогрессирования деменции, так как дренажная функция и удаление продуктов обмена из головного мозга, в том числе амилоида, происходит преимущественно во сне [24]. Прогрессирование нейродегенеративных заболеваний связано также с окислительным стрессом и дисфункцией митохондрий. Наличие у мелатонина выраженных антиоксидантных свойств, а также способности избирательно накапливаться в мембранах митохондрий, нормализуя их работу, рассматривается как ведущий механизм нейропротективного действия мелатонина при болезни Альцгеймера [25]. Исследования по изучению секреции мелатонина при БА малочисленны и свидетельствуют об отсутствии корреляции между БА, нарушением сна и уровнем секреции 6-оксиМТ [26]. В тоже время показано, что длительный (1-4 месяца) прием мелатонина в дозах от 3 до 9 мг способствует нормализации сна и имеет потенциальное положительное влияние на когнитивные функции при болезни Альцгеймера [27, 28].
Отдельного упоминания заслуживает нарушение сна в виде нарушения поведения в фазу быстрого сна. Расстройство поведения в фазу быстрого сна (РПБС) проявляется различной двигательной и речевой активностью. Двигательная активность варьирует от отдельных вздрагиваний до сложных агрессивных форм поведения с толканием, хватанием предметов, что может приводить к травматизации, как самого пациента, так и партнера по постели. Двигательная активность часто сопровождается речевой продукцией. В отличие от снохождения пациенты не покидают кровать, глаза их закрыты. Эпизоды возникают преимущественно во второй половине ночи, во время быстрого сна и характер двигательной и речевой продукции отражает характер сновидений.
Распространенность РПБС в популяции составляет 1-2 %, возникает преимущественно в возрасте старше 50 лет. Выделяют идиопатическое РПБС, и вторичное, развивающиеся у пациентов с синуклеинопатиями (болезнь Паркинсона, деменция с тельцами Леви, мультисистемная атрофия), аутоиммунными заболеваниями (нарколепсия, лимбический энцефалит), с очаговыми поражениями ствола мозга (инсульт, рассеянный склероз), при абстиненции и отмене ряда психотропных средств (антихолинергических и серотонинергических). Так как почти у всех пациентов с идиопатическим РПБС в дальнейшем развивается нейродегенеративное заболевание, эта категория РПБС тоже может быть отнесена к вторичным.
Препаратом выбора является клоназепам в дозе 0,5 – 2,0 мг за 30 минут до сна (уровень А). Клоназепам значительно снижает двигательную активность и травматизм, связанный с РПБС. Ограничениями для использования являются наличие деменции, нарушений походки и синдрома обструктивного апноэ сна, так как клоназепам будет усиливать эти проявления.
Мелатонин в дозе 3-12 мг может быть использован для лечения РПБС (уровень В). Его эффективность в контроле как первичного, так и ассоциированного с синуклеинопатиями РПБС меньше, чем у клоназепама, но больше, чем у других используемых средств. Мелатонин может быть препаратом выбора при лечении РПБС у пациентов с когнитивными расстройствами, нарушениями походки и синдромом обструктивного апноэ сна [29]. Мелатонин может назначаться как изолированно, так и в сочетании с клоназепамом.
Инсомния и мелатонин. Инсомния — повторные нарушения инициации, продолжительности, консолидации или качества сна, случающиеся, несмотря на наличие достаточного количества времени и условий для сна, и проявляющиеся нарушением дневной деятельности разного вида. Нарушения сна наряду с головными болями и дорсалгиями являются наиболее частыми жалобами при обращении к неврологу. По данным эпидемиологии, инсомния встречается у 28–45 % популяции и в половине случаев является важной проблемой требующей лечения. При этом 1,5–3 % популяции постоянно и 25–29 % эпизодически принимают снотворные препараты.
Наступление сна и его отдельных стадий связано с деятельностью сложной сети нервных структур, которая функционирует с помощью различных нейромедиаторных систем, среди которых важную роль отводят мелатонину. Эти представления позволяют предположить возможный дефицит эндогенного мелатонина у пациентов с инсомнией и обосновывают назначение экзогенного мелатонина.
В настоящее время имеется большое количество исследований свидетельствующих об эффективности использования мелатонина с целью улучшения качества и эффективности сна. Эффективность препаратов мелатонина при инсомнии подтверждена как в зарубежных, так и в отечественных исследованиях 32. Показано, что длительное применение не сопровождается снижением эффективности или развитием серьезных нежелательных явлений [34]. Проведение мета-анализа клинических испытаний применения экзогенного мелатонина [35] доказало его эффективность в лечении инсомнии. Были получены данные о значимом снижении времени наступления сна у пациентов с первичными расстройствами сна, получавшими экзогенный мелатонин по сравнению с группой плацебо.
Анисимов В.Н. Мелатонин: роль в организме, применение в клинике / Спб.: Изд-во «Система». 2007. 40 с.
Ковальзон В.М. Основы сомнологии: Физиология и нейрохимия цикла «бодрствование — сон» / М.: БИНОМ., Лаборатория знаний. 2012. 239 с.
Hasegawa A., Ohtsubo K., Mori W. Pineal gland in old age; quantitative and qualitative morphological study of 168 human autopsy cases // Brain Res. 1987. Vol.409. №2. P. 343–349.
Arendt J. Melatonin and human rhythms // Chronobiol Int. 2006. Vol.23. № 1–2. P. 21–37.
Bergiannaki J.D., Soldatos C.R., Paparrigopoulos T.J. et al. Low and high melatonin excretors among healthy individuals // J Pineal Res. 1995. Vol.18. № 3. P. 159–164.
Kunz D., Schmitz S., Mahlberg R. et al. A new concept for melatonin deficit: on pineal calcification and melatonin excretion // Neuropsychopharmacology. 1999. Vol. 21. № 6. P. 765–772.
Ozguner F., Koyu A., Cesur G. Active smoking causes oxidative stress and decreases blood melatonin levels // Toxicol Ind Health. 2005. Vol. 21. № 1-2. P. 21–26.
Kuhlwein E., Hauger R.L., Irwin M.R. Abnormal nocturnal melatonin secretion and disordered sleep in abstinent alcoholics // Biol Psychiatry. 2003. Vol.54. № 12. P. 1437–1443.
Cowen P.J., Bevan J.S., Gosden B., Elliott S.A. Treatment with beta-adrenoceptor blockers reduces plasma melatonin concentration // Br J Clin Pharmacol. 1985; Vol. 19. № 2. P. 258–260.
Rommel T., Demisch L. Influence of chronic beta-adrenoreceptor blocker treatment on melatonin secretion and sleep quality in patients with essential hypertension // J Neural Transm Gen Sect. 1994. Vol. 95. № 1. P. 39–48.
McIntyre I.M., Burrows G.D., Norman T.R. Suppression of plasma melatonin by a single dose of the benzodiazepine alprazolam in humans // Biol Psychiatry. 1988 Vol. 24. № 1. P. 108–112.
Murphy P.J., Badia P., Myers B.L. et al. Nonsteroidal anti-inflammatory drugs affect normal sleep patterns in humans // Physiol Behav. 1994. Vol. 55. № 6. P. 1063–1066.
Surrall K, Smith J.A., Bird H., Okala B. et al. Effect of ibuprofen and indomethacin on human plasma melatonin // J Pharm Pharmacol. 1987. Vol. 39. № 10. P. 840–843.
Gooley J.J., Chamberlain K., Smith K.A. et al. Exposure to room light before bedtime suppresses melatonin onset and shortens melatonin duration in humans // J Clin Endocrinol Metab. 2011. Vol.96. № 3. P. 463–472.
Reiter R.J., Tan D.X., Korkmaz A. et al. Light at night, chronodisruption, melatonin suppression, and cancer risk: a review // Crit Rev Oncog. 2007. Vol. 13 P. 303-328.
Możdżan M., Możdżan M., Chałubiński M. The effect of melatonin on circadian blood pressure in patients with type 2 diabetes and essential hypertension // Arch Med Sci. 2014. Vol. 29. № 4. P. 669-675.
Калинченко С.Ю., Тюзиков И.А. Дефицит мелатонина, ожирение и инсулинорезистентность: очевидные и неочевидные взаимосвязи // Вопросы диетологии. 2017. Т. 7. № 2. С. 23–32.
Anisimov V.N., Popovich I.G., Zabezhinski M.A.et al. Melatonin as antioxidant, geroprotector and anticarcinogen // Biochim Biophys Acta. 2006; Vol. 1757. № 5-6. P. 73-89.
Mazzoccoli G., Carughi S., De Cata A. et al. Melatonin and cortisol serum levels in lung cancer patients at different stages of disease // Med Sci Monit. 2005. №11. P. 284-288.
Lissoni P., Paolorossi F., Ardizzoia A. et al. A randomized study of chemotherapy with cisplatin plus etoposide versus chemoendocrine therapy with cisplatin, etoposide and the pineal hormone melatonin as a first-line treatment of advanced non-small cell lung cancer patients in a poor clinical state // J Pineal Res. 1997. Vol. 23. P. 15-19.
Lissoni P. Biochemotherapy with standard chemotherapies plus the pineal hormone melatonin in the treatment of advanced solid neoplasms // Pathol Biol (Paris). 2007. Vol. 55. P. 201-204.
Leon J., Acuna-Castroviejo D., Escames G. Et al. Melatonin mitigates mitochondrial malfunction // J. Pineal Res. 2005. Vol. 38. P. 1–9.
Luboshitzky R., Shen-Orr Z., Tzischichinsky O. Et al. Actigraphic sleep-wake patterns and urinary 6-sulfatoxymelatonin excretion in patients with Alzheimer’s disease // Chronobiol Int. 2001 Vol. 18. №3. P. 513-524.
Cardinali D.P., Vigo D. E., Olivar N. et al. Melatonin Therapy in Patients with Alzheimer’s Disease // Antioxidants (Basel) 2014. Vol. 3. № 2. P. 245–277.
Hughes R.J., Sack R.L., Lewy A.J. The role of melatonin and circadian phase in age-related sleep-maintenance insomnia: assessment in clinical trial of melatonin replacement // Sleep. 1998. Vol. 21. P. 52– 68.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin exretion in insomnia and its relation to the response to melatonin replacement therapy // Am j med. 2004. Vol. 116 № 2. P. 91– 95.
Ellis C. M., Lemmens G., Parkes D. Melatonin and insomnia // J. Sleep Res. 1996. Vol. 5. P. 61–65.
Полуэктов М.Г., Левин Я.И., Бойко А.Н. с соавт. Результаты российского мультицентрового исследования эффективности и безопасности мелаксена (мелатонин) для лечения нарушений сна у пациентов с хронической церебральной сосудистой недостаточностью // Журнал неврологии и психиатрии им. С.С. Корсакова. 2012. Т. 112. № 9. С. 26–31.
Andersen L.P., Gögenur I., Rosenberg J., Reiter R.J. The Safety of melatonin in humans // Clin. Drug Investig. 2016. Vol. 36. № 3. Р. 169–175.
Ferracioli-Oda E., Qawasmi A., Bloch M.H. Meta-analysis: melatonin for the treatment of primary sleep disorders // PLoS One. 2013. Vol. 8. № 5. ID e63773.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin excretion in insomnia and its relation to the response to melatonin replacement therapy // Am. J. Med. 2004. Vol.116. P. 91 – 95.
Attenburrow, M.E.J. Dowling B.A., Sharpley P.J. et al. Case-study of evening melatonin concentration in primary insomnia // Brit med j. 1996. Vol. 312. P. 1263 – 1264.
Тихомирова О.В., Бутырина Е.В., Зыбина Н.Н.. Фролова М.Ю. Оценка экскреции основного метаболита мелатонина в диагностике психофизиологической инсомнии / Медицинский алфавит. Современная лаборатория. 2013. №3. С. 46 – 52.
Lushington, K., Lack L., Kennaway D.J. et al. 6-Sulfatoxymelatonin excretion and self-reported sleep in good sleeping controls and 55-80-year-old insomniacs // J sleep res. 1998. Vol. 7. P. 75 – 83.
Lushington, K. Dawson D., Kennaway D.J. et al. The relationship between 6-sulphatoxymelatonin and polysomnographic sleep in good sleeping controls and wake maintence insomniacs, aged 55-80 years // J sleep res. 1999. Vol. 8. P. 57 – 64.
Hajak, G., Rodenbeck A., Staedt J. et al. Nocturnal plasma melatonin excretion in patients suffering from chronic primary insomnia // J. pineal res. 1995. Vol. 19. P. 116 – 122.
Тихомирова Ольга Викторовна
Заведующий отделом клинической неврологии и медицины сна
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Нарушение секреции мелатонина и эффективность заместительной терапии при расстройствах сна
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Гормон шишковидной железы мелатонин является предметом интенсивных исследований в связи с его многофункциональностью и широким терапевтическим потенциалом. В обзоре представлены данные о зависимости синтеза эндогенного мелатонина от времени суток, возраста, размеров шишковидной железы, освещенности, приема бета-блокаторов и ряда других медикаментов. Обсуждаются результаты исследований по нарушению секреции и эффективности использования экзогенного мелатонина при расстройствах цикла сон-бодрствование, инсомнии, нейродегенерации, сахарном диабете, онкологических заболеваниях.
Мелатонин, экскреция 6-сульфатоксимелатонина, терапия, нарушения сна
Melatonin Parasecretion and Replacement Therapy Efficacy at Sleep Disturbances
N.N. ZYBINA, О.V. TIKHOMIROVA
Nikiforov Russian Center of Emergency and Radiation Medicine, EMERCOM of Russia, Saint-Petersburg
Melatonin, pineal gland hormone, is a subject of active studies due to its multifunctional performance and wide therapeutic potential. The review presents data on dependence of endogenous melatonin synthesis on the time of day, age, pineal gland size, lighting conditions, administration of beta-blockers and a number of other medications. The article discusses the results of studies on parasecretion and efficacy of exogenous melatonin use at sleep-wake cycle disturbances, insomnia, neurodegeneration, diabetes mellitus and oncological diseases.
Key words: Melatonin, 6-Sulfatoxymelatonin excretion, therapy, sleep disorders.
Нарушение секреции мелатонина и эффективность заместительной терапии при расстройствах сна
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Мелатонин (N-ацетил-5-метокситриптамин) – вещество, открытое американским дерматологом А. Лернером. В организме позвоночных животных небольшие количества мелатонина выделяются сетчаткой глаз и значительные – некоторыми клетками слизистой кишечника, но главным источником системного мелатонина является эпифиз. Мелатонин синтезируется из незаменимой аминокислоты триптофана. Ритм его секреции эпифизом носит четко выраженный циркадианный характер. Уровень указанного гормона в крови начинает повышаться в вечернее время, совпадая с уменьшением уровня освещенности, достигает максимума в середине ночи (в 2–3 часа), затем прогрессивно уменьшается к утру. В дневное время секреция мелатонина остается на очень низком уровне. Циркадианный ритм выработки мелатонина эпифизом задается супрахиазматическим ядром таламуса (СХЯ) в зависимости от уровня освещенности 2.
Мелатонин выполняет функцию химического переносчика информации из циркадианного водителя ритма. Центральные мелатониновые рецепторы МТ1 и МТ2 сосредоточены преимущественно в СХЯ, в котором мелатонин действует по принципу обратной негативной связи. Кроме того, наличие МТ1 и МТ2 рецепторов в сосудах, адипоцитах, печени, поджелудочной железе определяет функции мелатонина в регуляции цикла сон-бодрствование и синхронизации наступления сна с изменением метаболических процессов и функционирования внутренних органов. Нарушение циркадианного ритма синтеза мелатонина приводит к развитию десинхроноза, который проявляется в рассогласовании суточных ритмов в работе различных функциональных систем и развитию целого ряда заболеваний.
В среднем, в организме взрослого человека синтезируется за день около 30 мг мелатонина. В крови человека более 80% циркулирующего мелатонина имеет эпифизарное происхождение. Период полужизни мелатонина в организме человека составляет, по разным данным, от 30 до 50 минут. Инактивация мелатонина происходит главным образом в печени, где под воздействием системы микросомальных окислительных ферментов он превращается в 6-оксимелатонин. Большая часть окисленного мелатонина выводится с мочой и калом в виде сульфатного конъюгата 6-сульфатоксимелатонина (6-оксиМТ).
В настоящее время в клинической лабораторной диагностике существуют методы с аналитическими характеристиками, позволяющими определять как содержания мелатонина в плазме и слюне, так и его производного 6-оксиМТ в моче. Вследствие выраженных почасовых колебаний уровня мелатонина в крови и быстром распаде мелатонина (период полувыведения не более 50 минут), объективная оценка содержания мелатонина возможна только при постановке катетера и многократном в течение суток заборе крови, что не может быть рекомендовано для широкого применения в клинической практике. В связи с этим наиболее широко в настоящее время применяется оценка содержания основного метаболита мелатонина 6-сульфатоксимелатонина в моче. Учитывая выраженную зависимость синтеза мелатонина от времени суток, принято оценивать концентрацию или экскрецию 6-оксиМТ отдельно в ночной и дневной порциях мочи.
Стандартизация преаналитического этапа определения метаболитов мелатонина в моче должна стать обязательной процедурой при использовании этого теста в диагностических целях. Данные об экскреции 6-СОМТ могут стать основанием для определения дополнительных показаний к назначению мелатонина при лечении инсомнии и других заболеваний. В оценке метаболизма мелатонина в клинической практике кроме уровня ночной экскреции его метаболитов важным может оказаться уровень дневной, ночной и вечерней экскреции и соотношение этих параметров.
Сложность в интерпретации полученных данных по экскреции мелатонина у пациентов связана с большим разбросом индивидуальных значений. Выраженные индивидуальные колебания уровня мелатонина среди здоровых испытуемых связывают с вариабельностью размеров шишковидной железы. Данные аутопсии выявили значительную вариабельность размеров шишковидной железы, достигающую 20-кратных различий между индивидуумами [3]. Такие же, значительные колебания в уровне секреции мелатонина отмечались многими исследователями у здоровых испытуемых 5. Исследование соотношения размеров шишковидной железы у 122 мужчин в возрасте 75 ± 2,2 лет с помощь МРТ и количеством 6-оксиМТ в утренней порции мочи выявило сильную корреляцию объема паренхимы с уровнем 6-оксиМТ, при значительной вариабельности как объема паренхимы (от 65 до 503 мм 3 ), так и концентрации мелатонина в утренней порции мочи (21 ± 16 нг/мл) [6]. Зависимости между секрецией мелатонина и наличием кист или кальцификатов в шишковидной железе выявлено не было. Единственным значимым для синтеза мелатонина явился объем паренхимы, состоящий из активных пинеалоцитов. В другом исследовании была выявлена значимая связь между объемом паренхимы и количеством 6-оксиМТ в суточной моче [7]. Важным выводом этих исследований явилось доказательство связи уровня секреции мелатонина с объемом паренхимы, а не объемом всей шишковидной железы, которая может включать как кисты, так и кальцификаты. Эта зависимость осталась значимой после исключения влияния возраста, наличия инсомнии, индекса массы тела.
Факторы, определяющие снижение синтеза мелатонина эпифизом
Возраст. Синтез мелатонина шишковидной железой быстро нарастает после рождения ребенка, достигая максимума к 2-4 годам. Резкое снижение синтеза мелатонина происходит в пубертатном периоде и затем отмечается медленное прогрессивное снижение синтеза мелатонина в течение жизни (рис. 1). Прогрессивное снижение синтеза мелатонина при нормальном старении связывают с уменьшением объема функционально активной шишковидной железы в связи с ее кальцифицированием, дегенерацией супрахиазматического ядра, гормональными перестройками в организме. Отмечается преимущественное снижение синтеза ночного мелатонина с достаточно большими индивидуальными колебаниями.
Рис. 1. Снижение синтеза мелатонина с возрастом
( Цит по Journal of anti-aging medicine; Pierpaoli W; 2(4):343-348 (1999)
Вредные привычки. Снижение уровня мелатонина выявлено у активных курильщиков [8]. Употребление алкоголя также снижает синтез мелатонина и вызывает нарушения сна [9].
Лекарственные средства. Многие лекарственные средства, широко используемые в современной медицине, значительно снижают синтез эндогенного мелатонина. В этот перечень входят бета-блокаторы [10, 11], бензодиазепины [12], нестероидные противовоспалительные средства [13,14]. Наиболее значимым для секреции мелатонина является прием бета-блокаторов, которые вызывают снижение секреции мелатонина до 50%. Именно снижение синтеза мелатонина является одной из важнейших причин развития инсомнии при приеме этих лекарственных средств.
Освещенность. Другим важным фактором, определяющим снижение синтеза мелатонина эпифизом является освещенность. При сохранении даже незначительного внешнего освещения в вечернее и ночное время (включенный компьютер, огни наружной рекламы, ночник) секреция мелатонина эпифизом будет нарушена. Оценка концентрации мелатонина в крови во время сна у здоровых волонтеров показала снижение синтеза мелатонина более чем на 50% при сне с сохраненным светом, по сравнению со сном в темноте. Выявлена также значимая разница в синтезе мелатонина в зависимости от интенсивности освещенности комнаты перед сном [15].
Характерная для современной жизни искусственная иллюминация в ночное время тормозит синтез эндогенного мелатонина. По данным многочисленных исследований прогрессивное увеличение освещенности в ночное время наносит серьезную угрозу здоровью жителям Земли. Нарушение циркадианной динамики синтеза мелатонина, связанное с освещенностью и работой в ночное время проявляется десинхронозами, которые повышают риск развития различных соматических, нейродегенеративных заболеваний и рака [1, 16].
Расстройства цикла «сон-бодрствование». Расстройства цикла «сон-бодрствование» включают синдром задержки фазы сна, синдром опережающей фазы сна, расстройство цикла «сон-бодрствование» при сменной работе и при смене часовых поясов (jet lag). Мелатонин играет ведущую роль в лечение этих расстройств сна.
Синдром задержки фазы сна – при этом расстройстве привычное время сна задерживается по отношению к желаемому и принятому в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на невозможность заснуть и трудности при пробуждении в желаемое или назначенное время суток. Позднее засыпание сопровождается мучительным утренним пробуждением и сонливостью в первую половину дня. Распространенность данного состояния максимальна среди подростков и составляет 7-16 %. Показана роль генетических факторов в развитии этого синдрома. Характерным является сдвиг синтеза эндогенного мелатонина на более позднее, чем в норме время. Лечение этого синдрома включает прием мелатонина за час до желаемого сна и использование фототерапии при пробуждении.
Синдром опережающей фазы сна – при этом нарушении привычное время сна наступает раньше, чем желаемое или принятое в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на сильную тягу ко сну в вечернее время и раннее окончательное пробуждение. Распространенность этого синдрома не превышает 1 % среди лиц среднего возраста. В лечении синдрома опережающей фазы сна используется хронотерапевтический подход.
Расстройство цикла «сон-бодрствование» при сменной работе – состояние, характеризующееся симптомами инсомнии и дневной сонливости, возникающее в связи со сменным графиком труда. Проявления расстройства зависят от графика труда. Необходимо соблюдать рекомендации по гигиене сна и организовывать максимально возможную продолжительность сна в условиях сменной работы. Медикаментозная терапия включает использование мелатонина при необходимости спать в дневное время, фототерапию и психостимуляторы для уменьшения сонливости при необходимости работать в ночное время.
Расстройство цикла «сон-бодрствование» при смене часовых поясов (jet lag) – это состояние, проявляющееся инсомнией, избыточной дневной сонливостью и нарушением дневного функционирования которые возникли при быстром перемещении через 2 и более часовых поясов. Причиной развития расстройства является возникшее несоответствие деятельности внутреннего пейсмейкера с локальным временем. Выраженность возникающего после перелета дискомфорта зависит от направления перелета, возраста, хронотипа. При перелете в восточном направлении возникают трудности засыпания, при перелете в западном направлении возникает необходимость ложиться спать позже, что переносится легче. Обычно симптомы держатся не более 2-3 дней, пока происходит адаптация к новому часовому поясу. При недостаточной адаптации к новым условиям рекомендуется использование Z-гипнотиков. Другим средством, облегчающим фазовый сдвиг, является мелатонин.
Заболевания, при которых доказана эффективность лечения мелатонином
Нейродегенерация и мелатонин. Многочисленные нейродегенеративные заболевания, среди которых наибольшее внимание приковано к болезни Паркинсона (БП) и болезни Альцгеймера (БА), сопровождаются различными нарушениями сна. Более того, дефицит сна имеет существенное значение для прогрессирования деменции, так как дренажная функция и удаление продуктов обмена из головного мозга, в том числе амилоида, происходит преимущественно во сне [24]. Прогрессирование нейродегенеративных заболеваний связано также с окислительным стрессом и дисфункцией митохондрий. Наличие у мелатонина выраженных антиоксидантных свойств, а также способности избирательно накапливаться в мембранах митохондрий, нормализуя их работу, рассматривается как ведущий механизм нейропротективного действия мелатонина при болезни Альцгеймера [25]. Исследования по изучению секреции мелатонина при БА малочисленны и свидетельствуют об отсутствии корреляции между БА, нарушением сна и уровнем секреции 6-оксиМТ [26]. В тоже время показано, что длительный (1-4 месяца) прием мелатонина в дозах от 3 до 9 мг способствует нормализации сна и имеет потенциальное положительное влияние на когнитивные функции при болезни Альцгеймера [27, 28].
Отдельного упоминания заслуживает нарушение сна в виде нарушения поведения в фазу быстрого сна. Расстройство поведения в фазу быстрого сна (РПБС) проявляется различной двигательной и речевой активностью. Двигательная активность варьирует от отдельных вздрагиваний до сложных агрессивных форм поведения с толканием, хватанием предметов, что может приводить к травматизации, как самого пациента, так и партнера по постели. Двигательная активность часто сопровождается речевой продукцией. В отличие от снохождения пациенты не покидают кровать, глаза их закрыты. Эпизоды возникают преимущественно во второй половине ночи, во время быстрого сна и характер двигательной и речевой продукции отражает характер сновидений.
Распространенность РПБС в популяции составляет 1-2 %, возникает преимущественно в возрасте старше 50 лет. Выделяют идиопатическое РПБС, и вторичное, развивающиеся у пациентов с синуклеинопатиями (болезнь Паркинсона, деменция с тельцами Леви, мультисистемная атрофия), аутоиммунными заболеваниями (нарколепсия, лимбический энцефалит), с очаговыми поражениями ствола мозга (инсульт, рассеянный склероз), при абстиненции и отмене ряда психотропных средств (антихолинергических и серотонинергических). Так как почти у всех пациентов с идиопатическим РПБС в дальнейшем развивается нейродегенеративное заболевание, эта категория РПБС тоже может быть отнесена к вторичным.
Препаратом выбора является клоназепам в дозе 0,5 – 2,0 мг за 30 минут до сна (уровень А). Клоназепам значительно снижает двигательную активность и травматизм, связанный с РПБС. Ограничениями для использования являются наличие деменции, нарушений походки и синдрома обструктивного апноэ сна, так как клоназепам будет усиливать эти проявления.
Мелатонин в дозе 3-12 мг может быть использован для лечения РПБС (уровень В). Его эффективность в контроле как первичного, так и ассоциированного с синуклеинопатиями РПБС меньше, чем у клоназепама, но больше, чем у других используемых средств. Мелатонин может быть препаратом выбора при лечении РПБС у пациентов с когнитивными расстройствами, нарушениями походки и синдромом обструктивного апноэ сна [29]. Мелатонин может назначаться как изолированно, так и в сочетании с клоназепамом.
Инсомния и мелатонин. Инсомния — повторные нарушения инициации, продолжительности, консолидации или качества сна, случающиеся, несмотря на наличие достаточного количества времени и условий для сна, и проявляющиеся нарушением дневной деятельности разного вида. Нарушения сна наряду с головными болями и дорсалгиями являются наиболее частыми жалобами при обращении к неврологу. По данным эпидемиологии, инсомния встречается у 28–45 % популяции и в половине случаев является важной проблемой требующей лечения. При этом 1,5–3 % популяции постоянно и 25–29 % эпизодически принимают снотворные препараты.
Наступление сна и его отдельных стадий связано с деятельностью сложной сети нервных структур, которая функционирует с помощью различных нейромедиаторных систем, среди которых важную роль отводят мелатонину. Эти представления позволяют предположить возможный дефицит эндогенного мелатонина у пациентов с инсомнией и обосновывают назначение экзогенного мелатонина.
В настоящее время имеется большое количество исследований свидетельствующих об эффективности использования мелатонина с целью улучшения качества и эффективности сна. Эффективность препаратов мелатонина при инсомнии подтверждена как в зарубежных, так и в отечественных исследованиях 31. Показано, что длительное применение не сопровождается снижением эффективности или развитием серьезных нежелательных явлений [34]. Проведение мета-анализа клинических испытаний применения экзогенного мелатонина [35] доказало его эффективность в лечении инсомнии. Были получены данные о значимом снижении времени наступления сна у пациентов с первичными расстройствами сна, получавшими экзогенный мелатонин по сравнению с группой плацебо.
Анисимов В.Н. Мелатонин: роль в организме, применение в клинике / Спб.: Изд-во «Система». 2007. 40 с.
Ковальзон В.М. Основы сомнологии: Физиология и нейрохимия цикла «бодрствование — сон» / М.: БИНОМ., Лаборатория знаний. 2012. 239 с.
Hasegawa A., Ohtsubo K., Mori W. Pineal gland in old age; quantitative and qualitative morphological study of 168 human autopsy cases // Brain Res. 1987. Vol.409. №2. P. 343–349.
Arendt J. Melatonin and human rhythms // Chronobiol Int. 2006. Vol.23. № 1–2. P. 21–37.
Bergiannaki J.D., Soldatos C.R., Paparrigopoulos T.J. et al. Low and high melatonin excretors among healthy individuals // J Pineal Res. 1995. Vol.18. № 3. P. 159–164.
Kunz D., Schmitz S., Mahlberg R. et al. A new concept for melatonin deficit: on pineal calcification and melatonin excretion // Neuropsychopharmacology. 1999. Vol. 21. № 6. P. 765–772.
Ozguner F., Koyu A., Cesur G. Active smoking causes oxidative stress and decreases blood melatonin levels // Toxicol Ind Health. 2005. Vol. 21. № 1-2. P. 21–26.
Kuhlwein E., Hauger R.L., Irwin M.R. Abnormal nocturnal melatonin secretion and disordered sleep in abstinent alcoholics // Biol Psychiatry. 2003. Vol.54. № 12. P. 1437–1443.
Cowen P.J., Bevan J.S., Gosden B., Elliott S.A. Treatment with beta-adrenoceptor blockers reduces plasma melatonin concentration // Br J Clin Pharmacol. 1985; Vol. 19. № 2. P. 258–260.
Rommel T., Demisch L. Influence of chronic beta-adrenoreceptor blocker treatment on melatonin secretion and sleep quality in patients with essential hypertension // J Neural Transm Gen Sect. 1994. Vol. 95. № 1. P. 39–48.
McIntyre I.M., Burrows G.D., Norman T.R. Suppression of plasma melatonin by a single dose of the benzodiazepine alprazolam in humans // Biol Psychiatry. 1988 Vol. 24. № 1. P. 108–112.
Murphy P.J., Badia P., Myers B.L. et al. Nonsteroidal anti-inflammatory drugs affect normal sleep patterns in humans // Physiol Behav. 1994. Vol. 55. № 6. P. 1063–1066.
Surrall K, Smith J.A., Bird H., Okala B. et al. Effect of ibuprofen and indomethacin on human plasma melatonin // J Pharm Pharmacol. 1987. Vol. 39. № 10. P. 840–843.
Gooley J.J., Chamberlain K., Smith K.A. et al. Exposure to room light before bedtime suppresses melatonin onset and shortens melatonin duration in humans // J Clin Endocrinol Metab. 2011. Vol.96. № 3. P. 463–472.
Reiter R.J., Tan D.X., Korkmaz A. et al. Light at night, chronodisruption, melatonin suppression, and cancer risk: a review // Crit Rev Oncog. 2007. Vol. 13 P. 303-328.
Możdżan M., Możdżan M., Chałubiński M. The effect of melatonin on circadian blood pressure in patients with type 2 diabetes and essential hypertension // Arch Med Sci. 2014. Vol. 29. № 4. P. 669-675.
Калинченко С.Ю., Тюзиков И.А. Дефицит мелатонина, ожирение и инсулинорезистентность: очевидные и неочевидные взаимосвязи // Вопросы диетологии. 2017. Т. 7. № 2. С. 23–32.
Anisimov V.N., Popovich I.G., Zabezhinski M.A.et al. Melatonin as antioxidant, geroprotector and anticarcinogen // Biochim Biophys Acta. 2006; Vol. 1757. № 5-6. P. 73-89.
Mazzoccoli G., Carughi S., De Cata A. et al. Melatonin and cortisol serum levels in lung cancer patients at different stages of disease // Med Sci Monit. 2005. №11. P. 284-288.
Lissoni P., Paolorossi F., Ardizzoia A. et al. A randomized study of chemotherapy with cisplatin plus etoposide versus chemoendocrine therapy with cisplatin, etoposide and the pineal hormone melatonin as a first-line treatment of advanced non-small cell lung cancer patients in a poor clinical state // J Pineal Res. 1997. Vol. 23. P. 15-19.
Lissoni P. Biochemotherapy with standard chemotherapies plus the pineal hormone melatonin in the treatment of advanced solid neoplasms // Pathol Biol (Paris). 2007. Vol. 55. P. 201-204.
Leon J., Acuna-Castroviejo D., Escames G. Et al. Melatonin mitigates mitochondrial malfunction // J. Pineal Res. 2005. Vol. 38. P. 1–9.
Luboshitzky R., Shen-Orr Z., Tzischichinsky O. Et al. Actigraphic sleep-wake patterns and urinary 6-sulfatoxymelatonin excretion in patients with Alzheimer’s disease // Chronobiol Int. 2001 Vol. 18. №3. P. 513-524.
Cardinali D.P., Vigo D. E., Olivar N. et al. Melatonin Therapy in Patients with Alzheimer’s Disease // Antioxidants (Basel) 2014. Vol. 3. № 2. P. 245–277.
Hughes R.J., Sack R.L., Lewy A.J. The role of melatonin and circadian phase in age-related sleep-maintenance insomnia: assessment in clinical trial of melatonin replacement // Sleep. 1998. Vol. 21. P. 52– 68.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin exretion in insomnia and its relation to the response to melatonin replacement therapy // Am j med. 2004. Vol. 116 № 2. P. 91– 95.
Ellis C. M., Lemmens G., Parkes D. Melatonin and insomnia // J. Sleep Res. 1996. Vol. 5. P. 61–65.
Полуэктов М.Г., Левин Я.И., Бойко А.Н. с соавт. Результаты российского мультицентрового исследования эффективности и безопасности мелаксена (мелатонин) для лечения нарушений сна у пациентов с хронической церебральной сосудистой недостаточностью // Журнал неврологии и психиатрии им. С.С. Корсакова. 2012. Т. 112. № 9. С. 26–31.
Andersen L.P., Gögenur I., Rosenberg J., Reiter R.J. The Safety of melatonin in humans // Clin. Drug Investig. 2016. Vol. 36. № 3. Р. 169–175.
Ferracioli-Oda E., Qawasmi A., Bloch M.H. Meta-analysis: melatonin for the treatment of primary sleep disorders // PLoS One. 2013. Vol. 8. № 5. ID e63773.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin excretion in insomnia and its relation to the response to melatonin replacement therapy // Am. J. Med. 2004. Vol.116. P. 91 – 95.
Attenburrow, M.E.J. Dowling B.A., Sharpley P.J. et al. Case-study of evening melatonin concentration in primary insomnia // Brit med j. 1996. Vol. 312. P. 1263 – 1264.
Тихомирова О.В., Бутырина Е.В., Зыбина Н.Н.. Фролова М.Ю. Оценка экскреции основного метаболита мелатонина в диагностике психофизиологической инсомнии / Медицинский алфавит. Современная лаборатория. 2013. №3. С. 46 – 52.
Lushington, K., Lack L., Kennaway D.J. et al. 6-Sulfatoxymelatonin excretion and self-reported sleep in good sleeping controls and 55-80-year-old insomniacs // J sleep res. 1998. Vol. 7. P. 75 – 83.
Lushington, K. Dawson D., Kennaway D.J. et al. The relationship between 6-sulphatoxymelatonin and polysomnographic sleep in good sleeping controls and wake maintence insomniacs, aged 55-80 years // J sleep res. 1999. Vol. 8. P. 57 – 64.
Hajak, G., Rodenbeck A., Staedt J. et al. Nocturnal plasma melatonin excretion in patients suffering from chronic primary insomnia // J. pineal res. 1995. Vol. 19. P. 116 – 122.
Тихомирова Ольга Викторовна
Заведующий отделом клинической неврологии и медицины сна
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Нарушение секреции мелатонина и эффективность заместительной терапии при расстройствах сна
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Гормон шишковидной железы мелатонин является предметом интенсивных исследований в связи с его многофункциональностью и широким терапевтическим потенциалом. В обзоре представлены данные о зависимости синтеза эндогенного мелатонина от времени суток, возраста, размеров шишковидной железы, освещенности, приема бета-блокаторов и ряда других медикаментов. Обсуждаются результаты исследований по нарушению секреции и эффективности использования экзогенного мелатонина при расстройствах цикла сон-бодрствование, инсомнии, нейродегенерации, сахарном диабете, онкологических заболеваниях.
Мелатонин, экскреция 6-сульфатоксимелатонина, терапия, нарушения сна
Melatonin Parasecretion and Replacement Therapy Efficacy at Sleep Disturbances
N.N. ZYBINA, О.V. TIKHOMIROVA
Nikiforov Russian Center of Emergency and Radiation Medicine, EMERCOM of Russia, Saint-Petersburg
Melatonin, pineal gland hormone, is a subject of active studies due to its multifunctional performance and wide therapeutic potential. The review presents data on dependence of endogenous melatonin synthesis on the time of day, age, pineal gland size, lighting conditions, administration of beta-blockers and a number of other medications. The article discusses the results of studies on parasecretion and efficacy of exogenous melatonin use at sleep-wake cycle disturbances, insomnia, neurodegeneration, diabetes mellitus and oncological diseases.
Key words: Melatonin, 6-Sulfatoxymelatonin excretion, therapy, sleep disorders.
мм 3 ), так и концентрации мелатонина в утренней порции мочи (21 ± 16 нг/мл) [6]. Зависимости между секрецией мелатонина и наличием кист или кальцификатов в шишковидной железе выявлено не было. Единственным значимым для синтеза мелатонина явился объем паренхимы, состоящий из активных пинеалоцитов. В другом исследовании была выявлена значимая связь между объемом паренхимы и количеством 6-оксиМТ в суточной моче [7]. Важным выводом этих исследований явилось доказательство связи уровня секреции мелатонина с объемом паренхимы, а не объемом всей шишковидной железы, которая может включать как кисты, так и кальцификаты. Эта зависимость осталась значимой после исключения влияния возраста, наличия инсомнии, индекса массы тела.
Факторы, определяющие снижение синтеза мелатонина эпифизом
Возраст. Синтез мелатонина шишковидной железой быстро нарастает после рождения ребенка, достигая максимума к 2-4 годам. Резкое снижение синтеза мелатонина происходит в пубертатном периоде и затем отмечается медленное прогрессивное снижение синтеза мелатонина в течение жизни (рис. 1). Прогрессивное снижение синтеза мелатонина при нормальном старении связывают с уменьшением объема функционально активной шишковидной железы в связи с ее кальцифицированием, дегенерацией супрахиазматического ядра, гормональными перестройками в организме. Отмечается преимущественное снижение синтеза ночного мелатонина с достаточно большими индивидуальными колебаниями.
Рис. 1. Снижение синтеза мелатонина с возрастом
( Цит по Journal of anti-aging medicine; Pierpaoli W; 2(4):343-348 (1999)
Вредные привычки. Снижение уровня мелатонина выявлено у активных курильщиков [8]. Употребление алкоголя также снижает синтез мелатонина и вызывает нарушения сна [9].
Лекарственные средства. Многие лекарственные средства, широко используемые в современной медицине, значительно снижают синтез эндогенного мелатонина. В этот перечень входят бета-блокаторы [10, 11], бензодиазепины [12], нестероидные противовоспалительные средства [13,14]. Наиболее значимым для секреции мелатонина является прием бета-блокаторов, которые вызывают снижение секреции мелатонина до 50%. Именно снижение синтеза мелатонина является одной из важнейших причин развития инсомнии при приеме этих лекарственных средств.
Освещенность. Другим важным фактором, определяющим снижение синтеза мелатонина эпифизом является освещенность. При сохранении даже незначительного внешнего освещения в вечернее и ночное время (включенный компьютер, огни наружной рекламы, ночник) секреция мелатонина эпифизом будет нарушена. Оценка концентрации мелатонина в крови во время сна у здоровых волонтеров показала снижение синтеза мелатонина более чем на 50% при сне с сохраненным светом, по сравнению со сном в темноте. Выявлена также значимая разница в синтезе мелатонина в зависимости от интенсивности освещенности комнаты перед сном [15].
Характерная для современной жизни искусственная иллюминация в ночное время тормозит синтез эндогенного мелатонина. По данным многочисленных исследований прогрессивное увеличение освещенности в ночное время наносит серьезную угрозу здоровью жителям Земли. Нарушение циркадианной динамики синтеза мелатонина, связанное с освещенностью и работой в ночное время проявляется десинхронозами, которые повышают риск развития различных соматических, нейродегенеративных заболеваний и рака [1, 16].
Расстройства цикла «сон-бодрствование». Расстройства цикла «сон-бодрствование» включают синдром задержки фазы сна, синдром опережающей фазы сна, расстройство цикла «сон-бодрствование» при сменной работе и при смене часовых поясов (jet lag). Мелатонин играет ведущую роль в лечение этих расстройств сна.
Синдром задержки фазы сна – при этом расстройстве привычное время сна задерживается по отношению к желаемому и принятому в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на невозможность заснуть и трудности при пробуждении в желаемое или назначенное время суток. Позднее засыпание сопровождается мучительным утренним пробуждением и сонливостью в первую половину дня. Распространенность данного состояния максимальна среди подростков и составляет 7-16 %. Показана роль генетических факторов в развитии этого синдрома. Характерным является сдвиг синтеза эндогенного мелатонина на более позднее, чем в норме время. Лечение этого синдрома включает прием мелатонина за час до желаемого сна и использование фототерапии при пробуждении.
Синдром опережающей фазы сна – при этом нарушении привычное время сна наступает раньше, чем желаемое или принятое в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на сильную тягу ко сну в вечернее время и раннее окончательное пробуждение. Распространенность этого синдрома не превышает 1 % среди лиц среднего возраста. В лечении синдрома опережающей фазы сна используется хронотерапевтический подход.
Расстройство цикла «сон-бодрствование» при сменной работе – состояние, характеризующееся симптомами инсомнии и дневной сонливости, возникающее в связи со сменным графиком труда. Проявления расстройства зависят от графика труда. Необходимо соблюдать рекомендации по гигиене сна и организовывать максимально возможную продолжительность сна в условиях сменной работы. Медикаментозная терапия включает использование мелатонина при необходимости спать в дневное время, фототерапию и психостимуляторы для уменьшения сонливости при необходимости работать в ночное время.
Расстройство цикла «сон-бодрствование» при смене часовых поясов (jet lag) – это состояние, проявляющееся инсомнией, избыточной дневной сонливостью и нарушением дневного функционирования которые возникли при быстром перемещении через 2 и более часовых поясов. Причиной развития расстройства является возникшее несоответствие деятельности внутреннего пейсмейкера с локальным временем. Выраженность возникающего после перелета дискомфорта зависит от направления перелета, возраста, хронотипа. При перелете в восточном направлении возникают трудности засыпания, при перелете в западном направлении возникает необходимость ложиться спать позже, что переносится легче. Обычно симптомы держатся не более 2-3 дней, пока происходит адаптация к новому часовому поясу. При недостаточной адаптации к новым условиям рекомендуется использование Z-гипнотиков. Другим средством, облегчающим фазовый сдвиг, является мелатонин.
Заболевания, при которых доказана эффективность лечения мелатонином
Нейродегенерация и мелатонин. Многочисленные нейродегенеративные заболевания, среди которых наибольшее внимание приковано к болезни Паркинсона (БП) и болезни Альцгеймера (БА), сопровождаются различными нарушениями сна. Более того, дефицит сна имеет существенное значение для прогрессирования деменции, так как дренажная функция и удаление продуктов обмена из головного мозга, в том числе амилоида, происходит преимущественно во сне [24]. Прогрессирование нейродегенеративных заболеваний связано также с окислительным стрессом и дисфункцией митохондрий. Наличие у мелатонина выраженных антиоксидантных свойств, а также способности избирательно накапливаться в мембранах митохондрий, нормализуя их работу, рассматривается как ведущий механизм нейропротективного действия мелатонина при болезни Альцгеймера [25]. Исследования по изучению секреции мелатонина при БА малочисленны и свидетельствуют об отсутствии корреляции между БА, нарушением сна и уровнем секреции 6-оксиМТ [26]. В тоже время показано, что длительный (1-4 месяца) прием мелатонина в дозах от 3 до 9 мг способствует нормализации сна и имеет потенциальное положительное влияние на когнитивные функции при болезни Альцгеймера [27, 28].
Отдельного упоминания заслуживает нарушение сна в виде нарушения поведения в фазу быстрого сна. Расстройство поведения в фазу быстрого сна (РПБС) проявляется различной двигательной и речевой активностью. Двигательная активность варьирует от отдельных вздрагиваний до сложных агрессивных форм поведения с толканием, хватанием предметов, что может приводить к травматизации, как самого пациента, так и партнера по постели. Двигательная активность часто сопровождается речевой продукцией. В отличие от снохождения пациенты не покидают кровать, глаза их закрыты. Эпизоды возникают преимущественно во второй половине ночи, во время быстрого сна и характер двигательной и речевой продукции отражает характер сновидений.
Распространенность РПБС в популяции составляет 1-2 %, возникает преимущественно в возрасте старше 50 лет. Выделяют идиопатическое РПБС, и вторичное, развивающиеся у пациентов с синуклеинопатиями (болезнь Паркинсона, деменция с тельцами Леви, мультисистемная атрофия), аутоиммунными заболеваниями (нарколепсия, лимбический энцефалит), с очаговыми поражениями ствола мозга (инсульт, рассеянный склероз), при абстиненции и отмене ряда психотропных средств (антихолинергических и серотонинергических). Так как почти у всех пациентов с идиопатическим РПБС в дальнейшем развивается нейродегенеративное заболевание, эта категория РПБС тоже может быть отнесена к вторичным.
Препаратом выбора является клоназепам в дозе 0,5 – 2,0 мг за 30 минут до сна (уровень А). Клоназепам значительно снижает двигательную активность и травматизм, связанный с РПБС. Ограничениями для использования являются наличие деменции, нарушений походки и синдрома обструктивного апноэ сна, так как клоназепам будет усиливать эти проявления.
Мелатонин в дозе 3-12 мг может быть использован для лечения РПБС (уровень В). Его эффективность в контроле как первичного, так и ассоциированного с синуклеинопатиями РПБС меньше, чем у клоназепама, но больше, чем у других используемых средств. Мелатонин может быть препаратом выбора при лечении РПБС у пациентов с когнитивными расстройствами, нарушениями походки и синдромом обструктивного апноэ сна [29]. Мелатонин может назначаться как изолированно, так и в сочетании с клоназепамом.
Инсомния и мелатонин. Инсомния — повторные нарушения инициации, продолжительности, консолидации или качества сна, случающиеся, несмотря на наличие достаточного количества времени и условий для сна, и проявляющиеся нарушением дневной деятельности разного вида. Нарушения сна наряду с головными болями и дорсалгиями являются наиболее частыми жалобами при обращении к неврологу. По данным эпидемиологии, инсомния встречается у 28–45 % популяции и в половине случаев является важной проблемой требующей лечения. При этом 1,5–3 % популяции постоянно и 25–29 % эпизодически принимают снотворные препараты.
Наступление сна и его отдельных стадий связано с деятельностью сложной сети нервных структур, которая функционирует с помощью различных нейромедиаторных систем, среди которых важную роль отводят мелатонину. Эти представления позволяют предположить возможный дефицит эндогенного мелатонина у пациентов с инсомнией и обосновывают назначение экзогенного мелатонина.
В настоящее время имеется большое количество исследований свидетельствующих об эффективности использования мелатонина с целью улучшения качества и эффективности сна. Эффективность препаратов мелатонина при инсомнии подтверждена как в зарубежных, так и в отечественных исследованиях 33. Показано, что длительное применение не сопровождается снижением эффективности или развитием серьезных нежелательных явлений [34]. Проведение мета-анализа клинических испытаний применения экзогенного мелатонина [35] доказало его эффективность в лечении инсомнии. Были получены данные о значимом снижении времени наступления сна у пациентов с первичными расстройствами сна, получавшими экзогенный мелатонин по сравнению с группой плацебо.
Анисимов В.Н. Мелатонин: роль в организме, применение в клинике / Спб.: Изд-во «Система». 2007. 40 с.
Ковальзон В.М. Основы сомнологии: Физиология и нейрохимия цикла «бодрствование — сон» / М.: БИНОМ., Лаборатория знаний. 2012. 239 с.
Hasegawa A., Ohtsubo K., Mori W. Pineal gland in old age; quantitative and qualitative morphological study of 168 human autopsy cases // Brain Res. 1987. Vol.409. №2. P. 343–349.
Arendt J. Melatonin and human rhythms // Chronobiol Int. 2006. Vol.23. № 1–2. P. 21–37.
Bergiannaki J.D., Soldatos C.R., Paparrigopoulos T.J. et al. Low and high melatonin excretors among healthy individuals // J Pineal Res. 1995. Vol.18. № 3. P. 159–164.
Kunz D., Schmitz S., Mahlberg R. et al. A new concept for melatonin deficit: on pineal calcification and melatonin excretion // Neuropsychopharmacology. 1999. Vol. 21. № 6. P. 765–772.
Ozguner F., Koyu A., Cesur G. Active smoking causes oxidative stress and decreases blood melatonin levels // Toxicol Ind Health. 2005. Vol. 21. № 1-2. P. 21–26.
Kuhlwein E., Hauger R.L., Irwin M.R. Abnormal nocturnal melatonin secretion and disordered sleep in abstinent alcoholics // Biol Psychiatry. 2003. Vol.54. № 12. P. 1437–1443.
Cowen P.J., Bevan J.S., Gosden B., Elliott S.A. Treatment with beta-adrenoceptor blockers reduces plasma melatonin concentration // Br J Clin Pharmacol. 1985; Vol. 19. № 2. P. 258–260.
Rommel T., Demisch L. Influence of chronic beta-adrenoreceptor blocker treatment on melatonin secretion and sleep quality in patients with essential hypertension // J Neural Transm Gen Sect. 1994. Vol. 95. № 1. P. 39–48.
McIntyre I.M., Burrows G.D., Norman T.R. Suppression of plasma melatonin by a single dose of the benzodiazepine alprazolam in humans // Biol Psychiatry. 1988 Vol. 24. № 1. P. 108–112.
Murphy P.J., Badia P., Myers B.L. et al. Nonsteroidal anti-inflammatory drugs affect normal sleep patterns in humans // Physiol Behav. 1994. Vol. 55. № 6. P. 1063–1066.
Surrall K, Smith J.A., Bird H., Okala B. et al. Effect of ibuprofen and indomethacin on human plasma melatonin // J Pharm Pharmacol. 1987. Vol. 39. № 10. P. 840–843.
Gooley J.J., Chamberlain K., Smith K.A. et al. Exposure to room light before bedtime suppresses melatonin onset and shortens melatonin duration in humans // J Clin Endocrinol Metab. 2011. Vol.96. № 3. P. 463–472.
Reiter R.J., Tan D.X., Korkmaz A. et al. Light at night, chronodisruption, melatonin suppression, and cancer risk: a review // Crit Rev Oncog. 2007. Vol. 13 P. 303-328.
Możdżan M., Możdżan M., Chałubiński M. The effect of melatonin on circadian blood pressure in patients with type 2 diabetes and essential hypertension // Arch Med Sci. 2014. Vol. 29. № 4. P. 669-675.
Калинченко С.Ю., Тюзиков И.А. Дефицит мелатонина, ожирение и инсулинорезистентность: очевидные и неочевидные взаимосвязи // Вопросы диетологии. 2017. Т. 7. № 2. С. 23–32.
Anisimov V.N., Popovich I.G., Zabezhinski M.A.et al. Melatonin as antioxidant, geroprotector and anticarcinogen // Biochim Biophys Acta. 2006; Vol. 1757. № 5-6. P. 73-89.
Mazzoccoli G., Carughi S., De Cata A. et al. Melatonin and cortisol serum levels in lung cancer patients at different stages of disease // Med Sci Monit. 2005. №11. P. 284-288.
Lissoni P., Paolorossi F., Ardizzoia A. et al. A randomized study of chemotherapy with cisplatin plus etoposide versus chemoendocrine therapy with cisplatin, etoposide and the pineal hormone melatonin as a first-line treatment of advanced non-small cell lung cancer patients in a poor clinical state // J Pineal Res. 1997. Vol. 23. P. 15-19.
Lissoni P. Biochemotherapy with standard chemotherapies plus the pineal hormone melatonin in the treatment of advanced solid neoplasms // Pathol Biol (Paris). 2007. Vol. 55. P. 201-204.
Leon J., Acuna-Castroviejo D., Escames G. Et al. Melatonin mitigates mitochondrial malfunction // J. Pineal Res. 2005. Vol. 38. P. 1–9.
Luboshitzky R., Shen-Orr Z., Tzischichinsky O. Et al. Actigraphic sleep-wake patterns and urinary 6-sulfatoxymelatonin excretion in patients with Alzheimer’s disease // Chronobiol Int. 2001 Vol. 18. №3. P. 513-524.
Cardinali D.P., Vigo D. E., Olivar N. et al. Melatonin Therapy in Patients with Alzheimer’s Disease // Antioxidants (Basel) 2014. Vol. 3. № 2. P. 245–277.
Hughes R.J., Sack R.L., Lewy A.J. The role of melatonin and circadian phase in age-related sleep-maintenance insomnia: assessment in clinical trial of melatonin replacement // Sleep. 1998. Vol. 21. P. 52– 68.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin exretion in insomnia and its relation to the response to melatonin replacement therapy // Am j med. 2004. Vol. 116 № 2. P. 91– 95.
Ellis C. M., Lemmens G., Parkes D. Melatonin and insomnia // J. Sleep Res. 1996. Vol. 5. P. 61–65.
Полуэктов М.Г., Левин Я.И., Бойко А.Н. с соавт. Результаты российского мультицентрового исследования эффективности и безопасности мелаксена (мелатонин) для лечения нарушений сна у пациентов с хронической церебральной сосудистой недостаточностью // Журнал неврологии и психиатрии им. С.С. Корсакова. 2012. Т. 112. № 9. С. 26–31.
Andersen L.P., Gögenur I., Rosenberg J., Reiter R.J. The Safety of melatonin in humans // Clin. Drug Investig. 2016. Vol. 36. № 3. Р. 169–175.
Ferracioli-Oda E., Qawasmi A., Bloch M.H. Meta-analysis: melatonin for the treatment of primary sleep disorders // PLoS One. 2013. Vol. 8. № 5. ID e63773.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin excretion in insomnia and its relation to the response to melatonin replacement therapy // Am. J. Med. 2004. Vol.116. P. 91 – 95.
Attenburrow, M.E.J. Dowling B.A., Sharpley P.J. et al. Case-study of evening melatonin concentration in primary insomnia // Brit med j. 1996. Vol. 312. P. 1263 – 1264.
Тихомирова О.В., Бутырина Е.В., Зыбина Н.Н.. Фролова М.Ю. Оценка экскреции основного метаболита мелатонина в диагностике психофизиологической инсомнии / Медицинский алфавит. Современная лаборатория. 2013. №3. С. 46 – 52.
Lushington, K., Lack L., Kennaway D.J. et al. 6-Sulfatoxymelatonin excretion and self-reported sleep in good sleeping controls and 55-80-year-old insomniacs // J sleep res. 1998. Vol. 7. P. 75 – 83.
Lushington, K. Dawson D., Kennaway D.J. et al. The relationship between 6-sulphatoxymelatonin and polysomnographic sleep in good sleeping controls and wake maintence insomniacs, aged 55-80 years // J sleep res. 1999. Vol. 8. P. 57 – 64.
Hajak, G., Rodenbeck A., Staedt J. et al. Nocturnal plasma melatonin excretion in patients suffering from chronic primary insomnia // J. pineal res. 1995. Vol. 19. P. 116 – 122.
Тихомирова Ольга Викторовна
Заведующий отделом клинической неврологии и медицины сна
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Нарушение секреции мелатонина и эффективность заместительной терапии при расстройствах сна
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Гормон шишковидной железы мелатонин является предметом интенсивных исследований в связи с его многофункциональностью и широким терапевтическим потенциалом. В обзоре представлены данные о зависимости синтеза эндогенного мелатонина от времени суток, возраста, размеров шишковидной железы, освещенности, приема бета-блокаторов и ряда других медикаментов. Обсуждаются результаты исследований по нарушению секреции и эффективности использования экзогенного мелатонина при расстройствах цикла сон-бодрствование, инсомнии, нейродегенерации, сахарном диабете, онкологических заболеваниях.
Мелатонин, экскреция 6-сульфатоксимелатонина, терапия, нарушения сна
Melatonin Parasecretion and Replacement Therapy Efficacy at Sleep Disturbances
N.N. ZYBINA, О.V. TIKHOMIROVA
Nikiforov Russian Center of Emergency and Radiation Medicine, EMERCOM of Russia, Saint-Petersburg
Melatonin, pineal gland hormone, is a subject of active studies due to its multifunctional performance and wide therapeutic potential. The review presents data on dependence of endogenous melatonin synthesis on the time of day, age, pineal gland size, lighting conditions, administration of beta-blockers and a number of other medications. The article discusses the results of studies on parasecretion and efficacy of exogenous melatonin use at sleep-wake cycle disturbances, insomnia, neurodegeneration, diabetes mellitus and oncological diseases.
Key words: Melatonin, 6-Sulfatoxymelatonin excretion, therapy, sleep disorders.