горячий лед что это такое
Какое вещество называют горячий лед и можно ли его получить в домашних условиях?
Само по себе выражение «горячий лед» с трудом укладывается в наших головах. Ведь мы привыкли, что лед, неважно, маленький это кубик в стакане или огромный айсберг в океане, ледяной. А тут почему-то горячий. Разберемся, что же это за вещество, как получается и проведем опыт в домашних условиях. Итак — горячий лед.
Вещество с таким названием
Все прекрасно знают, что лед — это вода, находящаяся в твердом агрегатном состоянии, в которое переходит уже при 0 °C. Но, проводя опыты над водой, английский физик Бриджмен обнаружил, что под большим давлением происходит перестройка кристаллической решетки, она становится более плотной.

Под давлением чуть меньше 21 тыс. атмосфер вода становится льдом уже при температуре +76 °C. А при 30 тыс. атмосфер — при 180 °C! Вот это действительно горячий лед. Обжечься можно сильно. Но прикоснуться к нему невозможно, ведь такое давление выдержать человеку нереально. Физики изучают свойства такого льда лишь косвенно.
Благодаря опытам англичанин определил, что лед бывает нескольких сортов, где под сортом I находится всем знакомый лед, образованный при нуле, и дальше, с возрастанием давления, переходит из одного сорта в другой. При 30 тыс. атмосфер он становится сортом VII. Так как кристаллическая решетка изменяется, то и свойства у горячего льда другие. Он тяжелее воды и его плотность составляет 1,05 г/см3.
Еще одно вещество с таким названием
Провести в домашних условиях эксперимент «Горячий лед», чтобы проверить теорию Бриджмена, естественно, не получится. Но химия как наука предлагает вам другой опыт, не менее эффектный.
Формула и уравнение реакции
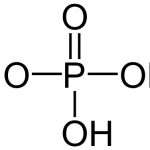
Ацетат натрия (еще ее называют натриевой солью уксусной кислоты) представляет собой белые кристаллы со слегка солоноватым вкусом и запахом, который напоминает уксусный. Его формула — CH3COONa. В лаборатории соль получают из уксусной кислоты и карбонатов, гидроксида или гидрокарбоната натрия.
Кому интересно, уравнение реакции следующее:
CH3COOH + NaHCO3 → CH3-COON a + H2O + CO2
Хозяйки знают, что процент уксусной кислоты может быть разным. Но нет разницы, какой вы найдете в шкафчике на кухне, просто понадобится разное количество соды. Пропорции следующие:
В результате реакции у нас получается раствор, но путем выпаривания воды мы получим 82 г ацетата натрия в виде кристаллов.
Химия — наука, которая не терпит варианта «насыпать на глаз». Если хотите, чтобы химический опыт «Горячий лед» удался, составляйте пропорцию из веществ с помощью весов. Более точными являются электронные.
Опыт в домашних условиях
Так как при проведении опыта используется кислота, а эксперимент «Горячий лед» требует еще и нагревания до высоких температур, то присутствие взрослых обязательно. Итак, приступим к колдовству.
Готовим «Горячий лед» в домашних условиях.
Прикоснитесь к охлажденному вареву зубочисткой, опущенной острием в поваренную соль. Если все сделано правильно, раствор начнет затвердевать, образуя рисунок из кристаллов, похожих на льдинки, каждый раз новый и неповторимый. При этом высвобождается большое количество энергии, которую вы прочувствуете как волну тепла.
Почему не получился эксперимент? Работа над ошибками
Вариантов, почему не получился опыт, не так и много, но рассмотрим их все:
Где используют эту реакцию?
Сам опыт «Горячий лед» имеет и практическое применение, в химических грелках и обогревателях используется именно перенасыщенный раствор, который даже при комнатной температуре, как вы сами видели, не переходит в твердую фазу.
Только в грелках вы воздействуете на раствор не зубочисткой, а специальным диском (чаще всего металлическим). В процессе перехода перенасыщенного раствора в твердую фазу выделяется от 264 до 289 кДж/кг. Так у вас образовывался «горячий» лед, а грелка действует на тело выделяемым теплом, при этом ожег исключен, так как выделяемой температуры недостаточно.
Кстати, как источник тепла, перенасыщенный раствор ацетата натрия используют и в некоторых моделях скафандров. «Горячий лед» рулит.
Состояния воды в природе: условия перехода, необычные факты
Удивительная вода: Freepick
Известные человечеству состояния воды не ограничиваются тремя базовыми вариантами, о которых большинство слышало в школе. Как создать горячий лед или сухую воду? Возможно ли наблюдать воду сразу жидкой, твердой и газообразной? Как на эти и многие другие вопросы отвечает наука?
Три состояния воды в природе
Воду как прозрачную жидкость, у которой отсутствует запах и вкус, знают все. Но только ли такой она бывает? Прежде чем ответить на вопрос о том, каковы возможные агрегатные состояния воды, выясним, что такое агрегатное состояние.
В физике под этим понятием подразумевают состояние вещества, обусловленное определенной температурой и давлением. Науке известно:
При этом одно и то же вещество может менять свое состояние в зависимости от условий окружающей среды.
Хорошо известны три агрегатных состояния воды:
Состояние воды прямо связано с температурой. Эта жидкость обладает уникальным свойством: свое жидкое состояние она сохраняет в широком диапазоне от 0 до 100 °С. В верхней точке начинается закипание с постепенным переходом в газообразную фазу. При снижении температуры ниже 0 °С происходит образование льда.
При этом в природе можно часто увидеть, как вода и лед соседствуют друг с другом, а в этом время над ними витает невидимый глазу водяной пар. Благодаря таким удивительным способностям воды происходит ее постоянный круговорот в природе.
Жидкое состояние воды: Freepick
Если рассматривать все три состояния воды, то жидкое остается одним из наиболее важных. Жидкая вода служит универсальным растворителем для множества других веществ, является основным компонентом организма человека и средой для протекания всех химических процессов.
Более того, именно у жидкой воды ученым удалось обнаружить дополнительные состояния — «обычная» и «аномальная» вода. Последняя образуется при температуре –63 °С и может находиться в одном из двух состояний:
Две эти жидкости заметно различаются по свойствам, а их плотность отличается на 20%, поэтому они не могут смешиваться между собой. Как ученым удалось уловить эти состояния, ведь хорошо известно, что происходит с водой при замерзании: она переходит в твердую фазу — в лед?
Авторам исследования понадобились специальные приборы. С помощью инфракрасного лазера лед нагревали, при этом образовывалась жидкая вода с высокой плотностью, а давление сохраняли повышенным.
За этим процессом вели наблюдение рентгеновским лазером. Было замечено образование пузырьков «аномальной» воды. Появлялись они на крайне маленький промежуток времени: были видны до 3-х микросекунд.
Эти исследования доказали, что ученым еще далеко не все известно о воде, хотя мы и сталкиваемся с ней ежедневно и ежечасно. Ее свойства продолжают изучать и открывать новые грани.
Состояния воды: необычные факты
Твердое состояние воды (лед): Freepick
Ученым оказалось недостаточно трех агрегатных состояний воды, поэтому они изобрели целый ряд необычных вариантов и продолжают работать в этом направлении.
Лед VII (горячий лед)
Для обычного холодного льда используется обозначение «лед Ih». Когда при нормальном давлении снижается температура и вода замерзает, то атомы кислорода в ее молекулах образуют шестигранники.
Если же давление будет возрастать, то можно получить лед VII, атомы которого располагаются в виде куба. Он очень противоречив:
Ученым удалось создать такой лед в лаборатории. Кроме того, он был обнаружен в алмазах, которые нашли в недрах нашей планеты.
Сухая вода
Ее получают путем смешивания обычной воды и двуокиси кремния. Несмотря на то что жидкости в ней 25%, она является сухим веществом. Сахарообразные крупинки внутри содержат воду, а сверху покрыты оксидом кремния.
Сухую воду создали в 1968 для нужд косметологии. Затем о ней забыли, а сейчас рассматривают варианты использования для поглощения углекислого газа, чтобы хранить и транспортировать химикаты.
Сверхзвуковой лед
Этот лед также называют льдом XVIII. Он образуется при очень сильном повышении давления и температурных показателей — до тысяч градусов и миллионов атмосфер. В горячем плотном и черном на виде веществе узнать лед очень трудно.
Получить его экспериментально удалось совсем недавно с применением мощных лазеров, которые создавали ударные волны, мгновенно повышая температуру и давление. При этом происходило разделение атомов водорода и кислорода с параллельным образованием твердых кристаллов.
Сверхкритическая вода
Вода может стать такой из газообразного состояния. Это очень странный пар, который нельзя назвать газом. Образование такой воды происходит при 373 °С и давлении 220 бар. Снова жидкой она уже стать не может. Такая вода способна проходить сквозь твердые вещества, как газы, и быть растворителем подобно жидкости.
Аморфный лед
Этот лед получается при мгновенном охлаждении воды, когда молекулы не кристаллизуются, как следует. Получается своеобразное стекло — очень медленно движущаяся жидкость.
На нашей планете аморфный лед встречается редко, а вот на просторах Вселенной вода часто существует в этом состоянии.
Тройная точка воды
В этой точке вещество одновременно существует как твердое, жидкое и газообразное. Такое специфическое равновесие достигается путем сочетания показаний давления и температуры. Для воды они составляют 0,01 °С и 0,0060366 атмосфер.
Эта точка применяется, когда определяется температура по Кельвину, калибруются термометры и определяются тройные точки для других жидкостей. Из тройной точки воду можно перевести в любое из ее возможных агрегатных состояний.
Горящий лед
Это не чистая вода, а сочетание воды и метана, которое способно гореть, словно бумага. Такой лед образуется в результате естественных процессов в океанских глубинах, в зонах вечной мерзлоты, может засорить нефтепровод или газопровод.
Таковы обычные и нестандартные состояния воды. Природа отменно поработала, чтобы создать такое чудо, но и ученые не остались в стороне. Они до сих пор работают над получением воды в уникальных состояниях.
Узнавайте обо всем первыми
Подпишитесь и узнавайте о свежих новостях Казахстана, фото, видео и других эксклюзивах.
Горячий лёд — химический опыт в домашних условиях

В нашем обычном представлении, мы привыкли думать, что лед – это обязательно холод. Также в голове не укладывается, как лед может получиться при комнатной температуре, а уж тем более как он может быть «горячим».
На самом деле в этом нет ничего сверхъестественного и магического. Более того, «горячий лед» можно сделать даже дома. Все что нам необходимо – это небольшие знания химии и физические аспекты.
Как бы ни было странно – но обычная вода может превратиться в горячий лед!
Один английский физик Перси Уильямс Бриджмен доказал, что при огромном давлении вода сможет перейти в кристаллическое соединение, при чем температура будет намного выше привычного для нас льда (0 ◦ С). Для этого ему пришлось использовать давлением равное 20 600 атмосфер, а температура при которой вода находилась в твердом состоянии была равной 76 ◦ С. Если бы мы могли взять в руки это лед, то получили бы ожоги.
Но поговорим о том, как же получить «горячий лед» при комнатной температуре и атмосферном давлении из реагентов, которые есть практически в каждом доме. Но тут обычной водой нам не обойтись =)
Что нам понадобится:
В химии есть такой химический опыт — реакция «горячий лед». Говоря химическим языком, это получение ацетата натрия (CH3COONa), соль натрия уксусной кислоты. Его можно получить различными способами и методами (или даже просто купить в хим. магазине). Но самый простой способ, доступный дома, это реакция уксусной кислоты (CH3COOH) и пищевой соды (NaHCO3).
Следует учитывать, что уксус, который мы покупаем в магазине может быть разной концентрации, а следовательно и количество соды пойдет разное.
— для 200 мл. 70% уксусной кислоты нужно 210 г соды
— для 200 мл. 30% уксусной кислоты нужно 87,4 г соды
— для 200 мл. 9% уксусной кислоты нужно 25,25 г соды
Практика показывает, что количество соды надо брать чуть меньше, потому что выход этой реакции примерно 88-90 %. Происходит это потому, что в результате выделения СО2 улетучивается и часть уксусной кислоты. Также было бы хорошо использовать электронные весы.
После проведенных расчетов можно приступать к самому процессу получения горячего льда. В кастрюлю выливаем уксусную кислоту. Порциями добавляем соду, тщательно перемешивая. Ждем прекращения выделения пузырьков. (P.S. процесс очень долгий и запах не из лучших. По возможности, советуем работать с вытяжкой или на открытом воздухе). После завершения выделения газов, ставим смесь на плитку и варим, чтоб испарить лишнюю влагу. Процесс необходимо все время контролировать! Выпаривать воду нужно до тех пор, пока по краю кастрюли не начнут появляться белые кристаллы. Тем самым мы получим перенасыщенный раствор ацетата натрия.
Продолжительность варки зависит от концентрации уксусной кислоты. Чем концентрация выше – тем быстрее испариться лишняя влага. После этого сразу снимаем нашу смесь с плиты и даем чуть-чуть остыть. На поверхности раствора должна появиться корка, как бы лед.
Если не появляется – то варим еще немного. После этого берем горячую, кипяченную воду и порциями при постоянном перемешивании добавляем в нашу смесь до тех пор, пока вся корка не растает, а раствор не станет однородным. (P.S. воды понадобиться совсем немного, поэтому не спишите добавлять сразу много воды, а лучше тщательнее перемешивайте.) Затем переливаем нашу смесь в баночку или другой сосуд и помещаем в холодильник до охлаждения хотя бы до комнатной температуры. В холодильник необходимо помещать для того, чтобы смесь не кристаллизовалось за то время, пока остывает. После этого охлажденный раствор достаем из холодильника. Добавляем туда щепотку поваренной соли. При хорошем соблюдении инструкции и пропорций должно получиться так :
На глазах раствор кристаллизуется. Если же этого не произошло, то раствор необходимо выпаривать еще. После удачного опыта раствор можно использовать повторно. Для этого наш лед необходимо нагреть в водяной бане до образования однородного раствора.
А затем снова охладить.
 masterok
masterok
Мастерок.жж.рф
Хочу все знать
Исследования английского физика Бриджмена показали, что под весьма значительным давлением вода переходит в так называемый горячий лед и остается такой при температуре значительно выше 0 градусов. Бриджмен показал, что может существовать лед не одного сорта, а нескольких. Если быть точными то шести. Горячий лед, получается под чудовищным давлением в 20600 атмосфер и остается твердым при температуре 76 градусов Цельсия.
Горячий лед обжог бы нам пальцы, если бы мы могли до него дотронуться. Но прикосновение к нему невозможно; горячий лед образуется под давлением мощного пресса в толстостенном сосуде из лучшей стали. Увидеть его или взять в руки нельзя, и свои свойства горячий лед открывает физикам лишь косвенным образом.
Под весьма значительным давлением вода переходит в так называемый горячий лед.
Любопытно, что горячий лед плотнее обыкновенного, плотнее воды: его удельный вес 1,05. Он тонет в воде, между тем как обыкновенный, холодный лед на ней плавает.
Описанный выше горячий лед вряд ли получился бы в домашних условиях. Но, все-таки, можно попробовать заморозить лед, не доводя его до температуры замерзания и, таким образом, получить горячий лед. Следуя дальнейшим инструкциям, вы можете приготовить вещество, которое будет похоже на лед, используя компоненты, купленные в магазине или найденные дома.
Чтобы приготовить горячий лед, найдите немного тригидрата ацетата натрия и растворите его как можно больше в горячей, практически кипящей воде. Для этого возьмите ацетат натрия и высыпьте его в кастрюлю. Для начала должно хватить около одного стакана. Оставьте немного его про запас, чтобы использовать в качестве затравочного кристалла.
Чтобы приготовить горячий лед, нужно перенасытить воду ацетатом натрия, поэтому не следует наливать слишком много воды – чем меньше вы ее нальете, тем гуще получится раствор и тем лучше получатся кристаллы.
Доведите раствор практически до кипения. Постоянно помешивайте его. Именно в этот момент вы фактически растворяете кристаллы тригидрата ацетата натрия. Раствор должен стать настолько густым, чтобы порошок больше не растворялся и на дне кастрюли остался небольшой осадок. Если порошок полностью растворился, и на дне ничего нет, продолжайте добавлять в воду ацетат натрия пока раствор не дойдет до такого состояния, когда он уже не может полностью растворить порошок.
После этого раствор вылейте в посудину любых размеров таким образом, чтобы осадок от нерастворимого порошка не попал в посудину и остался в кастрюле и поместите посудину с раствором в морозилку на 30–60 минут. Обычно растворенные кристаллы снова начали бы кристаллизироваться, но так как мы получили ацетат натрия в перенасыщенном растворе, он переохлаждается, то есть его температура опускается ниже обычной температуры кристаллизации без самого процесса кристаллизации.
Как только вы прикоснетесь к раствору зубочисткой с небольшим количеством ацетата натрия на ней, он затвердеет, образовывая горячий лед. От него должно исходить тепло. Это происходит из-за высвобождения энергия при образовании кристаллов.
Один пользователь сомневается в безопасности и вот что он говорит:









 masterok
masterok