госпитальная хирургия что это
Госпитальная хирургия что это
Классическим клиническим показанием к хирургическому лечению пациента является тяжелая стенокардия, резистентная к медикаментозной терапии. Однако тяжесть клинических проявлений не всегда коррелирует с тяжестью поражения коронарного русла. Кроме того, современная медикаментозная терапия обладает высокой эффективностью за счет резкого снижения потребления миокардом кислорода и воздействия на ряд патогенетических звеньев формирования синдрома «грудной жабы».
Основными анатомическими показаниями являются:
Виды операций при ИБС [1,9]
A. Непрямые методы реваскуляризации
B. Прямые методы реваскуляризации
Непрямые методы реваскуляризации
Возникли на заре коронарной хирургии и были связаны с отсутствием искусственного кровообращения, способного защитить организм и миокард от ишемии. Вместе с тем, ряд методик применяются и в настоящее время при невозможности, по каким-либо причинам, осуществить прямую реваскуляризацию. [ 2, с.55]
Первые операции были направлены на ликвидацию болевого синдрома, снижения основного обмена или на фиксацию к миокарду органов и тканей, богатых кровеносными сосудами и коллатералями.
Симпатэктомия. Это хирургическая операция, задачей которой является прекращение передачи нервного импульса по симпатическим нервным волокнам, расположенным в адвентиции сосудистой стенки. Эта идея была высказана 100 лет назад французским физиологом Франсуа-Франком, предположившим, что резекция шейно-грудных симпатических ганглиев может привести к устранению стенокардии. На практике эта идея была реализована в 1916 г. Т. Jonnesco. [2, с.55]
Кардиопексии. Наибольшее распространение получили операции непрямой реваскуляризации миокарда, направленные на создание дополнительного источника кровоснабжения сердца. Впервые Л. Moritz и С. Hudson в 1932 г. предложили в этих целях использовать перикард. Beck С. в 1935 г. выполнил скарификацию эпикарда, полагая, что в результате образования сращений между перикардом и эпикардом произойдет прорастание перикардиальных сосудов в миокард. Наибольшее распространение получил метод S. Thompson, который заключается в распылении талька в полости перикарда с целью образования сращений. Эти вмешательства были названы кардиоперикардиопексией. Однако этот вид хирургического метода лечения ИБС не получил широкого распространения.
В 1937 г. L. O’Shaughnessy впервые использовал тканевой трансплантат для реваскуляризации миокарда. Он подшил к эпикарду лоскут большого сальника на ножке. Эта операция, названная оментокардиопексией, привела к разработке целого ряда подобных методов. С целью создания дополнительного источника кровоснабжения сердца хирурги использовали ткань легкого, грудные мышцы, медиастинальный жир, кожный лоскут и даже участок тонкой кишки. [2, с.55]
Операция Фиески. Это операция двусторонней перевязки внутренних грудных артерий (ВГА), предложенная итальянским хирургом D. Fieschi в 1939 г. По мнению автора, перевязка ВГА тотчас ниже отхождения перикардодиафрагмальной ветви усиливает кровоток по этой артерии, имеющей анастомозы с ветвями коронарных артерий. [2, с.56]
Автор с успехом провёл операцию на больной стенокардией. Затем это вмешательство было забыто и только после 50-х гг. возрождено М. Баттезати. [3, с.71]
Операция Вайнберга. Занимает промежуточную позицию между непрямыми и прямыми методами реваскуляризации миокарда и заключается в имплантации кровоточащего дистального конца внутренней грудной артерии в толщу миокарда, что приводит вначале к формированию внутримиокардиальной гематомы, а в последующем к развитию анастомозов между ВГА и ветвями коронарных артерий. Основным недостатком метода Вайнберга являлось отсутствие немедленного эффекта реваскуляризации. [4, с.537]
Прямые методы реваскуляризации
С середины 50-х годов при ишемической болезни сердца хирурги начали использовать способы прямой реваскуляризации. Под операциями прямой реваскуляризации миокарда принято понимать прямые вмешательства на коронарных артериях. Первым таким вмешательством была коронарная эндартерэктомия (ЭАЭ). [2, с.56]
Коронарная эндартерэктомия. Пионером ее стал американский хирург С. Bailey. Он разработал три методики ЭАЭ: прямую, антеградную и ретроградную – через устья коронарных артерий в условиях искусственного кровобращения. С. Bailey разработал также специальный инструментарий для осуществления этой процедуры, в том числе микрокюретки для коронарных артерий. [2, с.56]
Эндартерэктомия заключается в удалении внутреннего слоя стенки артериального сосуда, включающей атеросклеротически измененную интиму и часть медии, и была разработана на периферических артериях в 1948 году Дос Сантосом. Эндартерэктомия нередко осложнялась тромбозом коронарной артерии с развитием ИМ, и летальность при этих вмешательствах была очень высока. Эта процедура сохранила известное значение до настоящего времени. При диффузном поражении коронарных артерий иногда приходится выполнять ЭАЭ в сочетании с АКШ. [4, с.537]
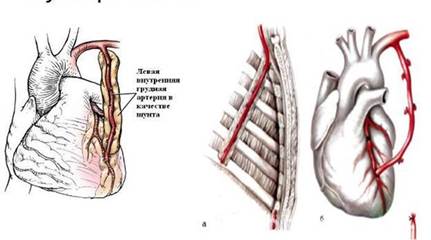
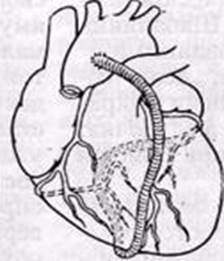
Маммарно-коронарное шунтирование. В 1964 г., русский хирург В. И. Колесов выполнил первую в мире успешную операцию маммарно-коронарного анастомоза (МКА). В настоящее время приоритет В.И. Колесова признан во всем мире, и знаменитый американский хирург D. Eggeer назвал его пионером коронарной хирургии. Колесов В.И. накладывал МКА без использования искусственного кровообращения, на работающем сердце. [2, с.57] ( Рис. 1)
Рис. 1. Грудовенечный анастомоз по Колёсову
Основные этапы операции:
1) доступ к сердцу, осуществляемый обычно путем срединной стернотомии;
2) выделение ВГА; забор аутовенозных трансплантатов, выполняемый другой бригадой хирургов одновременно с производством стернотомии;
3) канюляция восходящей части аорты и полых вен и подключение ИК;
4) пережатие восходящей части аорты с кардиоплегической остановкой сердца;
5) наложение дистальных анастомозов с коронарными артериями;
6) снятие зажима с восходящей части аорты;
7) профилактика воздушной эмболии;
8) восстановление сердечной деятельности;
9) наложение проксимальных анастомозов;
12) ушивание стернотомического разреза с дренированием полости перикарда.
Внутреннюю грудную артерию выделяют на лоскуте или скелетизируют. (Рис. 2) Преимущество скелетизированной ВГА заключается в ее большей длине. В то же время при выделении ВГА на лоскуте уменьшается риск травматизации стенки сосуда. Для удобства при выделении ВГА используют специальный ретрактор. С целью снятия сосудистого спазма в просвет ВГА вводят раствор папаверина и окутывают ВГА салфеткой, смоченной так же раствором папаверина. Операцию проводят в условиях умеренно гипотермического ИК (28-30°С). [2, с.59]
— большее соответствие диаметров внутренней грудной и коронарной артерии;
— анастомоз накладывают между однородными тканями;
— вследствие небольшого диаметра внутренней грудной артерии объемный кровоток по ней меньше, чем по аутовенозному шунту, но линейная скорость больше, что теоретически должно снизить частоту возникновения тромбозов;
— нужно накладывать только один анастомоз, что сокращает время операции;
— внутренняя грудная артерия редко поражается атеросклерозом.
Ограничения применения метода:
— имеются только две внутренние грудные артерии, что ограничивает возможность реваскуляризации нескольких артерий;
— выделение внутренней грудной артерии является более сложной процедурой.
Рис. 2. маммарно-коронарное шунтирование
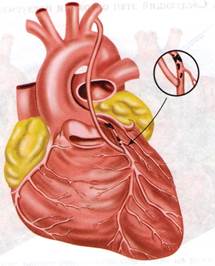
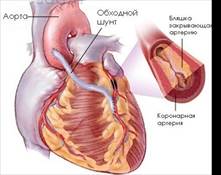
Аортокоронарное шунтирование. Идея создать обходной шунт между аортой или системной артерией и коронарным сосудом в обход пораженного и суженного атеросклерозом участка клинически была реализована Рене Фавалоро в 1967 г. Ранее, в 1962 г., Дэвид Сабистон (Дьюкский университет), используя в качестве сосудистого протеза большую подкожную вену, наложил шунт между аортой и коронарной артерией. Однако сообщение об этой операции появилось в 1973 г., т. е. через 9 лет. [5, с.533]
Аортокоронарное шунтирование ( Рис. 3) относится к разряду эффективных операций при хирургическом лечении ишемической болезни сердца. Операцию аортокоронарного шунтирования сегментом большой подкожной вены бедра выполняют в условиях искусственного кровообращения. Оперативный доступ: чаще срединная продольная стернотомия, которая позволяет подойти к нисходящим ветвям правой и левой коронарных артерий. Операцию начинают с выделения коронарной артерии, перевязки её выше места окклюзии. Накладывают дистальный артериовенозный анастомоз. Следующий этап операции предусматривает наложение проксимального аортовенозного анастомоза путём бокового отжатия восходящей аорты, в которой иссекают овальное отверстие диаметром 1*0,3см, и накладывают анастомоз «конец в бок». Кроме большой подкожной вены бедра, применяют внутреннюю грудную, лучевую, нижнюю надчревную аутоартерии. При множественном поражении коронарных артерий выполняют несколько шунтов (от 2 до 6). [ 6, с.179]
Рис. 3. Аортокоронарное шунтирование
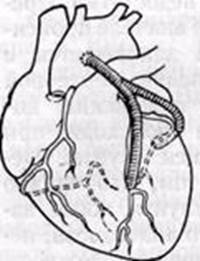
Существует несколько технических вариантов коронарного шунтирования (Рис. 4, 5) :
1. «Змеевидный» или секвенциальный шунт
Так называют шунт с последовательными анастомозами, то есть посредством одного трансплантата шунтируют несколько коронарных артерий или коронарную артерию на двух уровнях. При этом накладывают последовательные анастомозы «бок в бок» между трансплантатом и реваскуляризируемым сосудом и один дистальный анастомоз «конец в бок». Описаны случаи шунтирования одним аутовенозным трансплантатом до 5 коронарных артерий. Оптимальным вариантом является шунтирование двух, максимум трех ветвей с помощью одного трансплантата.
Его создают путем вшивания проксимального анастомоза одного из шунтов в бок другому. Используется при значительном истончении стенки восходящей части аорты или при небольшой площади аорты и большом количестве реваскуляризированных сосудов. [2, с.59]
Рис. 4 У-образный шунт
Рис.5 «Змеевидный» или секвенциальный шунт
Коронарное стентирование. Это операция, позволяющая восстановить кровоток в коронарных артериях путём имплантации стентов в месте сужения коронарной артерии. Стент – внутрисосудистый протез для поддержания стенки пораженного сосуда и сохранения диаметра его просвета. Конструкция стента представляет собой тонкий сетчатый каркас из инертного металлического сплава высочайшего качества, раскрываемый баллоном внутри сосуда до нужного диаметра. [2, с.79]
· Металлический стент (Bare Metal Stent) – внутрисосудистый протез из нержавеющей стали или кобальт-хромового сплава. Использование металлических стентов связано с риском тромбоза в первые 30 дней и требует двойной антитромбоцитарной терапии в течении 1 месяца, а также 20-30% риском рестеноза (повторного сужения сосуда) в течение 6-9 месяцев после имплантации.
· Стент с лекарственным антипролиферативным покрытием — внутрисосудистый протез из кобальт-хромового сплава с покрытием, высвобождающее лекарственное вещество, препятствующее повторному сужению сосуда. Лекарственный слой в последствии растворяется.
Техника стентирования коронарных артерий. ( Рис. 6)
На стадии коронарографии определяется характер, месторасположение и степень сужения коронарных артерий, после чего переходят к операции.
Под рентгеноскопическим контролем стент подводится к стенозу, после чего хирург раздувает баллон, на который одет стент, шприцом с манометром (индефлятором) до определенного давления. Баллон раздувается, стент расширяется и вдавливается во внутреннюю стенку, тем самым образуя жесткий каркас. Для полной уверенности в том, что стент полностью расправлен, баллон раздувается несколько раз. Затем баллон сдувается и удаляется из артерии вместе с проводником и катетером. Стент остается и сохраняет просвет сосуда. В зависимости от протяженности поражения артерии могут использоваться один или несколько стентов. [2, с.79]
Рис. 6. Этапы стентирования артерии
Несмотря на низкую частоту осложнений, проведение коронарного стентирования сопряжено с определенным риском.
Основные осложнения, встречающиеся при проведении стентирования, — это цереброваскулярные (0,22%), сосудистые (от 2%), летальный исход (1,27%). Основным фактором, лимитирующим эффективность коронарного стентирования, является процесс рестенозирования. Рестеноз – повторное сужение просвета сосуда, приводящее к снижению кровотока. In-stent рестеноз – повторное сужение просвета коронарного сосуда внунтри стента.
Факторами риска рестеноза являются:
— генетическая предрасположенность к повышенной пролиферации неоинтимы;
— параметры пораженного сегмента: диаметр сосуда, длина повреждение, тип стеноза;
— особенности течения процедуры: протяженность повреждения сосуда, остаточная диссекция, количество имплантируемых стентов, диаметр стента и соотношение его площади с поверхностью сосуда. [2, с.79]
Баллонная ангиопластика коронарных артерий. В последние 10—15 лет в лечении ИБС используют реваскуляризацию миокарда путем транслюминальной балонной дилатации (ангиопластики) стенозированных венечных артерий. В кардиологическую практику метод был внедрен в 1977 г. A. Gruntzig. Показанием к ангиопластике венечных артерий у больных ИБС служит гемодинамически значимое поражение коронарной артерии в ее проксимальных отделах при условии отсутствия выраженного кальциноза и поражения дистального русла этой артерии. [5, с. 532]
Для выполнения ангиопластики венечных артерий используют систему двух катетеров: катетер-проводник и дилатационный катетер. После выполнения коронарографии обычным методом ангиографический катетер заменяют катетером-проводником, через который проводят дилатационный катетер в стенозированную венечную артерию. Максимальный диаметр баллончика 3—3,7 мм при его наполнении, в спавшемся состоянии его диаметр составляет 1,2— 1,3 мм. Катетер проводят в стенозированную артерию. Дистальнее области стеноза антеградное давление в артерии падает и тем самым фиксируется перфузионное давление дистальнее стеноза (за счет коллатерального кровотока). При достижении баллончиком стенозированного сегмента последний под давлением 5 атм. заполняют 30% раствором контрастного вещества. В таком состоянии баллончик находится в течение 5—60 с, после чего его опорожняют и вновь измеряют перфузионное давление ниже стеноза. При необходимости баллончик можно наполнить несколько раз. Уменьшение градиента давления служит основным ориентиром для прекращения процедуры. Повторный ангиографический контроль позволяет определить степень остаточного стеноза.
Основным критерием успеха считается уменьшение степени стеноза после ангиопластики более чем на 20%. По сводным данным национального института сердца, легких и крови (США), суммарный положительный результат баллонной дилатации коронарных артерий достигается примерно у 65% больных. Вероятность успеха при этой процедуре возрастает у больных молодого возраста с непродолжительным анамнезом стенокардии и при проксимальных поражениях артерий.
Основными осложнениями ангиопластики венечных артерий являются
· острый инфаркт миокарда (5,3%)
· окклюзия коронарной артерии (4,6%)
· спазм коронарной артерии (4,5%)
· фибрилляция желудочков (1,8%)
Клинический эффект ангиопластики венечных артерий заключается в исчезновении или значительном урежении приступов стенокардии примерно у 80% больных с успешным результатом процедуры, в повышении толерантности к физическим нагрузкам более чем у 90%, улучшении сократительной способности миокарда и его перфузии. [5, с. 532]
История
Госпитальная хирургическая клиника медицинского факультета Московского университета была открыта в Ново-Екатерининской больнице в г.Москве осенью 1846 года и предназначалась для занятий со студентами. В хирургической клинике было 110 коек, за год пролечивали около 650 больных, а штат состоял из 1 профессора, 1 помощника-адъюнкта и 2 ассистентов.
Первым заведующим кафедрой госпитальной хирургии с 1846 по 1859 год стал директор клиники профессор Андрей Иванович Поль (1794—1864). Выпускник Санкт-Петербургской Медико-хирургической академии, твердый последователь пироговских принципов преподавания госпитальной хирургии он давал студентам большую свободу в изучении хирургии, обучал накладывать гипс, шины, привлекал к участию в операциях по литотомии и обработке ран и обладая высокой хирургической техникой лично показывал студентам, как нужно делать операции. В клинике он выполнял перевязку сосудов при аневризме общей сонной артерии, наружной подвздощной артерии, выделение эхинококка из забрюшинной клетчатки, резекцию нижней челюсти и др.операции. А.И.Поль первым в г. Москве применил хлороформенный наркоз при операции в декабре 1847 г.
С 1859 по 1868 год клинику и кафедру возглавлял доктор медицины(1854), профессор (1859) Александр Петрович Попов (1816—1885). Выпускник Московской Медико-хирургической академии, постоянный и верный помощник А.И.Поля он активно обучал студентов практической хирургии, выполнял камнесечение, ампутации, грыжесечение, трахеотомию, гинекологические операции. Студенты широко привлекались для ассистирования на операциях, перевязках. Впервые в России, при А.П.Попове, после удаления раковых опухолей на лице выполнялись пластические операции.
С 1868 по 1891 год кафедру госпитальной хирургии возглавлял доктор медицины, профессор(1859) Иван Николаевич Новацкий(1825-1902). Выпускник медицинского факультета Московского университета(1852),работал военным хирургом под руководством Н.И.Пирогова в Крымскую кампанию(1853-1856гг.) с 1860г.постоянный помощник А.П.Попова в хирургической госпитальной клинике. Внёс большой вклад в применение в московских больницах принципов асептики и антисептики в хирургии, подчеркивал связь гигиены и хирургии, значение профилактического метода в медицине. Предложил проект строительства клинического городка медицинского факультета на Девичьем поле в Москве в связи с ростом числа студентов на медицинском факультете.
Пётр Александрович Герцен ( 1871-1947 ) руководил кафедрой госпитальной хирургии с 1934 по 1947 год. Медицинское образование получил в Университетах г.Лозанна и и Базель(Швейцария). В 1897 г. П.А.Герцен поступил вольнослушателем на V курс медицинского факультета Московского университета. В декабре 1898 года П. А. Герцен получил российский диплом лекаря с отличием сдав государственные экзамены за весь университетский курс. Работал врачом в Старо-Екатерининской больнице, где приобрел большой практический опыт в хирургии. В годы русско-японской войны (1904-1905) –военный хирург на маньчжурском фронте. В 1909 году П.А.Герцен защитил вторую докторскую диссертацию и с 1910 года избран приват-доцентом факультетской хирургической клиники Московского университета. В годы Первой мировой войны— хирург в действующей армии. В 1919 году П. А. Герцен был избран на должность заведующего кафедрой оперативной хирургии 1-го Московского государственного университета, которая оказалась вакантной после ухода профессора Ф. А. Рейна, где переработал программу по оперативной хирургии, положив в её основу физиологическое обоснование применяемых хирургических методов лечения. В 1921 году Пётр Александрович избирается заведующим кафедрой общей хирургии 1-го Московского государственного университета и директором Института для лечения опухолей. В 1926 году П.И.Герцена избирают председателем Хирургического общества Москвы, а в 1929 году — председателем XXI съезда российских хирургов. После кончины профессора А. В. Мартынова в 1934 году П.А.Герцен стал заведующим кафедрой госпитальной хирургии 1-го Московского медицинского института, которой и руководил до конца жизни. П. А. Герцен написал около 100 научных работ, в их числе 5 монографий. Среди них особое значение имеют работы «К вопросу о технике холецистэнтеростомии» (1903), «Хирургическое лечение травматических аневризм» (1911), «Введение в клинику хирургических форм рака» (1930), «Рак молочной железы» (1930), «О кровотечениях» (1940)..П.А. Герценом было предложено 16 оригинальных способов и модификаций хирургических операций. Хирург широкого диапазона, П.А. Герцен внёс весомый вклад в изучение и разработку проблем хирургического лечения заболеваний органов брюшной полости, кровеносных сосудов, а также онкологических, урологических и кардиохирургических проблем. Он получил широкую известность после публикации своих работ «Переломы черепа у детей», «О нагноениях при брюшном тифе», «О шве сердца при его ранении».
П.А.Герцен один из организаторов и руководителей онкологической помощи в стране, создал научную хирургическую школу.
В связи с болезнью П.А.Герцена с 1940 по 1946 год работой клиники фактически руководил ученик П.А.Герцена профессор Пётр Григорьевич Мелихов (1898-1946) талантливый хирург, прошедший путь от ординатора до профессора кафедры госпитальной хирургии.
Всеволод Эрастович Салищев ( 1886-1960 ) руководил кафедрой госпитальной хирургии с 1948 по 1956 год. Выпускник медицинского факультета Московского университета (1913). Занимал пост приват-доцента по кафедре хирургии Московского университета. В годы Первой мировой войны В.Э. Салищев был призван на военную службу, был хирургом в военном госпитале в Москве, затем преподавал хирургию в Московском университете. В 1930 г.стал основателем и первым руководителем кафедры хирургии в Ивановском мединституте. В 1935 г. ему были присуждены ученая степень доктора мед. наук и звание профессора. С 1935 по 1941 г. заведовал кафедрой факультетской хирургической клиники 3-го ММИ. С 1942 по 1948 г.— профессор кафедры факультетской хирургической клиники, а с 1948 по 1956 г.— заведующий госпитальной хирургической клиникой и одновременно проректор 1-го ММИ по науке. В.Э.Салищев внёс большой вклад в совершенствование учебно-педагогического процесса, максимально приблизив его к постели больного. Разработал методики преподавания хирургии и подготовки врачей хирургов. Опубликовал руководства для студентов «Клинические занятия по хирургии», и «Вопросы частной хирургии». Научные труды посвящены вопросам истории хирургии, военно-полевой хирургии, нейрохирургии, переливанию крови в хирургии, хирургии желудка и желчных путей, вопросам предоперационной подготовки и послеоперационного ведения больных.
Б.В.Петровский- организатор и директор (1963—1988) Всесоюзного научного центра хирургии АМН СССР( РНЦХ) объединил работу кафедры госпитальной хирургии и клинического научно-исследовательского центра под девизом: « Лечить, учить, искать, внедрять достижения науки в практику» Б. В. Петровский автор свыше 500 научных работ, в том числе около 40 монографий. Создал одну из крупнейших научных хирургических школ (более 150 докторов наук). Основные направления, которые разрабатывались под руководством Б.В.Петровского: сердечно-сосудистая и эндоваскулярная хирургия, хирургия пищевода, хирургия заболеваний легких и средостения, эндоскопия, хирургия печени и желчных путей, траснсплантация органов, микрохирургия(в т.ч.пластическая),анестезиология и реаниматология, клиническая физиология, гипербарическая медицина, хирургическая медицинская техника.
Юрий Викторович Бирюков (род. 1937 ) руководил кафедрой госпитальной хирургии с 1988 по 2002 год. Выпускник 2-го МГМИ им.Н.И.Пирогова. Ученик Б.В.Петровского, с 1967 г. работал на кафедре госпитальной хирургии в должности ассистента, доцента, профессора кафедры. Защитил докторскую диссертацию(1982), руководил отделением хирургии легких и средостения Научного центра хирургии (1982-1988). Лауреат премии Совета Министров СССР (1986).Автор около 250 научных работ по проблемам торакальной хирургии. Под руководством Ю.В.Бирюкова защищено 27 докторских и кандидатских диссертаций.
Впервые в России Ю. В. Белов выполнил операции аортокоронарного шунтирования шести и семи коронарных артерий сердца, одномоментные операции на коронарных артериях сердца, на грудной и торако-абдоминальной аорте при ее аневризме, протезирование дуги аорты, операции по протезированию всей аорты.