гси в медицине что это
Внутрибольничные инфекции в родовспомогательных учреждениях
Опубликовано в журнале:
Сестринское дело »» №5-6 1998 Ежегодно в Российской Федерации регистрируется от 50 до 60 тысяч случаев внутрибольничных инфекций. В истекшем году было зарегистрировано 48,6 тысячи заболевших.
Как и в предыдущие годы, в общей структуре гнойно-септические инфекции (ГСИ), возникающие в родовспомогательных учреждениях, занимают первое место и составляют до 45% от общего числа зарегистрированных случаев внутрибольничных инфекций. Официальной регистрации подлежат ГСИ, возникающие среди новорожденных и родильниц, к которым прежде всего относятся такие тяжелые инфекции бактериальной природы, как бактериальный менингит, сепсис, остеомиелит новорожденных, а также перитонит, сепсис, эндометрит у рожениц.
В условиях работы родовспомогательного учреждения следует учитывать, что большинство возбудителей ВБИ относятся к условно-патогенным микроорганизмам, проявляющим свои свойства на фоне снижения неспецифических защитных сил организма. На этом фоне важное значение приобретает определение групп риска среди новорожденных и рожениц.
Распространению внутрибольничных инфекций способствует многообразие возбудителей (более 300 видов), формирование госпитальных штаммов, обладающих высокой устойчивостью к неблагоприятным факторам окружающей среды, в том числе к ультрафиолетовому излучению, высушиванию, лекарственной устойчивостью.
К группам риска среди рожениц относятся прежде всего женщины с хроническими соматическими и инфекционными заболеваниями, болезнями мочеполовой системы, с отягощенным акушерско-гинекологическим анамнезом (инфекционные осложнения при предыдущих беременностях, привычное невынашивание и др.), с кровотечением в послеродовом периоде и т.д. Кроме того, в последнее время участились случаи поступления в роддом женщин, не обращавшихся ни разу в женскую консультацию, т.е. у которых отсутствуют данные акушерского анамнеза.
Несмотря на то, что на долю вспышечной заболеваемости приходится 0,2-0,3% от общего числа зарегистрированных в указанных учреждениях случаев, число вспышек на протяжении последних лет не уменьшается. Так, в родовспомогательных учреждениях в 1997 году было зарегистрировано 9 вспышек, при которых пострадало 93 новорожденных и рожениц, из них один случай закончился летальным исходом. С начала 1998 года уже зарегистрировано 5 вспышек гнойно-септических инфекций среди новорожденных в родовспомогательных учреждениях страны.
Анализ заболеваемости в родовспомогательных учреждениях свидетельствует о том, что причины возникновения групповой заболеваемости связаны прежде всего с нарушением персоналом санитарно-гигиенического и противоэпидемического режимов, несвоевременным переводом заболевших новорожденных с признаками инфекционного заболевания в стационары II этапа выхаживания, отсутствием обследований на сальмонеллез, особенно в неблагополучных по этой инфекции территориях, женщин перед поступлением на роды. Источником инфекции может служить и персонал, который работает с признаками, к примеру, острой респираторной инфекции, что чаще всего выявляется только при проведении эпидемиологического расследования вспышки. Значительно реже в настоящее время констатируются случаи нарушения правил обработки и стерилизации инструментов.
Работа родовспомогательных учреждений в условиях отключения горячего водоснабжения, в период аварий на канализационных и водопроводных сетях недопустима. Такие чрезвычайные ситуации создают условия для распространения инфекции как среди новорожденных и рожениц, так и среди персонала.
Профилактика ВБИ невозможна без слаженной работы всех подразделений роддома. Особое место в структурных подразделениях занимает комната сбора и хранения грудного молока, где от четкой работы персонала зависит жизнь новорожденных. Инфицирование грудного молока при неправильном режиме обработки, приготовление молочных смесей с нарушением технологии может привести к развитию тяжелой инфекции у детей, т.к. грудное молоко и смеси являются благоприятной средой для развития микроорганизмов, относящихся к группе условно-патогенных (стафилококки, энтеробактерии, клебсиеллы), и патогенных (шигиллы, сальмонеллы, ротавирусы), которые чаще всего выделяются от больных, с предметов окружающей среды и от персонала при возникновении групповой заболеваемости. Многие из этих микроорганизмов приобрели свойства госпитальных штаммов, т.е. таких возбудителей, которые приобретают свойства устойчивости ко множеству антибиотиков и дезрастворам и прекрасно адаптировались к выживанию в условиях стационаров.
Это требует совершенствования мероприятий по профилактике ВБИ, что нашло свое отражение в приказе Минздрава России №345 от 26.11.97 «О совершенствовании мероприятий по профилактике внутрибольничных инфекций в акушерских стационарах».
Положения Приказа ориентируют на внедрение в родовспомогательных учреждениях новых технологий, направленных прежде всего на совместное пребывание матери и ребенка, раннее прикладывание к груди со свободным вскармливанием, раннюю (на 2-4-й день) выписку из стационара, что позволит максимально предотвратить риск заражения ВБИ. В настоящее время мы можем говорить, что эта работа находится на начальных этапах внедрения. Кроме того, особое внимание в приказе уделяется вопросу обработки рук персонала. Казалось, вопрос обработки рук освещается практически во всех документах, относящихся к работе лечебно-профилактических учреждений любого профиля. Но эта мера не утеряла свой значимости и в настоящее время. Многочисленные наблюдения и исследования свидетельствуют о недостаточном внимании со стороны персонала к этой важнейшей процедуре. Мытье рук после манипуляций, ведущих к их загрязнению, обязательно. Неукоснительное выполнение этих несложных правил в значительной мере предотвращает развитие тех или иных осложнений у рожениц и новорожденных.
В последние годы в большинстве родовспомогательных учреждений страны из-за нехватки персонала сложилась практика совмещения обязанностей акушерки и санитарки. В этих условиях недопустимо осуществлять мытье палат и других помещений в часы, предназначенные для проведения тех или иных манипуляций, предусмотренных функциональными обязанностями акушерки.
Татьяна ФРОЛОЧКИНА, главный специалист отдела госэпиднадэора и целевых программ.
Внутрибольничные инфекции
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.
Общие сведения
Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Внутрибольничные инфекции
Внутрибольничные инфекции (ВБИ) являются четвертой по частоте причиной летальности пациентов стационаров после болезней сердечно-сосудистой системы, злокачественных опухолей и инсультов. ВБИ приводят к увеличению времени госпитализации, существенно снижают качество жизни и приводят к потере репутации лечебного учреждения.
В 2010 году в Ямало-Ненецком автономном округе по данным отчетных форм зарегистрировано 98 случаев внутрибольничных инфекций (ВБИ). Показатель на 1000 населения составил 0,2. Заболеваемость осталась на уровне прошлого года (2009г.- 0,2) и не отражает истинного положения дел.
В лечебно-профилактических учреждениях Ямала продолжается недоучет инфекций мочевыводящих путей, пневмоний внутрибольничных и ГГСИ новорожденных, родильниц и оперированных больных.
Клиническая структура внутрибольничных инфекций по ЯНАО 2010г. (в %)
Зарегистрировано всего (абс. число)
Гнойно-септические инфекции новорожденных
Гнойно-септические инфекции родильниц
Инфекции мочевыводящих путей
Острые кишечные инфекции*
Другие инфекционные заболевания носительство возбудителей инфекционных заболеваний
Регистрация ГГСИ в акушерских стационарах введена в Российской федерации еще в 90-е годы. Однако до настоящего времени наблюдается большой разрыв в показателях регистрируемой и истинной заболеваемости, что не позволяет в системе эпидемиологического надзора осуществлять качественную эпидемиологическую диагностику. Учет гнойно-септических инфекций остается неполным, несмотря на внедрение в практику стандартного определения случая этих инфекций.
В родовспомогательных учреждениях среди новорожденных зарегистрировано 16 случая внутрибольничных инфекций, показатель на 1000 новорожденных составил 1,9. Заболеваемость регистрировалась на 4 территориях из 13 муниципальных образований (г. Салехарде, г. Ноябрьске, г. Новый Уреногой и в Ямальском районе).
Отсутствие системного доступного и качественного обследования на инфекции TORCH-комплекса приводит к рождению детей с инвалидизирующими заболеваниями ЦНС вследствие текущих внутриутробных инфекций, не диагностируемых у женщин во время беременности и у новорождённых в ранний неонатальный период. Данные обстоятельства диктуют необходимость углубленного обследования на ВУИ скринингового характера беременных женщин и новорождённых детей.
С 2006г. в России внедрена регистрации внутриутробных инфекций (ВУИ), в прошедшем году в родовспомогательных учреждениях автономного округа было зарегистрировано 69 случаев против 39 случаев внутриутробной инфекции в 2009 году.
Соотношение внутрибольничных инфекций к внутриутробным инфекциям в 2010г. составило как 1: 1,3.
В ЯНАО, как и в целом по России в родовспомогательных учреждениях основной удельный вес в структуре ВБИ занимают гнойно-септические инфекции новорожденных.
Размах показателей ВБИ новорожденных в муниципальных образованиях колеблется от 0,6 в г. Ноябрьске до 8,0 случаев на 1000 родов в Ямальском районе, это связано с разным уровнем оснащения диагностическим оборудованием лечебно-профилактических учреждений МО округа.
Основной удельный вес в структуре ВБИ новорожденных занимают гнойно-септические инфекции: конъюнктивиты (47,1%), сепсис (17,6%), пиодермия и омфалиты (по 5,9%).
Основными причинами ГСИ в акушерских стационарах остаются:
Значительное место в системе эпидемиологического надзора за гнойно-септическими инфекциями занимает микробиологический мониторинг. Вместе с тем существующие его организационные формы направлены только на оценку качества дезинфекционных мероприятий и не нацелены на своевременное выявление внутрибольничных штаммов (эковаров), которые и определяют эпидемическую ситуацию в стационарах.
Существенные экономические затраты при проведении микробиологического мониторинга и отсутствие должной эффективности диктуют необходимость его оптимизации в части совершенствования лабораторных методов диагностики случаев ГСИ и активного поиска внутрибольничных штаммов.
До сих пор остаются нерешенными проблемы раннего выявления послеродовых ГСИ у женщин и новорожденных, профилактики их инфицирования и предотвращения его реализации в манифестацию инфекционного процесса. Как правило, среди родильниц и новорожденных диагностируются признаки уже развившейся ГСИ, требующей длительного медикаментозного лечения.
Гси в медицине что это
О частоте внутриутробного (эндогенного) инфицирования новорожденных возбудителями гнойно-септических инфекций в акушерском стационаре
А.А. Хозяшева, В.И. Сергевнин, О.В. Чайкина
Медико-санитарная часть № 7 г. Перми
Пермская государственная медицинская академия
Известно, что гнойно-септичсские инфекции (ГСИ) новорожденных могут развиваться в результате постнатального (экзогенного) и внутриутробного (эндогенного) инфицирования. Постанатальное инфицирование возникает вследствие контакта новорожденного с источником возбудителя инфекции в условиях акушерского стационара. Внутриутробное инфицирование происходит от матери до родов (антенатально) или во время родов (интранатально). Очевидно, что профилактические мероприятия в отношении постнатальных и внутриутробных ГСИ принципиально различны. Между тем до настоящего времени четких критериев диагностики внутриутробных ГСИ не предложено, а частота их возникновения фактически не известна.
Целью работы явилось изучение частоты внутриутробного инфицирования новорожденных возбудителями ГСИ в акушерском стационаре.
Работа выполнена на базе акушерского стационара медсанчасти № 7 г.Перми в течение 1997 – 1999 гг. Бактериологически обследовано 2780 беременных, 2534 родильниц и 3423 новорожденных. У беременных исследовали мочу и мазок с цервикального канала, у родильниц – задние околоплодные воды и мазки с цервикального канала и последа, у новорожденных – мазки из ушной раковины и с кожи (непосредственно при рождении). Бактериологический анализ проводили на весь спектр аэробных и факультативно-анаэробных бактерий в соответствии с действующими инструкциями. Каждый случай ГСИ у новорожденного анализировали с учетом результатов комплексных бактериологических исследований, состояния здоровья матери, характера беременности и родов, времени появления и клинической картины заболевания.
Результаты бактериологических исследований показали, что пейзаж микроорганизмов, выделяемых от беременных, родильниц и новорожденных, в значительной степени совпадает (табл.)
Пейзаж микроорганизмов, выделенных от беременных, родильниц
и новорожденных (в % от общего количества микроорганизмов)
| Микроорганизмы | Беременные | Родильницы | Новорожденные |
| Грибы рода Candida | 33,0 | 30,0 | 13,0 |
| E. coli | 24,0 | 20,0 | 50,0 |
| S. aureus | 3,0 | 8,0 | 4,0 |
| S. epidermidis | 11,0 | 18,0 | 6,0 |
| S. pyogenes | 1,0 | 0 | 1,0 |
| S. faecalis | 8,0 | 8,0 | 9,0 |
| S. faecium | 15,0 | 12,0 | 8,0 |
| Klebsiella | 1,0 | 2,0 | 3,0 |
| Прочие | 4,0 | 2,0 | 6,0 |
| Итого | 100,0 | 100,0 | 100,0 |
Следует отметить, что в 59,0% случаев у родильниц в анамнезе фигурировали хронический пиелонефрит, кольпит, хламидиоз, венерические болезни и другие инфекции.
Представленные материалы свидетельствуют о том, что ГСИ новорожденных наиболее часто являются следствием внутриутробного (эндогенного) инфицирования. Отсюда очевидно, что в профилактике ГСИ новорожденных приоритетное место должны занимать мероприятия, направленные на нейтрализацию эндогенных факторов риска, т.е. на выявление и санацию очагов хронической и латентной инфекции у каждой беременной женщины.
Диагностика инфекционных заболеваний
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
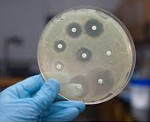
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
Чашки Петри с посевами инкубируют в термостате при определенных температурных, а для ряда микроорганизмов газовых (например, для выращивания анаэробов создают условия с низким содержанием кислорода) режимах в течение 18-24 часов. Затем чашки Петри просматривают. Количественную обсемененность доставленного биоматериала микрофлорой определяют по числу колониеобразующих единиц (КОЕ) в 1 мл или 1 мг исследуемого образца. При просмотре чашек Петри выявляют некоторые особенности изменения цвета среды, ее просветления в процессе роста культуры. Многие группы бактерий образуют характерные формы колоний, выделяют пигменты, которые окрашивают колонии или среду вокруг них. Из каждой колонии делают мазки, окрашивают по Граму и микроскопируют. Оценивают однородность бактерий, форму и размер, наличие спор или других включений, капсулы, расположение бактерий, отношение к окраске по Граму. Вся эта информация служит важнейшей составляющей для выбора сред и получения в дальнейшем чистой культуры каждого микроорганизма.
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
1. Обнаружение с диагностической целью антител в сыворотке крови обследуемого. В этом случае из двух компонентов реакции (антитело, антиген) неизвестным является сыворотка крови, так как постановка реакции проводится с заведомо известными антигенами. Положительный результат реакции свидетельствует о наличии в крови антител, гомологичных применяемому антигену; отрицательный результат указывает на отсутствие таковых. Достоверные результаты получают при исследовании «парных» сывороток крови больного, взятой в начале заболевания (3-7-й день) и через 10-12 дней. В этом случае удается наблюдать динамику нарастания антител. При вирусных инфекциях лишь четырехкратное и большее повышение титра антител во второй сыворотке имеет диагностическое значение.
С внедрением в практику лабораторий метода иммуноферментного анализа (ИФА) стало возможным определять в крови больных антитела, относящиеся к различным классам иммуноглобулинов (IgM и IgG), что существенным образом повысило информативность серологических методов диагностики. При первичном иммунном ответе, когда иммунная система человека взаимодействует с инфекционным агентом в первый раз, синтезируются преимущественно антитела, относящиеся к иммуноглобулинам класса М. Лишь позднее, на 8-12 день после попадания антигена в организм, в крови начинают накапливаться антитела иммуноглобулинов класса G. При иммунном ответе на инфекционные агенты вырабатываются также и антитела класса А (IgA), которые играют важную роль в защите от инфекционных агентов кожи и слизистых оболочек.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.