Шик положительная реакция что это
Шик положительная реакция что это
Цитохимические методы преследуют отождествление химических и ферментных веществ в клетках, используя для этого цветные реакции. Цитохимические препараты сохраняют клеточную структуру, что допускает выявление клеток и внутриклеточную локализацию исследувмого составного. Вот почему в гематологии отдается предпочтение не биохимическим, трудоемким, разрушающим клеточную структуру о относящимся к весьма разнородной клеточной популяции, а цитохимическим способам.
Цитохимия доказала, что среди морфологически одинаковых клеток имеются существенные химические и ферментативные различия.
Принцип ШИК-реакции. Полисахариды выявляются путем реакции, окисляющей спиртные группы, которые преобразуются в альдегидные группы, и отождествления последних путем цветной реакции реагентом Шифф.
Реагенты для ШИК-реакции: 1. Закрепляющий смесь спирт-формалин: 9 частей абсолютного этилового спирта +1 часть 40% формалина; сохранять при температуре +4°.
2. Периодння кислота, 1% водный раствор. Раствор бесцветный. Хранить в бутылке из коричневого стекла, в темноте, при лабораторной температуре. Пожелтевший раствор неприменим.
3. Реагент Шиффа. Развести 1 г основного фуксина в 200 мл дистилированной воды при температуре кипения. Болтать 5 минут, охладить до температуры 50°, профильтровать и добавить 20 мл нормальной соляной кислоты. Охладить до 25°, добавить 2 г метабисульфита натрия или калия, которые полностью обеспечивают раствор. Раствор должен простоять сутки в условиях темноты и холода (+4°). Затем добавить 2 г активированного угля, поболтать 1 мин. и профильтровать.
Полученный фильтрат прозрачный и бесцветный. Допускается слегка желтоватый оттенок; если раствор розовеет, становится неприменимым. Хранить при температуре +4° в герметически закрытой бутылке из коричневого стекла.
4. Зеленый светлый —1% водный раствор.
5. Диастаз: неразжиженная слюна человека или 0,1% раствора амилолитического-диастатического фермента в физиологическом солевом растворе.
Техника проведения ШИК-реакции
1) 10-тиминутное закрепление мазков смесью спирт-формалин; промывание дистилированной водой;
2) окисление 1% раствором периодной кислоты, 10 мин.; промывание дистилированной водой;
3) окраска реагентом Шиффа в накрытой посуде, в условиях темноты и холода, в течение 2 часов; промывание проточной водой;
4) контрастная окраска 1% зеленым-светлым в течение 1 минуты; промывание проточной водой.
Контрольный закрепленный мазок подвергается инкубации диастазом, 60 мин. в условиях комнатной температуры для выборочного удаления гликогена. После промывания дистилированной водой подвергается обработке по обычному методу.
Оценка результатов ШИК-реакции
Гликоген, окрашенным в багряно красный- цвет, представляется в виде зерен или рассеянный. Для контроля реакции используются зрелые гранулоциты мазка. Помимо гликогена ШИК положительную реакцию дают и другие вещества углеводной природы, такие как, муцин, мукопротеины, цереброзиды, фибрин. Дифференциация гликогена от этих составных осуществляется путем предварительной обработки диастазом, после чего гликоген более не окрашивается.
В гранулоцитах гликоген находится в рассеянном виде уже на стадии промиелоцита и начинает увеличиваться по мере созревания. В нормальных условиях лимфоциты отрицательны или в 20% из них могут находиться несколько мелких зерен гликогена. Моноциты отрицательные либо имеют тонкую зернистость.
Интенсивность окраски определяется полуколичественно. В лимфоцитах реакция ШИК отражается в виде гликогенного показателя, или среднего показателя реакции (Астальди). Нормальный показатель гликогена колеблется в пределах от 0,10 до 0,30. Обычно лишь у патологических лимфоцитов наблюдается степень нагрузки более 3.
Значилось метода ШИК-реакции:
а) При постановке дифференциального диагноза отдельных цитологических видов острой лейкемии:
— Миелобласты и промиелоуиты ШИК-отрицательные или приобретают слабую диффузную окраску. Тела Ауера дают положительную реакцию, которая ослабевает после переваривания со слюной.
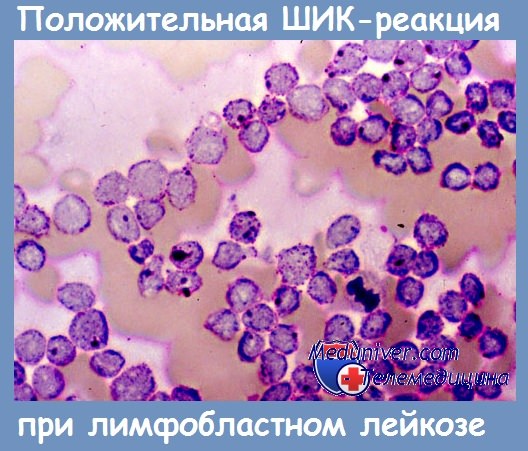
— Лимфобласты при острой лейкемии и лимфосаркоме дают резкую ШИК-положительную реакцию в виде зерен или крупных блоков гликогена.
— Эритробласты при эритремии и острой эритролейкемии дают резко положительную рассеянную или зернистую реакцию, в противоположность нормальным эритробластам, которые ШИК-отрицательные;
— Моноцитоидные б ласты непостоянно слабо положительные, с тонкой зернистостью.
б) В целях постановки диагноза и наблюдения за эффективностью лечения при хронической лимфатической лейкемии: завышенный показатель гликогена указывает на тяжелую форму заболевания и тяжкий прогноз.
Рост гликогена в патологических лимфоцитах не характерное для лейкемии явление, оно объясняется ростом метаболической активности при любом виде лимфоидной пролиферации.
в) Для дифференциации клеток Гоше от иных макрофагов с накоплением.
Видео методы окрашивания препаратов в гистологии
Редактор: Искандер Милевски. Дата обновления публикации: 5.5.2021
Шик положительная реакция что это
Цель работы. Проследить динамические изменения в тонкой кишке, связанные с углеводным и белковым обменом при воздействии неблагоприятных факторов внешней среды.
Материалы и методы исследования
Результаты исследования и их обсуждение
Окрашивание тонкой кишки контрольной группы прочным зеленым показало значительное содержание белка во всех структурах, включая эпителий, соединительную и мышечную ткани; бокаловидные клетки и нервные сплетения окрасились менее интенсивно. Наиболее интенсивная окраска наблюдалась в наружном циркулярном мышечном слое, вокруг нервных сплетений, в периваскулярных структурах, в мышечной пластинке, слизистой оболочке, а также в гранулах клеток Паннета и апикальной части ворсинки. В собственной пластинке хорошо контрастируют с общим фоном пучки волокон, заходящие в ворсинки и повторяющие ее форму. Сосуды окрашены неравномерно, их базальная мембрана имеет слабую реакцию в отличие от медии, которая имеет темно-зеленый цвет, плавно переходящий в подлежащие структуры. За счет содержания в них нейтральных мукополисахаридов основное вещество, коллагеновые волокна и мышечная ткань дают умеренно положительную реакцию. Ввиду этого стенка сосуда получает гомогенное окрашивание. Из-за неодинаковой способности накапливать гликоген интенсивность окраски в паренхиме менее однородна. Для выявления сиаломуцинов, помимо проведения классической Шик-реакции, препараты докрашивались альциановым синим. В начальной стадии секреторного цикла бокаловидные клетки имеют секрет, содержащий только нейтральные муцины. Несколько выше, на переходе с крипт на ворсинку, содержимое этих клеток приобретает темно-фиолетовый цвет, что свидетельствует о нахождении как нейтрального, так и кислого муцинов. В клетках Паннета и на боковой поверхности нижней трети ворсинок, главным образом, определяется имеющий голубую окраску сиаломуцин. Подслизистая и собственная пластинка слизистой окрашены в ярко-малиновый цвет, на фоне которого четко определяются волокна, имеющие более темный цвет. Сосуды окрашены в малиновый цвет, что говорит о преобладании в их стенке нейтральных мукополисахаридов.
Рис. 1. Распределение нейтрального муцина и сиаломуцинов в крипте тонкой кишки. Контрольная группа. Окраска Шик-реакция, альциановый синий. Ув.: об. 40, ок. 10.
Через один месяц после начала эксперимента на препаратах, окрашенных прочным зеленым, на фоне общего просветления препарата отмечалось незначительное перераспределение белка в эпителиальном пласте ворсинки, появились участки эпителия с менее интенсивной окраской в апикальной части и на боковых поверхностях ворсинки. В апикальной части энтероцитов выявлялись мелкозернистые гранулы, с более насыщенной окраской. В криптах клетки имели зернистую структуру, отчетливо определяемую на фоне просветления. Сосудистая стенка оставалась по-прежнему интенсивно окрашенной. В периваскулярном пространстве никаких изменений не выявлено. Шик-реакция в сочетании с альциановым синим через один месяц эксперимента дала большую выраженность по сравнению с прочным зеленым. На фоне структур, окрашенных в розовый цвет, что свидетельствует о содержании нейтрального муцина, появились значительные отложения сиаломуцина. Последний определялся не только в клетках Паннета и нижней трети боковой поверхности ворсинок, но и в сосудистой стенке с незначительным выходом в периваскулярное пространство в подслизистой основе и мышечной пластинке слизистой оболочки. Отмечалось перераспределение сиаломуцина и его более интенсивная окраска в клетках Паннета. Большая часть бокаловидных клеток, находящихся на разных стадиях своего секреторного цикла, характеризовалась тем, что с момента формирования они содержали в себе два типа муцина, о чем свидетельствует разная интенсивность их темно-фиолетовой окраски. Помимо изменения содержимого гранул бокаловидных клеток, увеличилось и их количество. Появились отдельные бокаловидные экзокриноциты, которые содержали в себе муцин только кислой природы. Таким образом, на протяжении первого месяца эксперимента отмечалось перераспределение белка с неравномерным уменьшением количества в эпителии и накоплением его в апикальной части клетки. Сосудистая стенка оставалась без изменений. Накопление сиаломуцина происходило преимущественно в области крипт, с преобладанием в секрете бокаловидных клеток. Накопление сиаломуцина отмечалось также в сосудистой стенке с незначительным выходом его в периваскулярное пространство.
Через два месяца после начала эксперимента на препаратах, окрашенных прочным зеленым, определялось уменьшение интенсивности окраски не только эпителиального пласта, но и в области сосудистой стенки и мышечной оболочки. На препаратах, окрашенных фуксин-сернистой кислотой, альциановым синим, в собственной пластинке слизистой оболочки определялось значительное отложение сиаломуцинов с преобладанием их в секрете бокаловидных клеток и накоплением в подслизистой и мышечном слоях. Таким образом, через два месяца эксперимента в собственной пластинке слизистой оболочки и подслизистой основе отмечалось снижение интенсивности окраски прочным зеленым сосудистой стенки и накопление сиаломуцинов, а также изменение состава секрета бокаловидных клеток с преобладанием в них кислых муцинов.
После трех месяцев хронического воздействия при окрашивании прочным зеленым кровеносные сосуды теряют свою интенсивную и однородную окраску, вокруг них определяется значительное скопление белка, окрашенного в более интенсивный зеленый цвет. Собственная пластинка слизистой становится прерывистой. Волокна, определяемые ранее в собственной пластинке слизистой, исчезают или имеют прерывистый характер. При окраске Шик-реакции, альциановым синим, отмечалось дальнейшее отложение сиаломцинов в подслизистой основе и собственной пластинке слизистой оболочки. При более детальном изучении сосудов было обнаружено накопление сиаломуцинов в сосудистой стенке с сохранением положительной Шик-реакции в интиме.
Четвертый месяц эксперимента характеризовался значительными гистохимическими изменениями показателей. Окрашивание фуксин-сернистой кислотой носит неоднородный характер. Умеренную реакцию дают только волокнистые структуры. Последние в участках, инфильтрированных клетками, теряют свою направленность и располагаются хаотично. При докрашивании альциановым синим определяется его повсеместное распространение. В бокаловидных клетках на всех стадиях жизненного цикла преобладают кислые мукополисахариды. Определяется значительное отложение сиаломуцина в периваскулярной области. Мышечная оболочка окрашена неравномерно, с одинаковым распределением как нейтральных, так и кислых мукополисахаридов. Окрашивание прочным зеленым мышечной оболочки кишечной стенки достаточно интенсивное. Последняя имеет неровные контуры и местами значительно истончена. Собственная пластинка слизистой приобретает прерывистый вид, неоднородно окрашена, волокна хаотично направлены, слабо окрашенные. Подслизистая основа и сосудистая стенка имеют также неоднородную структуру. Определяются участки периваскулярного отложения белка в виде ячеистой структуры.
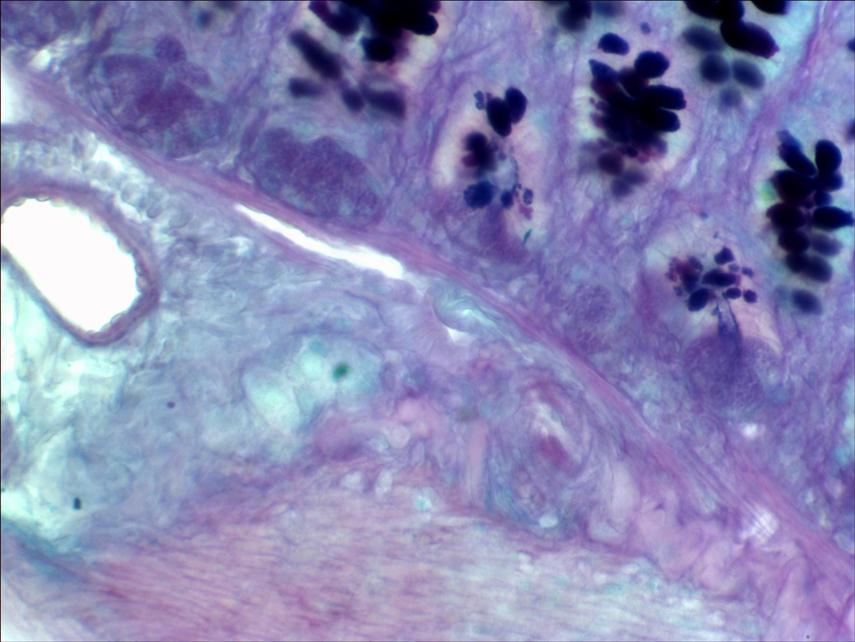
Рис. 2. Замещение нейтральных мукополисахаридов на кислые. Периваскулярные отложения сиаломуцина через 4 месяца хронической интоксикации. Окраска Шик-реакция, альциановый синий. Ув.: об.40, ок.10.
Выводы
Таким образом, наиболее значимыми проявлениями эксперимента являются изменения гистохимическиой картины в тканях кишечника, что связанно, прежде всего, с общим перераспределением белка как в соединительнотканном каркасе, так и в эпителиальном пласте. Изменяется мукополисахаридный состав, замещаясь с нейтрального на кислый. Отмечается преобладание сиаломуцинов в секретируемом продукте бокаловидных клеток. Истончается мышечная пластинка слизистой и мышечная оболочка. Происходит диссоциация соединительнотканных компонентов собственной пластинки слизистой и подслизистой основы. Кроме того, накопление кислых мукополисахаридов в стенках мелких артерий, а также в периваскулярной области рассматривается как плазматическое пропитывание, которое уже было описано как характерный признак для хронических прогрессирующих заболеваний желудочно-кишечного тракта [1].
Рецензенты:
Цитохимическое исследование гликогена
Метод Шабадаша
Под влиянием перйодата калия гликоген окисляется с образованием альдегидных соединений, легко реагирующих с реактивом Шиффа (фуксин-сернистая кислота). В местах локализации гликогена выявляется вишнево-фиолетовое окрашивание, по интенсивности которого можно судить о количестве гликогена в клетках.
Посуда и оборудование
Реактивы
Ход окраски
Для проведения реакции удобно все растворы поместить в химические стаканчики или кюветы и переносить препараты в указанной выше последовательности.
В настоящее время существуют реагенты для цитохимического исследования на гликоген заводского производства, которые более просты в применении. К сожалению, не все из них обладают хорошим качеством.
Результат метода Шабадаша
Гликоген окрашивается в вишнево-фиолетовый цвет на зеленом фоне препарата.
Расчет количества гликогена производят по полуколичественному методу или выражают в процентах.
Кроме гликогена, положительную реакцию могут давать такие ШИК-положительные вещества, как кислые и нейтральные мукополисахариды, мукопротеины, гликопротеины и др. Гликоген легко дифференцировать от других веществ пробой со слюной или диастазой.
Проба со слюной
Препарат помещают в свежесобранную слюну и оставляют на 30 мин в термостате. Затем производят окраску на гликоген приведенным выше методом. Инкубация препаратов со слюной способствует расщеплению гликогена, и при реакции с реактивом Шиффа не получается розовой окраски.
Идентифицировать гликоген можно также путем предварительной инкубации мазков с амилазой (1 мл профильтрованной амилазы растворить в 40 мл физиологического раствора) в течение 30 мин в термостате.
На практике проба со слюной обычно не проводится, поэтому под PAS-положительным материалом понимаются, как правило, все полисахариды, а не только гликоген.
Нормальные величины метода Шабадаша
В мазках периферической крови гликоген содержится в цитоплазме нейтрофилов (в виде обильной мелкой зернистости), цитоплазме лимфоцитов (в виде небольшого количества крупных зерен) и тромбоцитах (в виде одиночных крупных зерен). В пунктате костного мозга гликоген выявляется в нейтрофилах разной степени зрелости, лимфоцитах и мегакариоцитах.
В зрелых эозинофилах и базофилах PAS-положительный материал располагается следующим образом: специфические гранулы остаются неокрашенными и резко выделяются на фоне диффузного окрашивания цитоплазмы.
В моноцитах гликоген чаще выявляется в виде мелкой пылевидной зернистости на фоне светло-розового диффузного окрашивания.
В норме от 3 до 10% клеток эритроидного ряда содержат мукополисахариды.
Клиническое значение метода Шабадаша
При хроническом миелолейкозе содержание гликогена в гранулоцитах уменьшается приблизительно в 2 раза по отношению к норме, хотя общее его количество, определяемое биохимическими методами, может быть даже повышенным вследствие лейкоцитоза.
При тромбоцитопенической пурпуре и симптоматических тромбоцитопениях число гликогенположительных форм мегакариоцитов значительно снижено, после спленэктомии оно повышается до нормальных величин.
Цитохимическое исследование на гликоген можно проводить не только в мазках крови и костного мозга. Так, например, можно исследовать мазки влагалищного эпителия и по результатам исследования судить о функциональном состоянии яичников. В норме у женщин обнаруживают много гликогена в клетках, в то время как обеднение их гликогеном свидетельствует о нарушении функции яичников.
В опухолях количество гликогена различно: зрелые доброкачественные опухоли содержат много гликогена, в незрелых раковых опухолях количество гликогена резко уменьшено. Снижение гликогена в опухолевых клетках, вероятно, может быть использовано как показатель злокачественности опухоли.
Микрофотографии ШИК-реакции:
Литература:
Похожие статьи
Цитохимическое исследование миелопероксидазы
Миелопероксидаза является лизосомальным ферментом, катализирующим в присутствии перекиси водорода окисление различных субстратов. Она локализуется преимущественно в специфических азурофильных гранулах в цитоплазме гранулоцитов и является маркером клеток миелоидного ряда. Миелопероксидаза выявляется в клетках гранулоцитарного ряда, начиная с миелобласта.
Раздел: Цитохимия
Цитохимическое исследование липидов
Цитохимическое исследование липидов основано на применении красящих веществ, растворяющихся в жирах (судан III, судан IV, черный судан и др.). Для выявления нейтрального жира пользуются суданом III, окрашивающим жир в оранжевый цвет. Липоиды выявляются лучше суданом черным (черное окрашивание).
Раздел: Цитохимия
Кольцевая проба Геллера
Кольцевая проба Геллера относится к качественным реакциям определения белка в моче. Так как она основана на реакции коагуляции, то исследуемая моча должна соответствовать определенным требованиям: быть прозрачной и иметь кислую реакцию.
Раздел: Анализ мочи
Подсчет миелокариоцитов
Раздел: Гемоцитология
Морфология клеток мегакариоцитарного ростка
Раздел: Гемоцитология
Шик положительная реакция что это
Биологическая роль углеводов многообразна.
В организме они выполняют опорные и энергетические функции, некоторые углеводы являются составными частями биологически важных соединений (АТФ, циклической АМФ, нуклеиновых кислот, гепарина, витамина С и др.). Гликопротеиды как специфический компонент иммуноглобулинов играют важную роль в иммунных механизмах, определяя антигенную активность сывороточных и клеточных факторов. Кроме того, продукты расщепления углеводов используются для синтеза практически всех классов соединений в живой клетке.
В живой клетке углеводы существуют в форме моно-, олиго- и полисахаридов. В гистологических препаратах они сохраняются практически только в виде полисахаридов: во всяком случае только полисахариды могут быть с достоверностью выявлены гистохимически. Правда, возможно также гистохимическое выявление глюкозы и витамина С.
Общепринятой классификации полисахаридов не существует.
Для практических гистохимических целей достаточно разделить полисахариды на гомо- и гетерополисахариды.
Гомополисахариды построены из остатков молекул моносахаридов, главным образом пентозы и гексозы, соединенных между собой кислотными мостиками. Гомополисахаридами являются крахмал, инулин, клетчатка, гликоген. К ним с определенными оговорками можно также отнести хитин и полигалактуроновую кислоту.
Гетерополисахариды разделяют на гликозаминогликаны (ГАГ) и гликопротеины. К кислым гликозаминогликанам ГАГ относят гиалуроновую кислоту, молекула которой построена из остатков глюкуроновой и уксусной кислот и гексозамина; хондроинин-4-сульфат, хондроитин-6-сульфат, дерматан-сульфат, кератан-сульфат, гепаритин-сульфат, гепарин, молекулы которых содержат остатки гексозамина, глюкуроновой или уроновой кислот, серной и уксусной кислот в различных сочетаниях. В тканях кислые ГАГ, кроме гепарина, находятся в соединении с белками. Такие комплексы, в которых к белковому стержню присоединены полисахаридные цепи, носят название «протеогликаны». Все эти соединения входят в состав матрикса соединительной ткани, крови, синовиальной жидкости, слизи.
Гликопротеины являются белками, к молекуле которых ковалентно присоединены олигосахариды: гексозы, гексозамины, сиаловые кислоты, фукозы и др. Такие соединения являются составной частью клеточных мембран, слизистых секретов желез, сывороточных белков, ферментов, гормонов, «неколлагеновых белков» соединительной ткани и т.д.
Гистохимическая идентификация углеводов
Выявление углеводов основано, как правило, на методах общего анализа химических групп. Используются методы окисления, метахроматическое окрашивание основными красителями, реакции связывания коллоидных металлов, выявление базофилии, окрашивание кармином, реакции блокирования и превращения реакционноспособных групп, методы ферментативного гидролиза, радиоавтографию, иммуногистохимию.
Методы окисления 1,2-гликолей до альдегидов
Реакция Шифф-йодной кислотой (ШИК-реакция)
В результате этого образуется одна кетогруппа или две альдегидные группы, как, например, в глюкозе. Альдегидные группы реагируют с реактивом Шиффа (фуксин-сернистой кислотой) точно так же, как и в реакции Фельгена. С помощью этого метода выявляют все соединения, содержащие оксигруппы, которые в результате окисления метайодной кислоты могут превращаться в альдегидные группы. Однако в гистологических срезах практически лишь гликоген и гликопротеины, сохраняющиеся в достаточных количествах, могут быть выявлены с помощью ШИК-реакции. Гликоген можно дифференцировать от гликопротеинов путем переваривания в амилазе или диастазе.
1. Материал фиксируют в 10 % формалине, жидкостях Карнуа, Ценкера, заливают в парафин.
2. Депарафинированные срезы доводят до дистиллированной воды.
3. При комнатной температуре срезы окисляют 0,5—1 % водным раствором орто- или метайодной кислоты в течение 2 —10 мин.
Окисление можно также проводить по Шабадашу в 0,001—0,01 М метаперйодате калия или натрия в течение 7 — 25 мин.
Раствор хранят в темноте.
Рабочую концентрацию этого раствора и продолжительность инкубации в ней подбирают в зависимости от объекта.
4. Промывают в дистиллированной воде 10 мин.
5. Помещают срезы в реактив Шиффа на 10-30 мин при комнатной температуре в темноте.
Реактив Шиффа по Грауманну:
0,5 г парарозанилина (парафуксин, свободный от акридина, стандартный) полностью растворяют в 15 мл 1 н. соляной кислоты без нагревания при помешивании и доводят до 85 мл дистиллированной водой с растворенными в ней 0,5 г пиросульфита калия; прозрачный интенсивно-красный раствор, помещенный в темноту в сосуде с плотно прилегающей пробкой, в течение 24 ч приобретает желтоватый оттенок, его встряхивают 2 мин с 0,3 г активированного угля (порошок) и затем дважды фильтруют.
Такой раствор готов к использованию и его можно хранить в сосудах коричневого цвета с пришлифованной пробкой по крайней мере в течение 2 мес.
6. Срезы промывают сернистой водой (600 мл дистиллированной воды + 30 мл 10 % пиросульфита калия + 30 мл 1 н. соляной кислоты) три раза по 2 мин.
Сернистую воду можно также готовить (непосредственно до проведения реакции) по рекомендации А.Л. Шабадаша следующим образом:
к 200 мл дистиллированной воды добавить 10 мл 10 % раствора натрия гидросульфита
и 10 мл 1 н. соляной кислоты.
7. Тщательно промывают в проточной и дистиллированной воде, ядра можно докрасить 0,5 % светлым зеленым или кислым гемалауном.
8. Обезвоживают в спиртах возрастающей концентрации, заключают в бальзам.
углеводы, содержащие гексозу, окрашиваются в красно-лиловый цвет, гликоген — в более интенсивный темно-красный.
расщепление гликогена амилазой или диастазой, реакция ацетилирования для блокирования гидроксильных групп.
необходимо пользоваться химически чистой посудой, стеклянными палочками; нельзя работать с металлическими крючками или иголками; окрашивание срезов в реактиве Шиффа следует проводить в темноте.
Метахроматическое окрашивание кислых гликозаминогликанов
Метахромазия — это изменение спектров поглощения используемых красителей.
Метахромазию можно получить при использовании очень широкого набора красителей (табл. 2).
Спектры поглощения красителей, дающих метахромазию [Kelly, 1956]