Что эффективнее офлоксацин или левофлоксацин
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
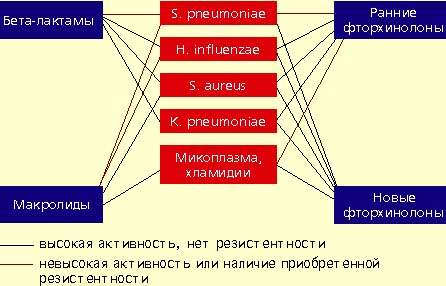
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Офлоксацин в урологической практике
Опубликовано в журнале:
«Лечебное дело», 2007, №2, с. 33-38
В.Е. Охриц, Е.И. Велиев
Кафедра урологии и хирургической андрологии РМАПО
Антибактериальные препараты (АБП) класса фторхинолонов (ФХ), объединенные общим механизмом действия (ингибирование синтеза ключевого фермента бактериальной клетки – ДНК-гиразы), в настоящее время занимают одну из ведущих позиций в химиотерапии бактериальных инфекционных заболеваний. Первый хинолон был получен случайно в процессе очистки противомалярийного препарата хлорохина. Это была налидиксовая кислота, которая более 40 лет применялась для лечения инфекций мочевых путей (ИМП). В последующем введение атома фтора в структуру налидиксовой кислоты положило начало новому классу АБП – ФХ. Дальнейшее совершенствование ФХ привело к появлению в середине 1980-х годов монофтор-хинолонов (содержащих один атом фтора в молекуле): норфлоксацина, пефлоксацина, офлоксацина и ципрофлоксацина.
Спектр действия ФХ
Все ФХ являются препаратами широкого спектра действия, который включает бактерии (аэробные и анаэробные, грамположительные и грамотрицательные), микобактерии, хламидии, микоплазмы, риккетсии, боррелии, некоторые простейшие.
ФХ характеризуются активностью в отношении преимущественно грамотрицательных бактерий: семейств Enterobacteriaceae (Citrobacter, Enterobacter, Escherichia coli, Klebsiella, Proteus, Providencia, Salmonella, Shigella, Yersinia), Neisseriae, Haemophilus, Moraxella, в отношении которых минимальная подавляющая концентрация (МПК90)
ФХ в большинстве случаев составляет Среди ФХ имеются различия в активности против разных групп микроорганизмов и отдельных видов бактерий. Наиболее активными in vitro ФХ являются ципрофлоксацин (в отношении Enterobacteriaceae и Pseudomonas aeruginosa) и офлоксацин (в отношении грамположительных кокков и хламидий).
Резистентность бактерий к ФХ развивается относительно медленно, в основном она связана с мутациями генов, кодирующих ДНК-гиразу или топоизомеразу IV. Другие механизмы резистентности бактерий к ФХ связаны с нарушением транспорта препаратов через пориновые каналы во внешней клеточной мембране микробной клетки или с активацией белков выброса, которые приводят к выведению ФХ из клетки.
Фармакокинетика ФХ
Все ФХ хорошо всасываются в желудочно-кишечном тракте, достигая максимальных концентраций в крови через 1–3 ч; прием пищи несколько замедляет всасывание, но не влияет на его полноту. ФХ характеризуются высокой биодоступностью при приеме внутрь, которая у большинства препаратов достигает 80–100% (за исключением норфлоксацина – 35–45%).
Все ФХ длительно циркулируют в организме в терапевтических концентрациях (период полувыведения 5–10 ч), благодаря чему применяются 1–2 раза в сутки.
Концентрации ФХ в большинстве тканей организма сопоставимы с сывороточными или превышают их; в большой концентрации ФХ накапливаются в паренхиме почек и в ткани простаты. Отмечается хорошее проникновение ФХ в клетки – полиморфно-ядерные лейкоциты, макрофаги, что важно при лечении внутриклеточных инфекций.
Имеются различия по выраженности метаболизма, которому подвергаются ФХ в организме. В наибольшей степени биотрансформации подвержен пефлоксацин (50–85%), в наименьшей – офлоксацин (менее 10%, при этом 75–90% офлоксацина в неизмененном виде выводится почками).
Важным достоинством ФХ является наличие у ряда препаратов (офлоксацин, пефлоксацин, ципрофлоксацин) двух лекарственных форм – для приема внутрь и для парентерального применения. Это делает возможным применять их последовательно (ступенчатая терапия), начиная с внутривенного введения и затем переходя на прием препаратов внутрь, что, безусловно, повышает комплайнс и экономическую обоснованность лечения.
Переносимость ФХ
В целом ФХ хорошо переносятся, хотя у 4–8% пациентов они могут вызывать нежелательные эффекты (наиболее часто – со стороны желудочно-кишечного тракта, центральной нервной системы и кожи).
Приблизительно 20 лет назад в исследованиях на животных была выявлена способность ФХ вызывать артропатии, что послужило причиной фактического запрета на использование ФХ у беременных и детей младше 12 лет. Назначение ФХ пациентам этих категорий возможно только по жизненным показаниям. В публикациях, касающихся применения ФХ у тяжело больных детей, не были подтверждены данные о частом развитии артротоксического эффекта. Он был отмечен менее чем у 1% детей и зависел от возраста и пола: встречался чаще у подростков, чем у детей раннего возраста, и у девочек чаще, чем у мальчиков.
Одним из самых безопасных ФХ считается офлоксацин. По данным некоторых исследователей при долгосрочном наблюдении за детьми и подростками, получавшими офлоксацин по жизненным показаниям, случаев артротоксичности (как острой, так и кумулятивной) выявлено не было. Кроме того, у больных с сопутствующими заболеваниями суставов не отмечалось обострения на фоне приема офлоксацина.
Особенности офлоксацина
Офлоксацин можно рассматривать как один из наиболее высокоактивных для лечения ИМП препаратов из ранних ФХ. Благодаря своей структуре и механизму действия офлоксацин обладает высокой бактерицидной активностью. Препарат активен в отношении грамотрицательных и грамположительных микроорганизмов (включая штаммы, резистентные к другим АБП), а также внутриклеточных возбудителей.
Офлоксацин можно назначать одновременно со многими АБП (макролидами, b-лактамами). Благодаря этому свойству препарат широко используют в составе комбинированной терапии при инфекционных заболеваниях. Офлоксацин в отличие от ципрофлоксацина сохраняет активность при одновременном применении ингибиторов синтеза РНК-полимеразы (хлорамфеникола и рифампицина), так как он практически не метаболизируется в печени.
Биодоступность офлоксацина при пероральном приеме и парентеральном введении идентична. Благодаря этому при замене инъекционного пути введения препарата пероральным коррекции дозы не требуется (одно из существенных отличий офлоксацина от ципрофлоксацина). Офлоксацин назначают 1–2 раза в сутки. Прием пищи не влияет на его всасываемость, однако при употреблении жирной пищи всасывание офлоксацина замедляется.
Офлоксацин хорошо проникает в органы-мишени (например, при хроническом простатите – в ткань предстательной железы). Между используемой дозой офлоксацина и его концентрацией в тканях существует линейная зависимость. Препарат выделяется преимущественно почками (более 80%) в неизмененном виде.
Офлоксацин в меньшей степени, чем ципрофлоксацин, взаимодействует с другими препаратами, практически не влияет на фармакокинетику теофиллина и кофеина.
Активность офлоксацина в наибольшей степени выражена в отношении грамотрицательных бактерий и внутриклеточных патогенов (хламидий, микоплазм, уреаплазм), в отношении грамположительной флоры и синегнойной палочки офлоксацин менее активен. Бактерицидный эффект офлоксацина проявляется достаточно быстро, а резистентность микроорганизмов к нему развивается медленно. Это обусловлено его влиянием на один ген ДНК-гиразы и на топоизомеразу IV. Основные отличия офлоксацина от других ФХ (Яковлев В.П., 1996):
ФХ в урологической практике
Пожалуй, наиболее активно ФХ используются в урологической практике для антибактериальной профилактики и терапии ИМП. Препарат для антибактериальной терапии (АБТ) ИМП должен характеризоваться следующими свойствами:
Важно выделять амбулаторные и нозокомиальные ИМП. При ИМП, возникших вне стационара, основным возбудителем является E. coli (до 86%), а другие микроорганизмы встречаются значительно реже: Klebsiella pneumoniae – 6%, Proteus spp. – 1,8%, Staphylococcus spp. – 1,6%, P. aeruginosa – 1,2%, Enterococcus spp. – 1%. При нозокомиальных ИМП лидирует также E. coli, однако значительно возрастает роль других микроорганизмов и микробных ассоциаций, намного чаще встречаются полирезистентные возбудители, а чувствительность к АБП различается между стационарами.
По данным проведенных в России многоцентровых исследований резистентность уропатогенов к широко применяемым АБП, таким как ампициллин и ко-тримоксазол, достигает 30%. Если уровень резистентности уропатогенных штаммов E. coli к антибиотику составляет в регионе более 10–20%, этот препарат не должен использоваться для эмпирической АБТ. Наибольшей активностью против E. coli среди ФХ обладают офлоксацин, ципрофлоксацин, норфлоксацин. В среднем по России выделяется 4,3% штаммов E. coli, резистентных к ФХ. Сопоставимые данные получены в США и большинстве европейских стран. В то же время, например, в Испании уровень резистентности кишечной палочки к ФХ гораздо выше – 14–22%. Регионы с более высоким уровнем устойчивости E. coli к ФХ существуют и России – это Санкт-Петербург (резистентны 13% штаммов) и Ростов-на-Дону (9,4%).
Анализируя устойчивость E. coli – основного возбудителя амбулаторных и стационарных ИМП в России, можно утверждать, что ФХ (офлоксацин, ципрофлоксацин и др.) могут служить препаратами выбора для эмпирического лечения неосложненных, а в ряде случаев и осложненных ИМП.
Применение офлоксацина для профилактики и лечения ИМП
Острый цистит
Острый цистит является наиболее частым проявлением ИМП. Частота острого цистита у женщин составляет 0,5–0,7 эпизода заболевания на 1 женщину в год, а у мужчин в возрасте 21–50 лет заболеваемость крайне низка (6–8 случаев на 10 тыс. в год). Распространенность острого цистита в России, по расчетным данным, составляет 26–36 млн. случаев в год.
При остром неосложненном цистите целесообразно назначать короткие (3–5-дневные) курсы АБТ.
Однако при хроническом рецидивирующем цистите короткие курсы терапии неприемлемы – продолжительность АБТ для полной эрадикации возбудителя должна составлять не менее 7–10 дней.
При циститах офлоксацин назначают по 100 мг 2 раза в день или по 200 мг 1 раз в день. При хроническом цистите у лиц молодого возраста, особенно при наличии сопутствующих инфекций, передающихся половым путем (в 20–40% случаев вызванных хламидиями, микоплазмами или уреаплазмами), офлоксацин является приоритетным среди других ФХ.
Острый пиелонефрит
Острый пиелонефрит является самым частым заболеванием почек во всех возрастных группах; среди больных преобладают женщины. Заболеваемость острым пиелонефритом составляет в России, по расчетным данным, 0,9–1,3 млн. случаев в год.
Лечение пиелонефрита основывается на применении эффективной АБТ при условии восстановления уродинамики и, по возможности, коррекции других осложняющих факторов (эндокринные нарушения, иммунодефицит и др.). Первоначально проводится эмпирическая АБТ, которую при необходимости изменяют после получения антибиотикограммы; АБТ должна быть длительной.
Офлоксацин может применяться для лечения пиелонефрита с учетом его накопления в паренхиме почек и высоких концентраций в моче, препарат назначают по 200 мг 2 раза в сутки в течение 10–14 дней.
Простатит
Несмотря на успехи современной урологии, лечение хронического простатита по-прежнему является неразрешенной проблемой. Этиопатогенетические представления о хроническом простатите предполагают, что инфекция и воспаление запускают каскад патологических реакций: морфологические изменения в ткани предстательной железы (ПЖ) с нарушением ее ангиоархитектоники, персистирующее иммунное воспаление, гиперсенситизацию автономной нервной системы и др. Даже после элиминации инфекционного агента перечисленные патологические процессы могут сохраняться, сопровождаясь тяжелой клинической симптоматикой. Длительная АБТ рекомендована многими исследователями как компонент комплексного лечения хронического простатита категорий II, III, IV по классификации Национального института здоровья США (NIH, 1995).
Острый простатит (категория I по NIH, 1995) в 90% случаев развивается без предшествующих урологических манипуляций, а примерно в 10% случаев становится осложнением урологических вмешательств (биопсии ПЖ, катетеризации мочевого пузыря, уродинамического исследования и др.). Основой лечения служит ступенчатая АБТ в течение 2–4 нед.
Подавляющее большинство возбудителей бактериальных простатитов относятся к грамотрицательным микробам кишечной группы (E. coli, Klebsiella spp., Proteus spp., Enterobacter spp. и др.). Этиологическими факторами могут быть также C. trachomatis, U. urealiticum, S. aureus, S. saprophyticus, Trichomonas spp., Pseudomonas spp., анаэробы и др. Препаратами выбора для лечения простатита служат ФХ, которые лучше всего проникают в ткань и секрет ПЖ и перекрывают основной спектр возбудителей простатита. Условием успешной АБТ при простатите является ее достаточная длительность – в течение как минимум 4 нед с последующим бактериологическим контролем.
Офлоксацин может с успехом применяться для лечения простатита, так как он высокоактивен против хламидий, а в отношении микоплазм и уреаплазм его эффективность сопоставима с другими ФХ и доксициклином. При хроническом простатите офлоксацин назначают внутрь по 400 мг 2 раза в сутки в течение 3–4 нед. При остром простатите проводят ступенчатую терапию: препарат вначале назначают внутривенно по 400 мг 2 раза в сутки, переходя на пероральный прием после нормализации температуры тела и клинического улучшения состояния.
Рак ПЖ и ИМП
Молекулярные и генетические исследования последних лет свидетельствуют о том, что простатит может инициировать развитие рака ПЖ. Хроническое воспаление активирует канцерогенез за счет повреждения генома клетки, стимуляции клеточной пролиферации и ангиогенеза. Активно проводятся исследования эффективности антибактериальной и противовоспалительной терапии в профилактике рака ПЖ.
Воспалительные изменения ПЖ могут приводить к повышению в крови уровня простатоспецифического антигена (ПСА). Согласно современным рекомендациям повышение уровня ПСА выше возрастных норм является показанием для биопсии ПЖ. Однако при отсутствии подозрительных на рак ПЖ изменений при пальцевом ректальном исследовании возможно применение антибактериальной и противовоспалительной терапии в течение 3–4 нед с последующим контролем уровня ПСА. В случае его нормализации биопсия ПЖ не проводится.
Доброкачественная гиперплазия ПЖ и ИМП
Доброкачественная гиперплазия ПЖ
(ДГПЖ) и симптомы инфекции нижних мочевых путей очень распространены среди мужчин. Основой медикаментозного лечения ДГПЖ являются а-блокаторы и ингибиторы 5а-редуктазы. Однако общеизвестен тот факт, что ДГПЖ почти всегда сопровождается простатитом, который зачастую вносит значительный вклад в клиническую симптоматику. Поэтому АБТ в ряде случаев целесообразна при ДГПЖ. При подтвержденном воспалительном процессе необходимо назначение АБТ на срок 3–4 нед. Препаратами выбора являются ФХ с учетом спектра их антимикробного действия и фармакокинетических особенностей.
Профилактика при урологических вмешательствах
ИМП наиболее часто становятся осложнением таких вмешательств, как трансректальная биопсия ПЖ, катетеризация мочевого пузыря, комплексное уродинамическое исследование и др. По современным стандартам антибактериальная профилактика ИМП является обязательной перед инвазивными урологическими вмешательствами. Это связано с тем, что стоимость антибактериальной профилактики и связанные с ней риски намного меньше риска возникновения и стоимости лечения ИМП. Для профилактики инфекционных осложнений при большинстве трансуретральных манипуляций, а также при трансректальной биопсии ПЖ достаточно назначения одной дозы ФХ за 2 ч до вмешательства (например, 400 мг офлоксацина).
Неразрешенной урологической проблемой является катетер-ассоциированная инфекция. Колонии микроорганизмов формируют так называемые биопленки на инородных материалах, недоступные для действия АБП и антисептиков. АБП не могут ликвидировать уже сформировавшуюся биопленку, но есть данные, что профилактическое назначение ФХ (например, офлоксацина, ципрофлоксацина или левофлоксацина) может предотвращать или замедлять ее образование.
Заключение
Фторхинолоны в течение многих лет с успехом применяются для лечения инфекций мочевых путей. Офлоксацин отвечает принципам рациональной антибактериальной терапии ИМП, его применение целесообразно для лечения и профилактики ИМП – цистита, пиелонефрита, простатита. Наличие пероральной и парентеральной лекарственной форм офлоксацина делает его применение удобным в амбулаторной практике и в стационаре.