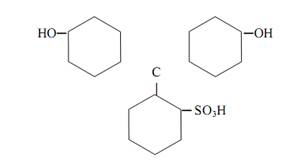
что относят к азоиндикаторам
Большая Энциклопедия Нефти и Газа
Азоиндикатор
Азоиндикаторы часто имеют желтую или оранжевую окраску в нейтральных или щелочных растворах и красную в кислых. Красная кислотная форма метилового оранжевого является амфионом. [1]
Они катализируют реакции аммонолиза, могут быть количественно оттитрованы амидом калия в присутствии специально подобранных индикаторов. Наоборот, в жидких галогепводородах резко повышается сила оснований, очень слабых в амфотерных растворителях. Изучение растворов в жидкой двуокиси серы позволило сформулировать и обосновать представление об апро-тонных кислотоподобных веществах, которые наряду с кислотами могут участвовать в равновесиях с основаниями. Сама двуокись серы относится к числу кислотоподобных веществ. Так, при образовании комплекса с азоиндикатором его спектр изменяется совершенно так же, как при действии протонной кислоты. Причина этого состоит в том, что кислотоподобное вещество содержит координационно ненасыщенный атом, присоединяющийся, подобно протону, к атому основания, являющемуся донором электронов. [11]
Они катализируют реакции аммонолиза, могут быть количественно оттитрованы амидом калия в присутствии специально подобранных индикаторов. Наоборот, в жидких галогенводородах резко повышается сила оснований, очень слабых в амфотерных растворителях. Изучение растворов в жидкой двуокиси серы позволило сформулировать и обосновать представление об апро-тонных кислотоподобных веществах, которые наряду с кислотами могут участвовать в равновесиях с основаниями. Сама двуокись серы относится к числу кислотоподобных веществ. Так, при образовании комплекса с азоиндикатором его спектр изменяется совершенно так же, как при действии протонной кислоты. Причина этого состоит в том, что кислотоподобное вещество содержит координационно ненасыщенный атом, присоединяющийся, подобно протону, к атому основания, являющемуся донором электронов. [12]
Индикаторы группы азосоединений
4.2 Индикаторы группы азосоединений
4.3 Трифенилметановые индикаторы
Трифенилметановые индикаторы. Индикаторы этой группы также часто применяются в кислотно-основном титровании. Все они формально могут рассматриваться как производные трифенилметана. Из индикаторов этой группы распространены фенолфталеины, сульфофталеины, анилинсульфофталеины, бензеины, собственно трифенилметановые красители. Характер таутомерных превращений фталеинов аналогичен описанным выше для фенолфталеина. К фталеинам относятся α-нафтолфталеин, фенолфталеин, тимолфталеин и др. К сульфофталеинам, содержащим сульфогруппу –SO3H в качестве заместителя в ароматических ядрах, принадлежат брокрезоловый зелёный, бромкрезоловый пурпуровый, брофеноловый синий, хлорфеноловый красный и др. Сульфогруппа играет роль ауксохрома. Сульфофталеины обладают интенсивной окраской и резким её изменением при переходе от одной формы индикатора к другой. Различные индикаторы этой группы можно рассматривать в качестве производных фенолового красного
Предполагается, что в растворе феноловый красный претерпевает в зависимости от рН раствора превращения по схеме:
Интервал перехода окраски индикатора наблюдается в пределах рН от
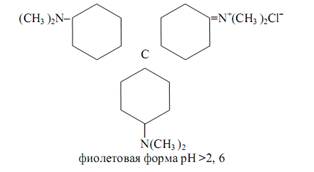
8, 4 (красная). К собственно трифенилметановым красителям относятся кристаллический фиолетовый, малахитовый зелёный, метиловый фиолетовый, пентаметоксикрасный, гексаметоксикрасный. Одним из индикаторов данной группы является кристаллический фиолетовый (кристаллвиолет):
В водных растворах кристаллический фиолетовый протонируется: к атомам азота двух ароматических диметиламиногрупп последовательно присоединяются один или два протона в зависимости от кислотности раствора с образованием зелёной, желтовато-зелёной и оранжевой форм. Интервал перехода лежит в пределах изменения рН раствора от
0,8 (зелёная окраска) до
2, 6 (синяя окраска). Изменение окраски индикаторов этой группы в водных растворах не очень резкое; они чаще применяются при кислотно-основном титровании в неводных средах.
Нитроиндикаторы представляют собой ароматические нитропроизводные, например, паранитрофенол, который в растворе претерпевает превращения:
Интервал перехода лежит в пределах рН от 5, 6 (бесцветный) до 7, 6 (жёлтый). К этой группе индикаторов относятся также мета- и ортонит-рофенолы, динитрофенолы и некоторые другие.
4.5 Индикаторы других структурных групп
Таким образом, как показано выше, в аналитической химии немалую роль играет применение органических реагентов в качественном, количественном анализах, кислотно-основном титровании и других случаях. Качественный анализ имеет большое значение, поскольку частные химические реакции на многие катионы и анионы применяются постоянно в фармацевтическом анализе, фармакопейном анализе для контроля подлинности лекарственных субстанций и компонентов лекарственных форм.
1. Основы аналитической химии. В 2-х книгах под ред. академика РАН Ю.А. Золотова. М.: «Высшая школа», 1996г.
2. Аналитическая химия. В 2-х частях. В.Д. Пономарев. М.: «Высшая школа», 1982г.
3. Аналитическая химия. В 2-х книгах. Ю.Я. Харитонов. М.: «Высшая школа», 2001г.
4. Аналитическая химия. А.Я. Логинов, А.Г. Воскресенский, И.С. Солодкин. М.: «Просвещение», 1973г.
5. Крешков. А.П. Основы аналитической химии, II. т. 1-3, Москва, 1977г.
6. В.Г. Беликов. Фармацевтическая химия. Пятигорск. 1996 г.
7. В.Д. Шаповалова. Фармацевтический анализ лекарственных средств. Харьков, 1995 г.
8. Ф.Б. Коган. Методы идентификации лекарственных препаратов. Киев, 1978 г.
9. Н.Н. Глущенко, Т.В. Плетнёва, В.А. Попков. Фармацевтическая химия. Москва, 2004 г.
Методическая разработка по дисциплине «Химические и физико-химические методы анализа» сборник тестов.
Методическая разработка тестовых заданий при изучении дисциплины «Химические и физико-химические меиоды анализа» предназначена для обучающихся и преподавателей.
Содержимое разработки
ОГАОУ СПО «Губкинский горно-политехнический колледж»
«Химические и физико-химические методы анализа»»
Разработал преподаватель: Протопопова Е.А.
Важным звеном учебно-воспитательного процесса является примерная оценка знаний, умений и навыков студентов. Необходимость контроля в системе обучения объясняется, прежде всего, общественной потребностью в получении информации об эффективности функционирования всей системы учебных заведений.
Контроль является неотъемлемым элементом учебного процесса, благодаря которому реализуется обратная связь в обучении, позволяющая оперативно реализовать его ход.
В последнее время в практику преподавателей входит тестирование как особая форма организации контроля знаний, умений и навыков каждого студента, позволяющая своевременно выявлять проблемы в знаниях и организовывать корректировочное индивидуальное обучение.
Известно, что тесты в обучении – это специальные задания, по результатам выполнения которых, можно судить об уровне знаний и умений испытуемого. Во многих тестах требуется определить из данного перечня общие или специфические свойства веществ, указать возможность протекания химических реакций.
В данной разработке приведены разнообразные тестовые задания, которые можно использовать как при изучении отдельных тем, так и для организации самостоятельной работы студентов.
Тестирование является средством углубления, систематизации, обобщения и закрепления знаний, умений и навыков студентов.
Полнота и всесторонность тестовых заданий обеспечивается включением в содержание его основных элементов учебного материала курса химии, а также и других дисциплин, проверку не только предметных (специальных) знаний, но и усвоение интегрированных знаний, мировоззренческих идей, а также специальных, общеучебных и интеллектуальных умений и навыков.
Ответы на тестовые задания по теме
Тестовые задания по теме
«Химические и физико-химические методы анализа»
Выберите один из предложенных вариантов ответа
1.К классификации методов качественного анализа не относится метод анализа
в) растворение осадка
2.К аналитическим реакциям, проводимым «мокрым» путем нельзя отнести реакцию:
б) окрашивания пламени
в) изменения окраски индикатора
3.В качественном анализе преимущественно проводят реакции
а)с растворами электролитов
б) с неэлектролитами
4.В макрометоде для проведения анализа используют сухое вещество в количестве
5.Выпаривание растворов проводят с целью
а) повышения концентрации раствора
б) понижения концентрации раствора
в) отделения катионов от анионов
6.Операцию центрифугирования проводят с целью
а) отделения осадка от раствора
б) отделения катионов от анионов
в) разделения катионов на аналитические группы
7.Если осадок растворяется медленно, то необходимо
а) добавить избыток растворителя
б) нагреть осадок на водяной бане
в) прокалить осадок в муфельной печи
8.Аморфные осадки солей серной кислоты имеют консистенцию
9.К катионам I аналитической группы относятся катионы
10.К катионам II аналитической группы относятся катионы
11.К катионам IIIаналитической группы относятся катионы
б) Fe 3+ ; Mn 2+ ; Zn 2+
12.К катионам IV аналитической группы относятся катионы
а) Са 2+ ; Ва 2+ ; Sr 2+
б) Bi 3+ ; Fe 2+ ; Sr 2+
в) Cr 2+ ; Са 2+ ; Mg 2+
13.К катионам V аналитической группы относятся катионы
б) Bi 3+ ; Fe 3+ ; As 3+
в) В1 3+ ; Cd 2+ ; Co 2+
14.К катионам VIаналитической группы относятся катионы
а) Cu 2+ ; Fe 2+ ; Мп 2+
б) Mg 2+ ; Sr 2+ ; Sb 3+
b) As 5+ ; Sb 5+ ; Sn 4+
15.Групповым реактивом на катионы II аналитической группы является раствор
в) гидроксида натрия
16.Групповым реактивом на катионы III аналитической группы является раствор
а) гидроксида натрия
17.Групповым реактивом на катионы III аналитической группы является избыток раствора
а) гидроксида аммония
б) гидроксида натрия
18.Групповым реактивом на катионы V аналитической группы является избыток
а) 6Н раствора гидроксида натрия
б) концентрированный раствор гидроксида аммония
в) растворы гидроксида аммония и гидроксида натрия
19.Групповым реактивом на катионы VI аналитической группы является раствор
а) гидроксида натрия
в) концентрированный раствор гидроксида аммония
20.К анионам I аналитической группы относятся
21.К анионам II аналитической группы относятсяанионы
22.Групповым реактивом на анионы I аналитической группы является раствор
23.Групповым реактивом на анионы II аналитической группы является раствор
24.Анализ сухой соли необходимо начинать с:
а) растворения соли
б) подбора растворителя
25.Оценка качества природных вод включает пробы на присутствие ионов:
26.Содержание гидрокарбоната кальция в природных водах обуславливает жесткость:
27.Продукты детского и диетического питания подвергают обязательному исследованию на содержание солей:
28.Гидроксиды железа (II) и марганца обладают свойствами:
29.Гидроксиды катионов (III) аналитической группы
а) хорошо растворимы в воде
б) не растворимы в воде
в) не растворимы в растворах кислот и щелочей
30.Сульфиды катионов III аналитической группы
а) растворимы в воде
б)не растворимы в воде
в) не растворимы в воде, но растворимы в кислотах
31.Железо входит в состав:
32.Марганец, цинк и хром можно отнести к:
в) элементам IV аналитической группы
33.Сульфиды катионов IV аналитической группы имеют окраску
а) растворов черного цвета
б) осадков черного цвета
в) осадков кирпично-красного цвета
34.Раствор соли нитрата серебра применяют в:
35.В водных растворах соли катиона Со 2+ имеют окраску
36.В водных растворах соли катиона Ni 2+ имеют окраску:
38.При отравлении мышьяком появляются симптомы:
а) понижается кровяное давление
б) повышается кровяное давление
в) появляется сухость во рту
39.Большинство анионов I аналитической группы с групповым реактивом образуют соли:
а) растворимые в воде
б) не растворимые в воде
в) не растворимые в кислотах
40.Соли метакремниевой кислоты вследствие гидролиза имеют среду:
41.Большинство солей, образованных анионами III аналитической группы
а) плохо растворимы в воде
б) имеют групповой реактив
в) не имеют группового реактива
42.Более распространенным названием титриметрического метода анализа считается:
43.В основе протолитометрического метода анализа лежит метод
44.К методам редоксиметрии не относится
45.Раствор, концентрация вещества в котором известна с высокой точностью называют
46.К азоиндикаторам относят
б) метиловый оранжевый
47.Перманганатометрическим методом определяют содержание
а) этилового спирта в продуктах питания
б) меди (II) в растворах инсктицидов
в) железа (II) в гербицидах
48.В основе гравиметрического метода анализа лежит закон
в)сохранения массы веществ
49.Термовесы сконструированные Дювалем применяют в методе
а) четырехосновная кислота
б) нитилтриуксусная кислота
в) динатриевая соль этилендиаминтетрауксусной кислоты
51.Колориметрический метод анализа можно отнести к методам
52.Хроматографический метод анализа был предложен
в) JI.B. Писаржевским
53.Какие объем анализируемого раствора и масса анализируемого вещества характерны для микрометода?
54.Какие объем анализируемого раствора и масса анализируемого вещества характерны для макрометода?
55.Предельная концентрация выражается в:
в)граммах на миллилитр (г/мл)
56.Ионное произведение воды – это:
а)отрицательный логарифм концентрации ионов водорода
б)произведение концентраций ионов водорода и гидроксид-ионов
в)отрицательный логарифм концентрации гидроксид-ионов
57.Чему равен фактор эквивалентности серной кислоты в реакции полной нейтрализации?
58.Чему равен фактор эквивалентности орофосфорной кислоты в реакции полной нейтрализации?
59.В каком случае растворимость хлорида серебра будет наибольшей?
а)в дистиллированной воде
б)в растворе нитрата серебра
в)в растворе нитрата натрия
60.В комплексном соединении [Ag(NH3)2]Cl лигандом является:
61.В комплексном соединении [Ag(NH3)2]Cl комплексообразователем является
а) 2н. раствор щелочи
б)2н. раствор аммиака в избытке
в) группового реактива нет
а)2н. раствор серной кислоты
б)2н. раствор соляной кислоты
в)2н. раствор аммиака в избытке
а)2н. раствор аммиака в избытке
б)2н. раствор щелочи
в)2н. раствор серной кислоты
65.Количественное определение значения кислотности почвы относится к методам
а)к методам окислительно-восстановительного титрования
б)к методам комплексонометрического титрования
в)к методам кислотно-основного титрования
66.Количественное определение значения общей жесткости воды относится:
а)к методам окислительно-восстановительного титрования
б)к методам осадительного титрования
в)к методам комплексонометрического титрования
67.Количественное определение содержания активного хлора в растворе относится:
а)к методам окислительно-восстановительного титрования
б)к методам осадительного титрования
в)к методам комплексонометрического титрования
68.Количественное определение хлоридов в растворе титрованием раствором нитрата серебра относится:
а)к методам окислительно-восстановительного титрования
б)к методам осадительного титрования
в)к методам комплексонометрического титрования
69.Количественное определение содержания растворенного кислорода в воде относится:
а)к методам окислительно-восстановительного титрования
б)к методам осадительного титрования
в)к методам кислотно-основного титрования
70.Под какой буквой перечислены только сильные электролиты?
71.Под какой буквой перечислены только слабые электролиты?
72.Под какой буквой перечислены только неэлектролиты?
73.Под какой буквой перечислены только соли, гидролизующиеся по катиону?
74.Под какой буквой перечислены только соли, гидролизующиеся по аниону?
75.Под какой буквой перечислены только соли, подвергающиеся полному гидролизу?
76.Метод анализа, рабочим раствором которого является Na2S2O3
77.Какая из перечисленных операций производится при гравиметрическом анализе?
78.К достоинствам гравиметрического метода анализа относят:
79.Для труднорастворимого соединения Ca3(PO4)2 произведение растворимости выражается как:
80.Какие из перечисленных систем обладают буферными свойствами?
а)ацетат натрия + уксусная кислота
б)хлорид натрия + соляная кислота
в)азотная кислота + нитрат аммония
81.В растворе комплексного соединения K3[Fe(CN)6] можно обнаружить в значительных количествах:
82.Какие из перечисленных терминов являются величинами, характеризующими количественный состав раствора:
83.Метод кислотно-основного титрования, где рабочим раствором является кислота, называется
84.Реакция обменного разложения соли, протекающая под действием воды, называется
85.Отношение концентрации гидролизованных молей к общей концентрации вещества называется
86.Степень окисления калия в соединении К3[Fe(СN)6]
87.Буферным действием обладают растворы:
88.Определить степень окисления хрома в соединении К2Cr2O7:
89.Какой индикатор используется в методе нейтрализации:
90.Определить степень окисления марганца в соединении КМnО4
91.Какая концентрация называется эквивалентной молярной:
б)появление характерного запаха
93.Метод анализа, рабочим раствором которого является КМnО4
94.Специфическим реагентом на катион аммония является:
в)гидроксид натрия NaOH
95.Нитритометрнческнй метод применяют для анализа:
в)ароматических первичных аминов
96.Требования к реакциям в титриметрии:
б)большая скорость реакции
в)растворимый продукт реакции
97.Признаком фиксирования конечной точки титрования является:
а)изменение окраски раствора
в)появление характерного запаха
98.Метод ионообменной хроматографии основан на:
а)различии в распределении веществ между двумя фазами
б)обмене ионами между веществом и сорбентом
в)различной подвижности веществ на сорбенте
99.Химический анализ включает:
100.Способы выражения концентрации титрованных растворов:
б)молярная концентрация эквивалента
Ответы на тестовые задания по теме
«Химические и физико-химические методы анализа»
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| в | а | а | б | б | б | в | б |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| б | в | в | в | а | б | в | а | б | а | б |
| 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 |
| б | б | б | в | б | в | б | а |
| 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| в | б | а | в | в | а | в |
| 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 |
| а | а | в | а | а | б | а | в | б | а | в |
| 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 |
| а | б | а | б | а | а | а | в | в | б |
| 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 |
| а | б | в | а | а |
Дата добавления: 2018-06-27 ; просмотров: 12918 ; Мы поможем в написании вашей работы!
Методическая разработка по дисциплине «Химические и физико-химические методы анализа» сборник тестов.
Методическая разработка тестовых заданий при изучении дисциплины «Химические и физико-химические меиоды анализа» предназначена для обучающихся и преподавателей.
Содержимое разработки
ОГАОУ СПО «Губкинский горно-политехнический колледж»
«Химические и физико-химические методы анализа»»
Разработал преподаватель: Протопопова Е.А.
Важным звеном учебно-воспитательного процесса является примерная оценка знаний, умений и навыков студентов. Необходимость контроля в системе обучения объясняется, прежде всего, общественной потребностью в получении информации об эффективности функционирования всей системы учебных заведений.
Контроль является неотъемлемым элементом учебного процесса, благодаря которому реализуется обратная связь в обучении, позволяющая оперативно реализовать его ход.
В последнее время в практику преподавателей входит тестирование как особая форма организации контроля знаний, умений и навыков каждого студента, позволяющая своевременно выявлять проблемы в знаниях и организовывать корректировочное индивидуальное обучение.
Известно, что тесты в обучении – это специальные задания, по результатам выполнения которых, можно судить об уровне знаний и умений испытуемого. Во многих тестах требуется определить из данного перечня общие или специфические свойства веществ, указать возможность протекания химических реакций.
В данной разработке приведены разнообразные тестовые задания, которые можно использовать как при изучении отдельных тем, так и для организации самостоятельной работы студентов.
Тестирование является средством углубления, систематизации, обобщения и закрепления знаний, умений и навыков студентов.
Полнота и всесторонность тестовых заданий обеспечивается включением в содержание его основных элементов учебного материала курса химии, а также и других дисциплин, проверку не только предметных (специальных) знаний, но и усвоение интегрированных знаний, мировоззренческих идей, а также специальных, общеучебных и интеллектуальных умений и навыков.