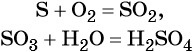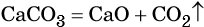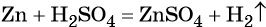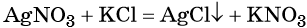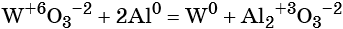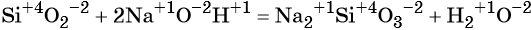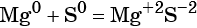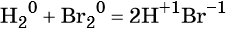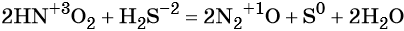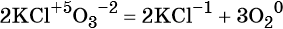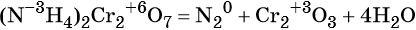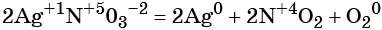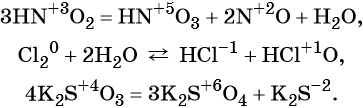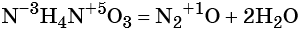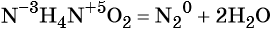что относят к реакциям обмена
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что относят к реакциям обмена
Классификацию органических реакций проводят на основе общих для всех реакций признаков: строение и состав исходных и конечных продуктов; изменение степеней окисления реагирующих частиц; тепловой эффект реакции; ее обратимость и т.п.
Наиболее часто органические реакции классифицируют по следующим признакам:
· по конечному результату реакции (на основе сопоставления строения исходных и конечных продуктов);
· по минимальному числу частиц, участвующих в элементарной реакции;
· по механизму разрыва ковалентных связей в реагирующих молекулах.
Тип многостадийных реакций определяют по самой медленной (лимитирующей) стадии. Различные способы классификации часто сочетаются друг с другом.
1. Классификация реакций по конечному результату
В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций:
Если процесс сопровождается изменением степени окисления атома углерода в органическом соединении, то выделяют также реакции окисления и восстановления. Окисление и восстановление органических веществ может проходить по какому-либо из названных выше типов реакций.
Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку):
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин «замещение», поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы.
C2H6 + Cl2 (на свету) → CH 3 CH 2 Cl + HCl хлорирование этана
CH 3 CH 2 Cl + KOH (водн. р-р) → CH 3 CH 2 OH + KCl щелочной гидролиз хлорэтана
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
К реакциям присоединения относятся также реакции полимеризации:
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
· отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи)
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH → CH 2 =CH 2 + H 2 O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
Реакции изомеризации или перегруппировки
В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава:
В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными).
Например, в результате перегруппировки может изменяться углеродный скелет молекулы:
В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ:
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов:
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2 пиролиз метана (1000 o C)
Реакции окисления и восстановления
Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе.
Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода.
Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]:
Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]:
Классификация реакций по числу частиц, участвующих в элементарной стадии
По этому признаку все реакции можно разделить на диссоциативные (мономолекулярные) и ассоциативные (бимолекулярные, тримолекулярные).
· Мономолекулярные реакции – реакции, в которых участвует только одна молекула (частица):
К этому типу относятся реакции распада и изомеризации. Процессы электролитической диссоциации также соответствуют этому типу, например:
Это самый распространенный тип элементарных реакций.
· Тримолекулярные реакции – реакции типа
в которых происходит столкновение трех молекул.
Тримолекулярные реакции встречаются довольно редко. Одновременное соударение большего числа частиц маловероятно.
Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются нарадикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные («любящие электроны») реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне.
CH2=CH2 + HCl → CH3CH2Cl (электрофил – H + в составе HCl)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
Катион NO2 + образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма – SE (S – substitution [замещение]).
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Строение некоторых нуклеофильных реагентов
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
Примеры нуклеофильных реакций
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Обозначение механизма – AdN (Ad – addition [присоединение]).
Что относят к реакциям обмена
Химическую реакцию, схема которой относят к реакциям
Реакции разложения — химические реакции, в которых из одного, более сложного вещества образуются два или более других, более простых веществ.
Реакция обмена — химическая реакция между двумя соединениями, при которой проходит обмен между обоими реагентами, реакционными группами или ионами.
Реакции соединения — химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество.
Реакции замещения — химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе.
Правильный ответ указан под номером 1.
Реакции соединения соответствует уравнение
1)
2)
3)
4)
Реакции разложения — химические реакции, в которых из одного, более сложного вещества образуются два или более других, более простых веществ.
Реакция обмена — химическая реакция между двумя соединениями, при которой проходит обмен между обоими реагентами, реакционными группами или ионами.
Реакции соединения — химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество.
Реакции замещения — химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе.
Правильный ответ указан под номером 3.
Из предложенного перечня выберите две пары веществ, между которыми протекает реакция соединения.
1) алюминий и серная кислота
2) хлорид кальция и фосфат натрия
3) оксид меди(II) и водород
4) хлорид железа(II) и хлор
5) углекислый газ и оксид бария
Запишите номера выбранных ответов.
Реакции соединения — химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество. Под это описание подходит реакция, протекающая между хлоридом железа(II) и хлором (4) (с образованием хлорида железа(III)), а также углекислым газом и оксидом бария (5) (с образованием карбоната бария).
С какими двумя из перечисленных ниже веществ оксид кальция вступает в реакцию соединения?
Запишите номера выбранных ответов.
Реакции соединения — химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество. Под это описание подходят реакции между оксидом кальция и водой (с образованием гидроксида кальция), а также оксидом кальция и углекислым газом (с образованием карбоната кальция).
Реакция, уравнение которой является реакцией
Реакции разложения — химические реакции, в которых из одного, более сложного вещества образуются два или более других, более простых веществ.
Реакция обмена — химическая реакция между двумя соединениями, при которой проходит обмен между обоими реагентами, реакционными группами или ионами.
Реакции соединения — химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество.
Реакции замещения — химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе.
Правильный ответ указан под номером 4.
Реакции замещения соответствует уравнение реакции
1)
2)
3)
4)
Реакции разложения — химические реакции, в которых из одного, более сложного вещества образуются два или более других, более простых веществ.
Реакция обмена — химическая реакция между двумя соединениями, при которой проходит обмен между обоими реагентами, реакционными группами или ионами.
Реакции соединения — химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество.
Реакции замещения — химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе.
Правильный ответ указан под номером 3.
Из предложенного перечня выберите две пары веществ, между которыми протекает реакция соединения.
2) оксид фосфора(V) и вода
3) сероводород и кислород
4) аммиак и соляная кислота
5) оксид цинка и соляная кислота
Запишите номера выбранных ответов.
Реакции соединения — химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество. Под это описание подходит реакция, протекающая между оксидом фосфора(V) и водой (2) (с образованием ортофосфорной кислоты), а также аммиаком и соляной кислотой (4) (с образованием хлорида аммония).
Из предложенного перечня выберите две пары веществ, между которыми протекает реакция соединения.
3) хлорид натрия и нитрат серебра
4) хлорид железа(II) и хлор
Запишите номера выбранных ответов.
Реакции соединения — химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество. Под это описание подходит реакция, протекающая между азотом и водородом (2) (с образованием аммиака), а также хлоридом железа(II) и хлором (4) (с образованием хлорида железа(III)).
Из предложенного перечня выберите две пары веществ, между которыми протекает реакция соединения.
1) магний и нитрат железа(III)
2) оксид серы(VI) и оксид кальция
3) оксид меди(II) и соляная кислота
Запишите номера выбранных ответов.
Реакции соединения — химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество. Под это описание подходит реакция, протекающая между оксидом серы(VI) и оксидом кальция (2) (с образованием сульфата кальция), а также железом и хлором (4) (с образованием хлорида железа(III)).
В реакцию разложения, сопровождающуюся изменением степени окисления, вступает
1)
2)
3)
4)
В реакцию разложения, сопровождающуюся изменением степени окисления, вступает перманганат калия:
Правильный ответ указан под номером 4.
Гидроксид магния-нерастворимое основание(осадок)и оно раскладывается под температурой на оксид мет.и воду.
Кристина, но при этом не изменяется степень окисления.
В реакцию замещения вступают между собой
1) и
2) и
3) и
4) и
Реакция замещения − это реакция простого вещества со сложным, в результате которой получаются другое простое вещество и другое сложное. Из представленных вариантов простое вещество есть только в варианте 3.
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков.
По числу и составу исходных и полученных веществ различают реакции соединения, разложения, обмена и замещения.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из двух и более простых, например:
Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
По изменению степеней окисления химических элементов, входящих в состав реагирующих веществ, реакции делят на окислительно-восстановительные и не окислительно-восстановительные.
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов:
Не окислительно-восстановительными называют реакции, в которых степень окисления химических элементов, входящих в состав реагентов, не изменяется.
Окислительно-восстановительные реакции разделяют на следующие основные типы: реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Реакциями межмолекулярного окисления-восстановления называют реакции, в которых обмен электронами происходит между различными атомами, молекулами или ионами, например:
(сера — окислитель, магний — восстановитель).
(бром — окислитель, водород — восстановитель).
(окислитель — азотистая кислота, восстановитель — сероводород).
Таким образом, атом-окислитель и атом-восстановитель в данных реакциях принадлежат разным веществам.
Реакциями внутримолекулярного окисления-восстановления называют реакции, в которых атом-окислитель и атом-восстановитель входят в состав одной и той же молекулы.
(окислитель — атом хлора в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
(окислитель — атом хрома в степени окисления +6, восстановитель — атом азота в степени окисления –3).
(окислители — атомы серебра в степени окисления +1 и азота в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
Реакциями диспропорционирования называют реакции, в которых молекулы или ионы одного и того же вещества реагируют друг с другом как окислитель и восстановитель. При этом содержащиеся в данном соединении атомы с переменной промежуточной степенью окисления переходят один в высшую, другой — в низшую степень окисления, например:
Реакциями конмутации называют реакции окисления-восстановления, в результате которых происходит выравнивание степеней окисления атомов одного и того же элемента, например:
(окислитель — атом азота в степени окисления +5, восстановитель — атом азота в степени окислителя –3).
(окислитель — атом азота в степени окисления +3, восстановитель — атом азота в степени окислителя –3).
По тепловому эффекту, сопровождающему химические реакции, их разделяют на экзотермические и эндотермические.
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH 0.
В соответствии с агрегатным состоянием реагентов различают гомогенные и гетерогенные химические реакции.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например твёрдой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Тренировочные задания
1. Реакция 3CaО + P2O5 = Ca3(PO4)2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
2. Реакция Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
3. Реакция H2SO4 + Fe = FeSO4 + H2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
4. Реакция CaCO3 = CaO + CO2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
5. Реакция разложения описана уравнением
6. Реакция соединения описана уравнением
7. К каталитическим процессам относят реакцию между
1) калием и водой
2) серой и хлором
3) азотом и литием
4) азотом и водородом
8. К экзотермическим реакциям относится взаимодействие
1) азота с кислородом
2) углерода с углекислым газом
3) воды с углеродом
4) углерода с кислородом
9. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и хлора
2) брома и водорода
3) гидроксида калия и уксусной кислоты
4) кальция и уксусной кислоты
10. К реакциям замещения относится взаимодействие
1) серной кислоты и гидроксида натрия
2) серной кислоты и железа
3) серной кислоты и оксида натрия
4) серной кислоты и хлорида бария
11. К экзотермическим реакциям относится
1) взаимодействие соляной кислоты и гидроксида калия
2) взаимодействие азота и кислорода
3) гидролиз сульфата меди
4) разложение карбоната натрия
12. К эндотермическим реакциям относится
1) взаимодействие азота и кислорода
2) взаимодействие азотной кислоты и гидроксида лития
3) взаимодействие кислорода и водорода
4) взаимодействие воды и оксида калия
13. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и брома
2) натрия и кислорода
3) оксида калия и воды
4) натрия и уксусной кислоты
14. Взаимодействие брома с гидроксидом калия относится к реакциям
1) нейтрализации
2) межмолекулярного окисления-восстановления
3) диспропорционирования
4) обмена
15. Взаимодействие азота и кислорода относится к реакциям
1) соединения, эндотермическим
2) соединения, экзотермическим
3) разложения, эндотермическим
4) обмена, экзотермическим
16. К эндотермическим реакциям относится взаимодействие
1) азота и лития
2) азота и кислорода
3) кислорода и кальция
4) углерода и кислорода
17. Взаимодействие оксида кальция и воды относится к реакциям
1) каталитическим, экзотермическим
2) разложения, эндотермическим
3) соединения, экзотермическим
4) обмена, эндотермическим
18. К каталитическим экзотермическим реакциям относится
1) получение фосфорной кислоты из оксида фосфора (V) и воды
2) разложение карбоната кальция
3) синтез аммиака из простых веществ
4) получение соляной кислоты из хлора и водорода
19. При нагревании нитрата серебра происходит реакция
1) соединения
2) разложения
3) замещения
4) обмена
20. Реакция, протекающая по схеме: CaCO3 = CaO + CO2 − Q, является реакцией
1) экзотермического разложения
2) разложения
3) замещения
4) эндотермического разложения