Что тяжелее аргон или воздух
Аргон – самый ленивый газ
Содержание
На данный момент известны изотопы аргона с массовыми числами от 29 до 54, но в в земной атмосфере он представлен тремя стабильными изотопами:
История открытия aргона
Аргон был открыт Джоном Уильямом Стреттом (John Strutt) и Сэром Уильямом Рамзаем (Sir William Ramsay) при исследовании азота, полученного из воздуха химическим путем. Несовпадение плотности этого газа при различных способах получения натолкнуло этих ученых на идею о присутствии в воздухе какого-то тяжелого инертного газа, который и был выделен ими в 1894 г. и назван argon, что с греческого переводится как «ленивый», «медлительный», «неактивный».
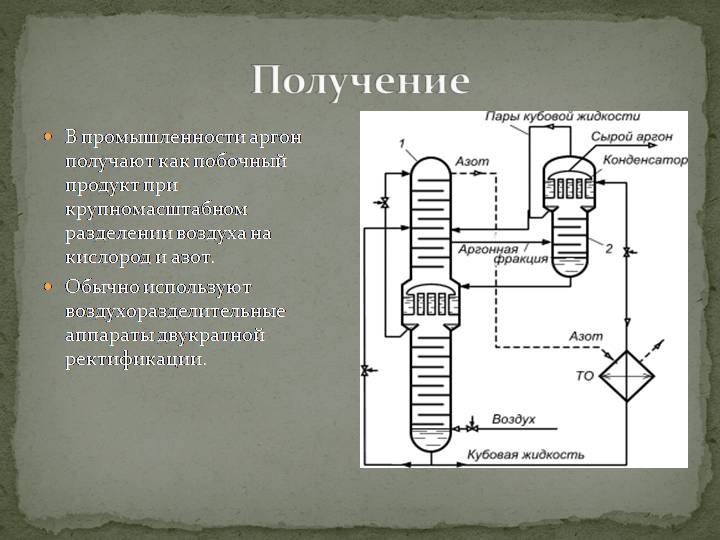
Способы получения аргона
Аргон получают как побочный продукт, при производстве кислорода и азота из воздуха методом низкотемпературной ректификации (см. получение аргона)
Применение аргона
Наиболее часто аргон применяют:
Применение аргона в сварке
Аргон применяют в качестве защитной среды при сварке активных и редких металлов (титана, циркония и ниобия) и сплавов на их основе, алюминиевых и магниевых сплавов, а также хромоникелевых коррозионностойких жаропрочных сплавов, легированных сталей различных марок.
Аргон, являясь более тяжелым, чем воздух, своей струей лучше защищает металл при сварке в нижнем положении. Растекаясь по поверхности свариваемого изделия, он защищает достаточно длительно довольно широкую и протяженную зону как расплавленного, так и нагретого при сварке металла.
Применение аргона позволяет повысить температуру сварочной дуги, что улучшает проплавление сварного шва, увеличивая производительность сварки в целом. При этом проплавление приобретает «кинжальную» форму, что дает возможность выполнять однопроходную сварку в щелевую разделку металла больших толщин. При сварке в среде аргона (как и иных инертных газов) минимизируется выгорание активных легирующих элементов, что позволяет использовать более дешевые сварочные проволоки.
При TIG сварке аргон служит защитой не только для сварочной ванны от вредного воздействия воздуха, а также инертной защитой конца электрода.
Для дуговой сварки в целом аргон применяется гораздо чаще, чем гелий, однако при сварке листового алюминия толщиной менее 6 мм аргон рекомендуют смешивать с гелием, чтобы обеспечить нужную теплопроводность. В некоторых случаях аргонно-гелиевые смеси используют для зажигания дуги, после чего сварка происходит в присутствии гелия. Этот метод применяется для сварки толстолистового алюминия вольфрамовым электродом при постоянном токе.
Вредность и опасность аргона
Аргон не оказывает опасного воздействия на окружающую среду, но относится к асфиксантам (удушающий газ). Поскольку газообразный аргон тяжелее воздуха он может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается содержание кислорода в воздухе, что вызывает кислородную недостаточность и удушье. Поэтому можно сделать вывод, что в больших количествах аргон вреден для организма человека.
Жидкий аргон – низкокипящая жидкость, которая может вызвать обморожение кожи и поражение слизистой оболочки глаз человека.
Хранение и транспортировка аргона
Газообразный и жидкий аргон поставляется по ГОСТ 10157. Хранят и транспортируют газообразный аргон в баллонах по ГОСТ 949 под давлением 15МПа.
Стальные баллоны должны соответствовать ГОСТ 949. Баллон окрашивается в серый цвет с зеленой полосой и зеленой надписью «АРГОН ЧИСТЫЙ».
Возможна транспортировка аргона в жидком виде в специальных цистернах или сосудах Дьюара с последующей его газификацией.
Характеристики аргона
Характеристики Ar представлены в таблицах ниже:
Техническая информация
Аргон
Опасность аргона.
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе. Аргон — третий по содержанию после азота и кислорода компонент воздуха. Аргон — самый распространённый инертный газ в земной атмосфере (в1 м? воздуха содержится 9,34л аргона). Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа.
Аргон – инертный газ с атомной массой 39,9, в обычных условиях – бесцветный, без запаха и вкуса, примерно в 1,38 раза тяжелее воздуха. Аргон считается наиболее доступным и сравнительно дешевым среди инертных газов.
Аргон занимает третье место по содержанию в воздухе (после азота и кислорода), на него приходятся примерно 1,3% массы и 0,9% объема атмосферы Земли.
В промышленности, основной способ получения аргона – метод низкотемпературной ректификации воздуха с получением кислорода и азота и попутным извлечением аргона. Также аргон получают в качестве побочного продукта при получении аммиака.
Газообразный аргон хранится и транспортируется в стальных баллонах (по ГОСТ 949-73). Баллон с чистым аргоном окрашен в серый цвет, с надписью «Аргон чистый» зеленого цвета.
Согласно ГОСТ 10157-79 газообразный и жидкий аргон поставляется двух видов: высшего сорта (с объемной долей аргона не менее 99,993%, объемной долей водяных паров не более 0,0009%) и первого сорта (с объемной долей аргона не менее 99,987%, объемной долей водяных паров не более 0,001%).
Меры безопасности при обращении с аргоном:
• дистанционный контроль содержания кислорода в воздухе ручными или автоматическими приборами; объем кислорода в воздухе должен составлять не меньше 19%;
• при работе с жидким аргоном, способным вызвать обморожение кожи и поражение слизистой оболочки глаз, необходимо использовать защитные очки и спецодежду;
• при работе в атмосфере аргона необходимо использовать шланговый противогаз или изолирующий кислородный прибор.
Применение аргона при сварке
Аргон используется в качестве инертного защитного газа при дуговой сварке, в том числе в качестве основы защитной газовой смеси (с кислородом, углекислым газом). Является основной защитной средой при сварке алюминия, титана, редких и активных металлов.
Аргон также применяется при плазменной сварке в качестве плазмообразующего газа, при лазерной сварке в качестве плазмоподавляющего и защитного газа.
В зависимости от требуемых объемов потребления аргона могут использоваться несколько схем его обеспечения. При объеме потребления до 10 000 м3/г аргон обычно доставляют в баллонах. При объеме потребления свыше 10 000 м3/г аргон целесообразно перевозить в жидком виде в специальных емкостях железнодорожным или автомобильным транспортом. При транспортировке по железной дороге применяются специализированные цистерны 8Г-513 или 15-558. На автомобильном транспорте наиболее часто устанавливаются универсальные газовые емкости типа ЦТК объемом от 0,5 до 10 м3. В этих емкостях также могут транспортироваться кислород и азот.
При централизованном снабжении схемы обеспечения сварочных постов аргоном могут быть следующими:
• непосредственно от транспортной емкости через перекачивающий насос и стационарный газификатор в сеть (см. рисунок ниже);
• от транспортной емкости в стационарную емкость с дальнейшей газификацией и подачей в сеть;
• заполнение баллонов от транспортной газификационной установки.
Сварка нержавейки
Сварка нержавейки – это трудоемкий, но в, то же время, методичный и скрупулезный процесс, требующий от исполнителя четкого следования инструкциям по сварке. Прежде всего, необходимо защитить зону сварки от неблагоприятного воздействия атмосферного воздуха. Это обеспечит надежную сварку нержавеющих сталей. Само качество сварных соединений будет зависеть от проведенной процедуры подготовки нержавеющей проволоки и кромок деталей. Оксидная пленка, которая образуется после горячей обработки, удаляется механическим путем. Сварка нержавейки может осуществляться вольфрамовым электродом при условии постоянного источника тока.
Особенностью сварки нержавейки является содержание в ней хрома, который при высокой температуре образует карбид хрома, нарушающий структуру стали и повышающий в несколько раз ее хрупкость. Именно по этой причине сварка любых типов нержавеющей стали производится в среде инертных газов (гелия, углекислоты, аргона или смесей) или специальных флюсов, защищающих все хромированные химические элементы, которые входят в состав нержавеющей стали.
Способы сварки нержавеющей стали:
На данный момент существует два основных способа сварки нержавейки:
— электродуговая сварка нержавейки вольфрамовым электродом (неплавящимся или плавящимся). Это самый распространенный способ, который применяется не только промышленными предприятиями, но и частными лицами. В процессе сварки происходит повышение стабильности дуги, и уменьшение частоты образования пор при помощи смеси аргона с углекислым газом или кислородом. Сварка вольфрамовым неплавящимся электродом производится с применением постоянного тока прямой полярности, а плавящегося – током с обратной полярностью. Если в нержавеющей стали имеется доля содержащегося алюминия, то ее варят переменным током с целью разрушения окислительной пленки. При проведении ручной дуговой сварки нержавейки вольфрамовым электродом диаметром до двух миллиметров и присадочной проволокой диаметром не более двух миллиметров, сварочный ток будет составлять 60— 80 А для металла в двух миллиметровую толщину. Если толщина составляет четыре миллиметра — то величина сварочного тока не будет превышать 130 А.
— газовая аргоновая сварка нержавейки с использованием инертных газов и их смесей. Она представляет собой гибрид электрической и газовой сварки. От электросварки она позаимствовала электрическую дугу, а от газовой — идентичный метод работы сварщика. Неплавящийся вольфрамовый электрод является сердцем аргоновой горелки. Вольфрам – это металл, который достаточно проблематично поддается плавке. Вокруг электрода образуется керамическое сопло, и из него во время сварки выдувается инертный газ аргон. Если пытаться сваривать деталь без использования аргона — алюминий начнет попросту трещать, гореть и покрываться коркой. Аргон, в свою очередь, препятствует этому процессу и защищает место сварки от попадания воздуха.
Процесс сварки происходит следующим образом: на свариваемые детали подается «масса», как при классической электросварке. Сварщик берет в левую руку присадочную проволоку, а в правую – горелку. Если производится сварка алюминия то, присадочная проволока должна быть изготовлена из идентичного материала (сплавов алюминия «АК» или «АМГ»). Хотя, в девяноста процентах случаев достаточно взять обычный алюминиевый электротехнический провод нужной толщины. На горелке включается кнопка, и производится подача газа. Между деталью и кончиком неплавящегося электрода возникает электрическая дуга. Она и играет роль главного инструмента – осуществляет плавление детали и присадочной проволоки.
Особенности сварочного процесса нержавейки
При сварке нержавейки используются специальные электроды с покрытием из защитно-легирующего состава, у которых стержень самого электрода сделан из высоколегированной специальной стали. Благодаря такому составу при смешивании металла с металлом и расплавлении электродов свариваемых деталей будет поддерживаться постоянный химический состав шва, который по структуре практически не будет отличаться от нержавеющей стали, из которой произведена деталь.
Сварка производится без колебательных движений горелки, углом вперед на короткой дуге. Угол между присадочным материалом и электродом должен составлять не более 90°, и подача присадочной проволоки должна осуществляться непрерывно. После окончания процесса сваривания или обрыва дуги газ должен подаваться непрерывно до тех пор температура металла не опустится до 400°С.
Также кроме специальных электродов, применяемых для сварки, большой популярностью пользуется проволока из нержавейки, изготовленная тем же производителем, что и сталь, при этом для защиты от кислорода места сварки применяются специальные флюсы на основе оксидов или фторидные флюсы. Также на место сварки может подаваться гелий, аргон или смесь других инертных газов. Кроме того для равномерной подачи проволоки и заваривания часто применяются специальные полуавтоматические сварочные установки, в которых автоматический механизм может осуществлять подачу проволоки непрерывно.
Кислород
Кислород — самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47,4 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своём составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
История открытия кислорода.
Впервые кислород был получен 1 августа 1774 года при химических опытах английского химика Джозефа Пристли, который проводил лабораторные работы над оксидом ртути, направляя солнечные лучи с помощью линзы на это соединение. При разложении оксида ртути, Джозефу Пристли удалось выделить простое вещество, которому он дал название «дифлогистированный воздух». В 1775 году Антуан Лавуазье исследовал открытие Джозефа Пристли и установил, что полученный при химической реакции газ, является составным элементом атмосферного воздуха, кислот и многих других веществ. Полученный Джозефом Пристли газ был назван Кислородом. Название «Кислород» произошло от латинского «Oxygenium». Ещё до Пристли, в 1771 году, исследования кислорода проводил шведский химик Карл Шееле. Своему открытию Карл Шееле дал название «огненный воздух», описание которого он изложил в книге. Поскольку публикация книги Шееле произошла позже открытия Пристли, открытие кислорода присвоено именно Джозефу Пристли. В истории открытия кислорода важную роль сыграли опубликованные ранее работы по окислению и разложению ртути, которые проводил французский химик Пьер Байен. Окончательную точку в истории открытия кислорода и итог определения названия открытия поставил французский химик Антуан Лавуазье, оперируя ранее полученными результатами Пристли и Шееле.
Антуан Лавуазье назвал полученный газ «Oxygene». После введения Ломоносовым М. В. слова «кислота» появилось название на русском языке «кислород» (от греч. зн. «рождающий кислоту»).
Получение кислорода.
Получение кислорода происходит двумя способами: промышленным и лабораторным.
Промышленный способ получения кислорода заключается в криогенной ректификации и в применении специальных мембранных кислородных установок.
В лабораториях используют технический кислород (произведённый промышленным путём), который доставляют в металлических кислородных баллонах под давлением 14,7 МПа (150 кгс/см²). В лабораториях получение кислорода ведётся путём нагревания перманганата калия KMnO4, но количество получаемого кислорода не велико. Ещё одним из лабораторных способов получения кислорода является реакция каталитического разложения пероксида водорода, при которой катализатором будет диоксид марганца. При каталитическом разложении хлората калия, также выделяется кислород. Лабораторными способами получения кислорода также являются реакция разложения оксида ртути и электролиз водного щелочного раствора.
Физические свойства кислорода.
Кислород может иметь газообразный, жидкий или твёрдый вид. При нормальных условиях окружающей среды, кислород будет бесцветным газом «парамагнетиком», не имеющим запаха и вкуса. Молекулярная масса кислорода равна 15,9994 г/моль, а масса 1 литра газообразного кислорода равна 1,429 грамма. Следует обратить внимание на то, что кислород слабо растворим в воде или спирте, но обладает высокой растворимостью в расплавленном серебре.
При повышении температуры газообразного кислорода, происходит его обратимый распад на атомы: +2000 C° — 0,03%; +4000 C° — 59%, а при температуре +6000 C° — уже 99,5%.
Оранжевые кристаллы образуются при давлении в интервале 6-8 ГПа. При давлении 10-96 ГПа, цвет кристаллов будет в диапазоне от тёмно-красного оттенка до чёрного цвета. При давлении, превышающем 96 ГПа – кристаллы твёрдого кислорода приобретают металлический блеск и при низких температурах обретают свойство сверхпроводимости.
Химические свойства кислорода.
Применение кислорода.
Кислород применяется в разных областях человеческой деятельности:
Металлургия. Кислород применяется, при производстве стали и при выработке некоторых цветных металлов.
Сварка и резка металлов. При газосварочных работах и резке металлов может использоваться кислород в баллонах.
Ракетное топливо. В ракетном топливе жидкий кислород применяется в качестве мощного окислителя.
Медицина. В медицине кислород используется в металлических кислородных баллонах. Кислород используется в медицинской аппаратуре искусственного дыхания.
Пищевая промышленность. Кислород является зарегистрированной пищевой добавкой E948 и применяется в качестве упаковочного газа.
Химическая промышленность. Кислород – это мощный реактив-окислитель!
Токсические производные кислорода.
Реактивные формы кислорода (в том числе озон) являются очень токсичными для живых организмов продуктами, которые получаются при активировании или частичном восстановлении кислорода.
Углекислота
Углекислый газ CO2 (углекислота, двуокись углерода, диоксид углерода, угольный ангидрид) в зависимости от давления и температуры может находиться в газообразном, жидком или твердом состоянии.
В газообразном состоянии диоксид углерода представляет собой бесцветный газ с немного кисловатым вкусом и запахом. В атмосфере Земли содержится около 0,04% углекислого газа. При нормальных условиях его плотность составляет 1,98 г/л – примерно в 1,5 раза больше плотности воздуха.
Жидкий диоксид углерода (углекислота) представляет собой бесцветную жидкость без запаха. При комнатной температуре она существует только при давлении свыше 5850 кПа. Плотность жидкой углекислоты сильно зависит от температуры. Например, при температуре ниже +11°С жидкая углекислота тяжелее воды, при температуре выше +11°С – легче. В результате испарения 1 кг жидкой углекислоты при нормальных условиях образуется примерно 509 л газа.
В промышленности наиболее распространены 3 способа получения углекислого газа:
Согласно ГОСТ 8050-85 газообразная и жидкая углекислота поставляется трех видов: высшего, первого и второго сортов. Для сварки рекомендуется использовать углекислоту высшего и первого сорта. Применение углекислоты второго сорта для сварки допускается, однако желательно наличие осушителей газа.
Меры безопасности при работе с углекислым газом:
Углекислота не токсична и не взрывоопасна, однако при ее концентрациях в воздухе свыше 5% (92г/м3) снижается доля кислорода, что может привести к кислородной недостаточности и удушью. Поэтому следует опасаться ее скапливания в плохо проветриваемых помещениях. Для регистрации концентрации углекислоты в воздухе производственных помещений применяются газоанализаторы – стационарные автоматические или переносные.
Осмотр внутренней емкости ранее эксплуатируемой цистерны для хранения и транспортирования жидкой углекислоты необходимо проводить в шланговом противогазе. Цистерну необходимо отогреть до температуры окружающей среды, а внутреннюю емкость продуть воздухом или провентилировать. Противогаз разрешается не использовать только после того, как объемная доля углекислоты внутри оборудования станет ниже 0,5%.
Применение углекислого газа при сварке:
Углекислый газ применяется в качестве активного защитного газа при дуговой сварке (обычно при полуавтоматической сварке) плавящимся электродом (проволокой), в том числе в составе газовой смеси (с кислородом, аргоном).
Снабжение сварочных постов углекислым газом может осуществляться следующими способами:
Автономная станция по производству углекислоты – отдельный специализированный цех предприятия, производящий диоксид углерода для собственных нужд и поставки другим организациям. Углекислый газ подается к сварочным постам по газопроводам, проложенным в сварочных цехах.
При небольших объемах потребления углекислого газа или невозможности проведения трубопроводов к сварочным постам для снабжения углекислым газом используются баллоны. В стандартный черный баллон емкостью 40 л заливают 25 кг жидкой углекислоты, которая обычно хранится при давлении 5–6 МПа. В результате испарения 25 кг жидкой углекислоты образуется примерно 12 600 л газа.
Для отбора газа из баллона он должен оснащаться редуктором, подогревателем газа и осушителем газа. При выходе углекислого газа из баллона в результате его расширения происходит адиабатическое охлаждение газа. При высокой скорости расхода газа (более 18 л/мин) это может привести к замерзанию содержащихся в газе паров воды и закупорке редуктора. В связи с этим между редуктором и вентилем баллона желательно размещать подогреватель газа. При прохождении газа по змеевику он подогревается электрическим нагревательным элементом, включенным в сеть с напряжением 24 или 36В.
Для извлечения влаги из углекислого газа применяется осушитель газа. Он представляет собой корпус, заполненный материалом (обычно силикагелем, медным купоросом или алюмогелем), хорошо впитывающим влагу. Осушители бывают высокого давления, устанавливаемые до редуктора, и низкого давления, устанавливаемые после редуктора.
Газ аргон: технические характеристики и применение
Инертные газы практически не вступают в реакцию с другими веществами, поэтому их нельзя использовать, например, для отопления жилища или производства химических соединений. Несмотря на свой «асоциальный характер» такие элементы получили очень большое распространение в промышленности, благодаря наличию очень интересных физических свойств. Газ аргон относится именно к таким элементам.
Об основных качествах аргона, а также о сферах его применения будет подробно рассказано в этой статье.
Аргон: технические характеристики
Аргон представляет собой бесцветный газ, который не оказывает никакого действия на органы вкуса и обоняния. Этот одноатомный элемент является одним из самых распространённых инертных газообразных веществ на земле.
Аргон был открыт в конце XIX века британским учёным Джоном Стреттом. Исследователь проводил опыты по выделению азота из воздуха. В результате экспериментов было выяснено, что азот полученный таким образом имеет немного большую плотность, чем в случае, когда для получения этого газа использовались органические вещества. Учёный предположил, что азот из атмосферы содержит примесь неизвестного на тот момент газообразного вещества. Впоследствии, эти догадки были подтверждены, и аргон был получен в чистом виде и тщательно исследован.
Несмотря на отсутствие соединений аргон, как и другие вещества, обладает физическими свойствами. К наиболее важным характеристикам газа относятся:
Аргон практически не растворяется в воде, а также абсолютно безопасен в плане пожарной активности. Этот газ не ядовит, поэтому при работе с ним не требуется использовать каких-либо средств защиты.
Где применяется аргон
Аргон получил большое распространение в промышленности. Инертные свойства этого газа особенно востребованы в различных производственных процессах, где необходимо вытеснить один из самых активных элементов – кислород. Использование аргона очень дёшево, в сравнении с другими инертными летучими веществами, поэтому газ незаменим в том случае, когда требуется защитная среда при сваривании металлов, а также вытеснение влаги и кислорода в ёмкостях, где хранятся пищевые продукты.
Наполнение колб ламп накаливания инертным газом, позволяет значительно увеличить ресурс работы осветительного прибора. Кроме повышенного срока использования такие элементы обладают большей яркостью. Используется инертный газ и при производстве люминесцентных ламп. Применение аргона позволяет облегчить запуск разряда электрической дуги, а также значительно увеличить ресурс электродов.
При изготовлении стеклопакетов, инертным газом заполняются полости между стёклами, что позволяет значительно улучшить теплоизоляционные свойства. Учитывая тот факт, что аргон является абсолютно прозрачным, использование его никак не ограниченно даже при изготовлении многослойных конструкций.

Благодаря возможности образовывать плазму при относительно невысоком напряжении, этот благородный газ используется в медицине для проведения аргоновой коагуляции. Такой метод успешно используется для удаления новообразований, а также для остановки кровотечений.
Аргон применяется и в химической промышленности. Благодаря отсутствию взаимодействия с другими элементами этот газ используется для получения сверхчистых веществ, а также для их анализа. В металлургической промышленности благородный газ позволяет обрабатывать такие металлы, как: титан, тантал, ниобий, бериллий, цирконий и др. Кроме этого, газ используется для перемешивания расплавленных веществ и снижения окисления хрома при производстве хромированной стали.
Способы получения аргона
Аргон является третьим по распространённости газом в земной атмосфере, поэтому наиболее логичным способом является добывание его из воздуха. Для этой цели используются специальные низкотемпературные ректификационные аппараты.
Процесс отделения инертного вещества осуществляется в такой последовательности:
Температура кипения аргона в ректификационной установке составляет минус 185,3˚С. При этом, кислород кипит при температуре на 3 градуса выше, а азот – на 13˚С ниже этого показателя. По причине небольшого отличия в переходе из одного агрегатного состояния в другое, на первом этапе отделения аргона смесь содержит большое количество жидкого кислорода. На заключительной стадии получения аргона производится отделение благородного газа из кислородно-аргоновой смеси. Процесс доочистки, как правило, осуществляется с помощью электролитического водорода. В результате реакции в контактном аппарате с кислородом образуется водяной пар, который затем утилизируется через влагоотделитель.
Аргон может быть получен не только из атмосферного воздуха. При некоторых производственных процессах этот газ может являться сопутствующим продуктом. Например, при производстве аммиака, аргон является примесью азота и является совершенно ненужным элементом, поэтому полученный таким образом газ имеет очень низкую себестоимость, в сравнении с криогенным аргоном.
Правила хранения и транспортировки
Хранение и перевозка газа осуществляется в специальных металлических баллонах. Несмотря на то, что аргон является инертным газом, к ёмкостям всё равно предъявляются определённые технические требования, нарушение которых приведёт к невозможности использовать сосуд в дальнейшем. Кроме этого, утечка благородного газа в закрытом помещении может вызвать тошноту и потерю сознания у людей, ведь этот газ тяжелее воздуха и способен вытеснить необходимый для дыхания кислород.
Баллоны, используемые для хранения и транспортировки аргона, представляют собой цилиндрические ёмкости, которые могут быть разделены на следующие категории:
Стандартное давление в аргоновом баллоне составляет 150 атм, но в ёмкостях объёмом 40 литров разрешается хранить газ давлением до 200 атм. На ёмкости для хранения аргона наносится информация о дате изготовления и аттестации, а также такие параметры, как вес и объём.
Аргоновые баллоны имеют в верхней части горловины вентиль, с помощью которого можно надёжно перекрыть подачу газа, а также колпак, который защищает запорное устройство от механических повреждений.
Все баллоны, вне зависимости от объёма, окрашиваются в серый цвет и маркируются надписью «Аргон» зелёного цвета.
Транспортировка аргона должна осуществляться по правилам. Автомобили должны маркироваться специальным знаком, которые указывает на перевозку нетоксичных и невзрывоопасных веществ. Все документы оформляются в строгом соответствии с правилами ДОПОГ.
Кроме этого, при перевозке аргона необходимо:
При перевозке аргона в количестве до 18 баллонов (объём 40 л) груз не является опасным, поэтому специальное разрешение не требуется. Тем не менее, даже при перемещении небольших партий следует придерживаться вышеописанных правил транспортировки ёмкостей с этим газом.


