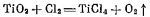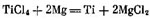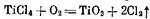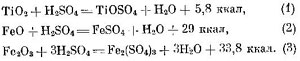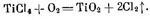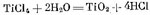Что является побочным продуктом при получении титана
Основы металлургии титана
Титан отличается высокой механической прочностью, коррозионной стойкостью, жаропрочностью (tпл = 1660 °С) и малой плотностью (4,51 г/см 3 ). Его применяют как конструкционный материал в самолетостроении, а также при постройке сосудов, предназначенных для транспортирования концентрированной азотной и разбавленной серной кислот.
Применяют также диоксид TiO2 для производства титановых белил и эмали.
Наиболее распространенным сырьем для получения титана и диоксида титана служит ильменитовый концентрат, выделяемый при обогащении титаномагнетитовых железных руд, в котором содержится, %: 40—60 TiO2,
20 Fe2O3 и 5—7 пустой породы (CaO, MgO, Al2O3, SiO2), причем титан в виде минерала ильменита FeO • TiO2.
Получение титана
Технологический процесс производства титана из ильменитового концентрата состоит из следующих основных стадий: получение титанового шлака восстановительной плавкой, получение тетрахлорида титана хлорированием титановых шлаков, получение титана (губки, порошка) восстановлением из тетрахлорида. Кроме того, зачастую проводят рафинирование полученного титана и иногда переплав для получения титана в виде слитков.
Восстановительная плавка ильменитового концентрата имеет целью перевести TiO2 в шлак и отделить оксиды железа путем их восстановления. Плавку проводят в электродуговых печах. В печь загружают концентрат и восстановитель (кокс, антрацит), их нагревают до
1650 °С. Основной реакцией является: FeO • TiO2 + С = Fe + TiO2 + СО.
Из восстановленного и науглероживающегося железа образуется чугун, а оксид титана переходит в шлак, который содержит 82—90 % TiO2 (титановый шлак).
Получение тетрахлорида титана TiCl4 осуществляют воздействием газообразного хлора на оксид титана при температурах 700—900 °С, при этом протекает реакция: TiO2 +2Cl2 + 2С = TiCl4 + 2СО. Исходным титаносодержащим сырьем при этом является титановый шлак.
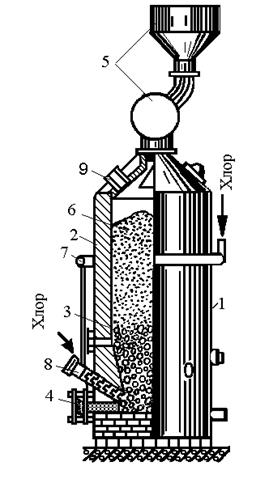
Хлорирование осуществляют в шахтных хлораторах непрерывного действия или в солевых хлораторах. Шахтный хлоратор — это футерованный цилиндр диаметром до 2 и высотой до 10 м, в который сверху загружают брикеты из измельченного титанового шлака и снизу вдувают газ магниевых электролизеров, содержащий 65—70 % Cl2.
Взаимодействие TiO2 брикетов и хлора идет с выделением тепла, обеспечивающего необходимые для процесса температуры (
950 °С в зоне реагирования). Образующийся в хлораторе газообразный TiCl4 отводят через верх, остаток шлака от хлорирования непрерывно выгружают снизу.
Солевой хлоратор представляет собой футерованную шамотом камеру, наполовину заполненную отработанным электролитом магниевых электролизеров, содержащим хлориды калия, натрия, магния и кальция. Сверху в расплав загружают измельченные титановый шлак и кокс, а снизу вдувают хлор. Температура 800—850 °С, необходимая для интенсивного протекания хлорирования титанового шлака в расплаве, обеспечивается за счет тепла протекающих экзотермических реакций хлорирования. Газообразный TiCl4 из верха хлоратора отводят на очистку от примесей, отработанный электролит периодически заменяют. Основное преимущество солевых хлораторов состоит в том, что не требуется дорогостоящее брикетирование шихты. Отводимый из хлораторов газообразный TiCl4 содержит пыль и примеси газов — СО, СO2 и различные хлориды, поэтому его подвергают сложной, проводимой в несколько стадий очистке.
Металлотермическое восстановление титана из тетрахлорида ТіСІ4 проводят магнием или натрием. Для восстановления магнием служат аппараты, представляющие собой (рис. 252) помещенную в печь герметичную реторту высотой 2—3 м из хромо-никелевой стали. После ввода в разогретую до
750 °С реторту магния в нее подают тетрахлорид титана. Восстановление титана магнием ТіCl4 + 2Mg = Ті + 2MgCl2 идет с выделением тепла, поэтому электронагрев печи отключают и реторту обдувают воздухом, поддерживая температуру в пределах 800—900 °С; ее регулируют также скоростью подачи тетрахлорида титана. За один цикл восстановления длительностью 30—50 ч получают 1—4 т титана в виде губки (твердые частицы титана спекаются в пористую массу — губку). Жидкий MgCl2 из реторты периодически выпускают.
Титановая губка впитывает много MgCl2 и магния, поэтому после окончания цикла восстановления проводят вакуумную отгонку примесей. Реторту после нагрева до
1000 °С и создания в ней вакуума выдерживают в течение 35—50 ч; за это время примеси испаряются. Иногда отгонку примесей из губки проводят после ее извлечения из реторты. Восстановление натрием проводят в аппаратах, схожих с применяемыми для магниетермического восстановления. В реторте после подачи TiCl4 и жидкого натрия идет реакция восстановления титана: TiCl4 + 4Na = Ti + 4NaCl. Температура в 800—880 °С поддерживается за счет выделяющегося при восстановлении тепла.
Полученную твердую массу, содержащую 17 % Ti и 83 % NaCl извлекают из реактора, измельчают и выщелачивают из нее NaCl водой, получая титановый порошок.
Рафинирование титана
Для получения титана высокой чистоты применяют так называемый иодидный способ, при котором используется реакция Ti + 2I2 ⇔ TiI4. При температуре 100—200 °С реакция протекает в направлении образования TiI4, а при температуре 1300—1400 °С — в обратном направлении.
Титановую губку (порошок) загружают в специальную реторту, помещаемую в термостат, где температура должна быть на уровне 100—200 °С, и внутри нее спецальным приспособлением разбивают ампулу с иодом. Через несколько натянутых в реторте титановых проволок пропускают ток, в результате чего они накаливаются до 1300—1400 °С. Пары иода реагируют с титаном губки по реакции Ti + 2I2 —> TiI4. Полученный TiI4 разлагается на раскаленной титановой проволоке, образуя кристаллы чистого титана и освобождая иод: TiI4 —> Ti + 2I2. Пары иода вновь вступают во взаимодействие с рафинируемым титаном, а на проволоке постепенно наращивается слой кристаллизующегося чистого титана. Процесс заканчивают при толщине получаемого прутка титана 25—30 мм. Получаемый металл содержит 99,9—99,99 % Ti, в одном аппарате получают
10 кг чистого титана в сутки.
Получение титановых слитков
Для получения ковкого титана в виде слитков губку переплавляют в вакуумной дуговой печи. Расходуемый (плавящийся) электрод получают прессованием губки и титановых отходов. Жидкий титан затвердевает в печи в водоохлаждаемом кристаллизаторе.
Производство титана



Титан как элемент открыт в 1791 г. Его промышленное производство началось в 50-х годах XX века и получило быстрое развитие. Титановые сплавы имеют наиболее высокую удельную прочность среди всех металлических материалов, а также высокую жаропрочность и коррозионную стойкость и находят все более широкое применение в авиационной технике, химическом машиностроении и других областях техники. Титан используют для легирования сталей. Двуокись титана TiO2 используют для производства титановых белил и эмалей; карбид титана TiC — для особо твердых инструментальных сплавов.
Титан по распространению в природе занимает четвертое место среди металлов и входит в состав более чем 70 минералов. К основным промышленным титаносодержащим минералам относятся рутил (более 90% ТiO2) и ильменит TiO2-FeO (60%TiO2). Ильменит входит в состав титаномагнетитов — его смеси с магнитным железняком; они содержат до 20% ТiO2. К перспективным рудам относятся сфен CaO-SiO2-TiO2 (32—42% TiO 2) и перовскит СаО- TiO (60% ТiO 2).
Четыреххлористый титан отделяется и очищается от остальных хлоридов благодаря различию температуры кипения этих хлоридов методом ректификации в специальиых установках.
Производство титана является технически сложным процессом. Двуокись титана TiO2 — химически прочное соединение. Металлический титан (tПЛ = 1725 °С), обладает большой активностью. Он бурно реагирует с азотом при температуре 500—600 °С и кислородом воздуха при 1200—1300 °С, поглощает водород, взаимодействует с углеродом и т. д. Наиболее широкое распространение получил магниетермический способ, осуществляемый по следующей технологической схеме: титановая руда ® обогащение ® плавка на титановый шлак ® получение четыреххлористого титана TiCl4 ® восстановление титана магнием.
Обогащение титановых руд. Титаномагнетиты и другие бедные руды обогащают электромагнитным и другими способами, получая концентрат, содержащий до 50 % TiO2 и около 35 % Fe2O3 и FeO.
Плавку на титановый шлак проводят в электродуговой печи. Шихтой служат прессованные брикеты, состоящие из мелкоизмельченного концентрата, антрацита или угля и связующего (сульфитный щелок). В результате плавки получают богатый титановый шлак, содержащий до 80 % TiO2. Побочным продуктом является чугун, содержащий до 0,5 % Ti. Измельченный шлак подвергают магнитной сепарации (для удаления железосодержащих частиц), смешивают с мелким нефтяным коксом и связующим и спрессовывают в брикеты. После обжига при 700—800 °С брикеты направляют на хлорирование.
Получение четыреххлористого титанаTiCl4 в герметизированных электрических печах представлено на рис. 2.9.
Нижнюю часть печи заполняют угольной (графитовой) насадкой, которая служит электрическим сопротивлением и нагревается при пропускании электрического тока. В реакционной зоне печи выше уровня угольной насадки развивается температура 800…850 °С. При хлорировании образуется четыреххлористый титан по реакции TiO2+2C-T2Cl2=TiCl4+2CO. Пары четыреххлористого титана находятся в паро-газовой смеси, содержащей SiCl4 и другие хлориды; СО, С12 и другие газы.
Ее очищают от твердых частиц и охлаждают в конденсаторах, в результате чего получают жидкий четыреххлористый титан. Для более полной очистки от твердых частиц конденсат отстаивают и фильтруют.
Четыреххлористый титан отделяют от других хлоридов путем ректификации конденсата, основанной на различии температур кипения различных хлоридов. Жидкий четыреххлористый титан направляют на восстановление.
В настоящее время для получения четыреххлористого титана начинают применять другие способы хлорирования: в хлоратоpax непрерывного действия, в солевом расплаве; перспективным является хлорирование в кипящем слое.
Восстановление титана магнием из TiCl4проводят в герметичных реакторах (ретортах) из нержавеющей стали, установленных в электрических печах сопротивления. После установки в печь из реторты откачивают воздух и заполняют ее очищенным аргоном; после нагрева до температуры 700° С заливают расплавленный магний и начинают подачу жидкого TiCl4. Титан восстанавливается магнием по реакции TiCl4+2Mg=Ti+2MgCl2. Эта реакция сопровождается выделением большого количества тепла и в реакторе поддерживается необходимая температура 800…900 °С без дополнительного нагрева за счет регулирования скорости подачи TiCl4. Частицы восстановленного титана спекаются в пористую массу (титановая губка), пропитанную магнием и хлористым магнием. Расплав хлористого магния периодически удаляют через патрубок в дне реактора. В промышленных реакторах (емкостью до 2 т) получают титановую губку, содержащую до 60% Ti, 30 °/o Mg и 10 % MgCl2.
Получение титановых слитков. Титановые слитки получают переплавкой титановой губки в вакуумных электрических дуговых печах. Расходуемый электрод изготавливают прессованием из измельченной титановой губки. Электрическая дуга горит между расходуемым электродом и ванной расплавленного металла, постепенно заполняющего изложницу, затвердевающего и образующего слиток.
Наличие вакуума предохраняет металл от окисления и способствует его очистке от поглощенных газов и примесей.
Для получения слитков может быть использована дробленая титановая губка, загружаемая в печь дозатором. В этом случае дуга горит между расплавленным металлом и графитовым электродом, поднимаемым по мере заполнения изложницы металлом.
Для обеспечения высокого качества слитков плавку повторяют два раза. При второй плавке расходуемым электродом служит слиток, полученный при первой плавке.
Титановые сплавы выплавляют в электрических дуговых вакуумных печах, аналогичных применяемым для переплавки титановой губки. В качестве шихтовых материалов используют титановую губку и легирующие элементы в соответствии с заданным химическим составом сплава. Из шихты прессованием при 280….330 °С изготавливают переплавляемый (расходуемый) электрод. Плавку ведут в вакууме или в атмосфере аргона. Перед началом плавки на поддон в качестве затравки насыпают слой стружки из сплава такого же состава. Для более равномерного распределения легирующих элементов в сплаве полученный слиток переплавляют вторично.
Натриетермический способ получения титана отличается от магниетермического тем, что титан из TiCl4 восстанавливают металлическим натрием. Этот процесс проводят при относительно невысокой температуре, и титан в меньшей степени загрязняется примесями. Вместе с тем натриетермический способ технически более сложен.
Кальциееидридный способ основан на том, что при взаимодействии двуокиси титана TiO2 с гидридом кальция СаН2 образуется гидрид титана ТiH2, из которого затем выделяется металлический титан. Недостаток этого способа состоит в том, что получаемый титан сильно загрязнен примесями.
Иодидный способприменяют для получения небольших количеств титана очень высокой чистоты, до 99,99%. Он основан на реакции Ti+2I2 « TiI4, которая при 100 …200 °С идет слева направо (образование Til4), при 1300…1400 °С —в обратном направлении (разложение ТiI4).
Рафинируемую титановую губку помещают в реторту и нагревают до 100…200 °С; внутрь реторты вводят и разбивают ампулу с йодом, взаимодействующим с титаном по реакции Ti+2I2 ® TiI4. Разложение TiI4 ® Ti+2I2 и выделение титана происходит на титановых проволоках, натянутых в реторте, нагретых до 1300… 1400 °С пропусканием тока.
Получение титана и его соединений из природных концентратов
Современная техника и промышленность используют три вида титановой продукции:
получение хлорида титана:
восстановление хлорида титана магнием:
Из природных концентратов сразу на хлорирование могут направляться только рутиловые концентраты, содержащие 94-96% TiО2. Но этих концентратов, как мы видели, сравнительно мало (около 10% массы всего природного титанового сырья), поэтому в основном на металлургическую переработку идут ильменитовые концентраты, содержащие от 35 до 65% TiО2. Хлорировать такие концентраты невыгодно, так как значительная часть хлора пойдет на образование хлоридов других металлов, в основном железа. Увеличится расход хлора на единицу титановой продукции, появится много отходов, которые надо будет утилизировать. Поэтому природные ильменитовые концентраты металлургическими методами вначале обогащают, т. е. делают такие искусственные титановые продукты, в которых содержанке TiО2; составляет не менее 70%, а лучше 85-95%.
Такие высокотитановые искусственные продукты получают двумя путями: химико-гидрометаллургическим переделом ильменитовых концентратов на искусственный рутил, содержащий 95-98% TiО2, или электроплавкой концентратов на титановый шлак, содержащий 70-85% TiО2.
Наиболее распространенным способом подготовки природных ильменитовых концентратов к хлорированию в целях повышения содержания TiО2 в исходном сырье является его плавка на шлак. В настоящее время в мире выплавляется 1,2-1,5 млн т титановых шлаков в год (без СССР), которые идут на производство металлического титана или используются для получения белого пигмента.
Печь загружают шихтой из тонкоизмельченного концентрата и антрацита. После разогрева шихты до 900- 1200° С она расплавляется, и за 2-3 ч (в зависимости от мощности печи) происходит сначала образование, а затем, в течение 1-1,5 ч, доводка шлака, отстой и перегрев шлака в печи. Затем расплав шлака выпускают в изложницы и через 20-40 мин перевозят для остывания на специальную площадку, где они находятся около 6-8 ч. Остывшие слитки шлака извлекаются из изложниц мостовым краном и доставляются на склад горячего шлака. Здесь они рассыпаются из-за того, что имевшиеся в слитке низшие оксиды титана окислились.
После полного остывания разложившийся шлак дробится, измельчается и подвергается магнитной сепарации для удаления корольков железа.
Расплавленный железный чугун из нижней части печной ванны разливается в песчаные формы, откуда после охлаждения извлекается, дробится и в железнодорожных вагонах отправляется предприятиям черной металлургии.
Весь процесс плавки шихты титанового концентрата продолжается 4,5-6,5 ч. В печь загружается примерно 28 т шихты, выход готового титанового шлака составляет 51-52% загруженной шихты. В шлак извлекается 90-95% титана.
Следует отметить, что более мощные печи (от 10 MВ•A и выше) полузакрытого и закрытого типов имеют значительно лучшие технологические показатели, чем открытые печи. В закрытых печах увеличивается загрузка шихты на плавку, снижается время плавки и расход электроэнергии, увеличивается календарная производительность печи, повышается извлечение титана в шлак.
За рубежом главным производителем титановых шлаков является Канада. Здесь плавятся сравнительно бедные, содержащие всего 35-38% TiО2, титановые концентраты месторождений района Лак-Тао. Перед планкой их обжигают в огромных, длиной более 60 м, вращающихся печах для удаления серы, затем в нагретом виде смешивают с антрацитом и порошковая шихта подается на плавку в мощные (от 24 до 75 MВ•А) шестиэлектродные печи закрытого типа. Здесь получают два типа шлаков: первый содержит 70-72% TiО2 и предназначен для производства пигментной двуокиси титана: второй, с содержанием 74-76% TiО2, идет на хлорирование для получения металлического титана. Кроме того, шлаки содержат несколько процентов оксидов железа, магния, кремния, алюминия, десятые доли процента оксидов марганца, хрома, ванадия, сотые доли процента серы, фосфора, углерода.
Применяемые в Канаде электропечи имеют большую единичную мощность: каждая из них может перерабатывать в непрерывном процессе 340-460 т шихты в сутки и выпускать 140-190 т шлака ежесуточно.
Следующим переделом на длинном пути к получению металла является хлорирование титановых шлаков. Это процесс взаимодействия весьма реакционно-способного хлора, одного из самых сильных окислителей, с оксидами металла. Преимущество данного метода состоит в том, что хлориды металлов имеют более низкую температуру плавления и кипения, чем оксиды или другие их соединения. Кроме того, хлориды металлов довольно резко отличаются друг от друга по физическим свойствам: температурам кипения, плавления, сублимации. Все это позволяет выделять из сложного по составу природного сырья хлориды различных металлов при более низких температурах, т. е. со значительной экономией энергозатрат и по более простой технологии.
В промышленном хлораторе он загрязнен многими примесями, как механическими, так и растворенными в нем. Отсюда и цвет жидкости от коричневого до темно-бурого. В основном это примеси хлоридов различных элементов, содержащихся в исходной шихте (кремния, алюминия, магния, марганца, кальция, ванадия и др.), и газов (фосгена, кислорода, азота). От всех этих примесей TiCl4 надо очистить. Очистка (так называемая ректификация) его довольно сложный процесс. Для отделения твердых взвесей применяются операции отстаивания и фильтрации, которые производятся в герметичных отстойниках, используются также фильтровальные установки различных типов с фильтрами из керамики, металлокерамики, стеклоткани и тому подобных кислотостойких материалов.
После отделения механических примесей и взвесей жидкий раствор TiCl4 очищают от растворенных в нем примесей. В первую очередь освобождаются от соединений ванадия. Извлечь этот ценный элемент можно с помощью медного порошка, сероводорода или смеси трехвалентных хлоридов титана и алюминия.
В результате сложных реакций ванадия с низшими хлоридами образуются нерастворимые соединения, которые перед дальнейшей ректификацией жидкого TiCl4 выводятся из процесса. Соединения ванадия и некоторых других редких элементов, содержащихся в жидком TiCl4, имеют важное клиническое значение.
Осветленный после извлечения ванадия TiCl4 подвергают дальнейшей очистке методами ректификации. Этот процесс представляет собой многократную перегонку жидкой смеси, в которой различные соединения разной летучести кипят и возгоняются в парогазовую фазу при различных температурах. Ректификация жидкого TiCl4 производится в специальных аппаратах, состоящих из куба, ректификационной колонки и конденсатора. В кубе-испарителе жидкость нагревается, и образовавшиеся пары поступают в колонку, проходя ее снизу вверх. Отсюда они поступают в конденсатор, где охлаждаются, и в виде чистого дистиллята выводятся из процесса. Так получают совершенно чистый, практически свободный от примесей и растворенных газов жидкий TiCl4, суммарное количество примесей в нем не превышает 0,01%.
При любом технологическом способе металлургическое восстановление очищенного TiCl4 производится в герметичном реакторе, заполненном аргоном. В этот реактор подают расплавленный, очищенный от примесей магний и тут же начинают нагревать TiCl4. Оба вещества, вступая друг с другом в контакт, начинают бурно реагировать: магний «разрывает» TiCl4 на титан и хлор. Реакция идет бурно, с выделением большого количества тепла, подобно пожару: горит тонкий слой в месте соприкосновения расплава магния и жидкого тетрахлорида. Все это время реактор охлаждается потоками воды.
Внутри реактора освобожденный титан в виде хлопьев собирается в сгустки и оседает на стенках и дне сосуда. Когда прореагирует вся загруженная масса магния и TiCl4 (они берутся по расчету) и реактор заполнится получаемыми продуктами, его извлекают краном из печи, охлаждают, разбирают и в открытом виде помещают в специальный аппарат, где полученный титан нагревают в вакууме для удаления испарением из толщи рыхлого металла загрязняющих примесей.
После этого титан, прикипевший к стенкам реактора, механическими способами (отбойным молотком) удаляют из него. Полученный металл представляет собой рыхлую запекшуюся массу пепельно-серого цвета, похожую на застывшую лаву, с многочисленными порами, пустотами, хрупкую, легко крошащуюся на мелкие куски. Эта металлическая масса своей легкостью и пористостью похожа на губку, почему и получила название «титановая губка». В целом это уже довольно чистый металл, но некомпактный, хрупкий, к обработке непригодный, содержащий остатки хлористого и металлического титана. Остатки хлоридов интенсивно поглощают воду из воздуха, что ухудшает качество металла. Поэтому все операции по сбору, обработке губки ведут в помещениях с сухим воздухом, а перевозят ее в герметичных контейнерах.
Титановая губка, очищенная от примесей, является исходным материалом для получения компактного металлического титана в виде слитков, листов, лент, прутков и т. п. Для этого производится уплотнение губки на гидравлических прессах и ее переплавка. Уплотненные секции титановой губки сваривают в длинные, весящие сотни килограммов электроды, которые в дуговых электропечах под действием постоянного тока силой в несколько тысяч ампер медленно расплавляются в слитки. Затем остывшие слитки первой планки сваривают по два-три в новые электроды и расплавляют повторно в других, более производительных печах. Этот двойной переплав требует много электроэнергии: на каждую тонну чистого титанового слитка расходуется около 5 тыс. кВт•ч электроэнергии.
Незначительные добавки в титан таких элементов, как марганец, хром, ванадий, олово, резко улучшают прочностные и другие свойства титана.
Получение пигментной двуокиси титана. Так же как и металлический титан, двуокись титана имеет самостоятельное, очень большое значение во многих областях промышленности и техники.
В связи с этим в США, Англии, Франции и других странах в начале 50-х гг. начал развиваться так называемый хлорный способ получения пигментной двуокиси титана. Он основан на «сжигании» очищенного от примесей тетрахлорида титана. Получение пигментной двуокиси титана идет по реакции
Хлорная технология имеет ряд преимуществ перед сернокислотной: она высокопроизводительна и непрерывна, поддается высокой степени автоматизации, практически безотходна, хлор может возвращаться в процесс хлорирования титанового шлака. В то же время хлорный метод получения титанового пигмента сложнее и дороже сульфатного. Поэтому он пока не получил широкого распространения в мировом производстве пигментной двуокиси титана.
В природных условиях двуокись титана существует в виде трех кристаллических модификаций тетрагональной сингонии:
Более подробные минералогические сведения об этих модификациях приводились выше, здесь же отметим, что наиболее прочную, химически инертную форму двуокиси титана представляет собой только рутил. При всех химических реакциях получения двуокиси титана сначала образуется анатаз, а уж в дальнейшем в результате специально проводимых реакций он переходит в рутил.
Долгие годы пигментная двуокись титана выпускалась лишь анатазной формы. Примерно до 1949 г. считалось, что белый пигмент высокого качества может быть только анатазом. При производстве пигмента применялись даже специальные приемы для предотвращения образования рутила, например добавляли калий в виде поташа при прокаливании метатитановой кислоты. Такое представление о малопригодности пигмента рутильной формы было связано с тем, что полученные в конце 30-х гг. первые партии рутильного диоксида титана не имели удовлетворительных пигментных свойств из-за низкой по сравнению с анатазом дисперсности и желтизны. Желтели эти первые пигменты из-за наличия в них низших окислов титана, а плохая дисперсность обусловливала высокую абразивность рутила, отрицательно сказывавшуюся при перетирании пигмента с пленкообразующим веществом.
Тонкодисперсная двуокись титана рутильной формы белого цвета была получена лишь к 1950 г. По сравнению с анатазным рутильный пигмент имел более высокую разбеливающую способность, лучшую перетираемость, укрывистость и другие свойства. Важнейшим является более высокая химическая инертность рутильного пигмента, что связано с более компактным и симметричным расположением атомов в кристаллической решетке рутила по сравнению с анатазом.
Наружные покрытия лакокрасочными материалами с анатазным пигментом недолговечны: уже через несколько недель после их нанесения начинается процесс «меления» наружного слоя покрытия. Происходит это потому, что двуокись титана анатазной модификации становится под действием ультрафиолетовых лучей солнечного спектра своеобразным катализатором, ускоряющим образование на поверхности покрытия перекисных соединений, разрушающих органическую часть пленкообразователя. Частицы TiO2 при этом, сами не разрушаясь, освобождаются от оболочки последнего и образуют белый тонкодисперсный пачкающий налет на поверхности покрытия. Если меление незначительное, то оно оказывается даже полезным, так как смывание дождями поверхностного налета, быстро чернеющего от частиц пыли, грязи, особенно в атмосфере промышленных центров, обеспечивает непрерывную очистку поверхности, и здания сохраняют первоначальную чистую, яркую окраску долгие годы. В случае использования рутильного пигмента, слабо поддающегося фотохимическому эффекту под действием ультрафиолетовых лучей, срок службы наружного покрытия значительно увеличивается. Применение анатазного пигмента приводит к значительному и быстрому мелению, в результате чего пленка покрытия растрескивается, теряются ее защитные свойства, и начинается коррозия изделия под пленкой. Поэтому с 50-х гг. выпуск рутильной модификации двуокиси титана стал непрерывно возрастать, и в настоящее время он составляет почти 100% мирового производства пигмента.
Принципиальная технологическая схема получения рутильной двуокиси титана сульфатным способом предусматривает проведение целого ряда переделов ильменитового концентрата; его сушку и измельчение, растворение в серной кислоте, выщелачивание сульфатов, восстановление железа, очистку раствора, его упаривание, выделение сульфатов титана, прокалку и т. д.
Как видно из этих уравнений, все реакции идут с большим выделением тепла, однако при разложении высокотитанистых концентратов тепла не хватает, и для поддержания температуры 200°С его приходится подводить извне в смесь концентрата с кислотой.
Пигментную двуокись титана получают также хлорным способом. Стремительное развитие его, особенно в США, объясняется сокращением в 50-х гг. производства металлического титана и освобождением в связи с этим мощностей по выпуску тетрахлорида титана. В дальнейшем темпы роста хлорного производства титановых пигментов не снижались, что объясняется довольно чистой его экологией (отсутствие отходов и стока кислых вод) и высоким качеством пигмента (большая яркость, белизна и чистота тонов).
Исходным сырьем для изготовления пигментов является тетрахлорид титана, получаемый в основном из титановых шлаков или из рутилового концентрата. Эти материалы шихтуют с антрацитом, затем после брикетирования и гранулирования их хлорируют хлоргазом. Образованный тетрахлорид титана очищают от примесей и в жидком состоянии используют для получения двуокиси титана. Технология переработки готового тетрахлорида титана может идти двумя путями: сжигания его паров в кислороде и гидролиза водяным паром.
В первом случае пары тетрахлорида титана получают в специальном испарителе, смешивают с равным объемом азота и смесь вместе с нагретым воздухом пропускают через трубку, нагретую снаружи до 1100° С. В трубке происходит реакция
Этот метод вызывает определенные трудности из-за необходимости, во-первых, применять аппаратуру из специальных материалов, стойких к воздействию хлорводорода, а во-вторых, утилизировать соляную кислоту.
Сравнивая качество титановых пигментов, полученных сульфатным и хлоридным методами, надо отметить, что различия незначительны. По дисперсности, белизне, яркости и интенсивности пигментная двуокись титана, полученная хлорным методом, несколько превосходит сульфатную двуокись титана, но атмосферостойкость и склонность к мелению последней и фотохимический эффект «хлорного» продукта выше. Для снижения этого эффекта требуется дополнительная обработка хлорного пигмента. Себестоимость производства двуокиси титана хлорным методом, по данным различных источников, несколько выше, чем сульфатным. Но это в значительной мере зависит от местных условий: наличия сырьевых ресурсов, стоимости электроэнергии, возможностей и затрат на утилизацию отходов и т. д. В целом хлорный метод производства пигментной двуокиси титана считается более прогрессивным и перспективным.
Первые опыты по получению ферротитана из отечественного сырья проводились ещё в 1928-1929 гг. профессором С. С. Штейнбергом и инженером П. С. Кусакиным. Они плавили концентрат в дуговой электропечи и получали ферротитан, содержащий до 17% титана и 5% углерода.
В 1932-1933 гг. в Ленинградском институте металлов, а затем в 1934 г. в Московском институте стали, в лаборатории электрометаллургии, были проведены исследования по алюмотермическому методу получения ферротитана из отечественных руд. В результате этих работ был предложен алюмотермический способ получения в печи ферротитана из ильменитовых руд Кусинского месторождения. В конце 1930 г. этот способ внедрили на Чусовском заводе ферросплавов. Годом позже бригадой под руководством П. П. Шипулина (Ленинградский институт металлов) был разработан и внедрен внепечной способ алюмотермического получения ферротитана восстановлением окислов металлов алюминием. Шихта порошкообразного ильменитового концентрата в смеси с порошковым алюминием и обрезками металлического титана засыпается в плавильную открытую печь (своеобразный тигель) и поджигается с помощью запальной смеси. Окисление алюминия и восстановление окислов титана и железа концентрата происходят с выделением большого количества тепла. При температуре 1900-2400° С концентрат переплавляется с большой скоростью. Образующийся металл (железо) и шлак (ферротитан) хорошо разделяются. Алюмотермическое производство легирующих сплавов широко применяют и для других трудновосстановимых металлов: ниобия (феррониобий), циркония, бора, хрома и др.
Наряду с ферротитаном в черной металлургии используются титаножелезистые сплавы с углеродом (феррокарботитан: 74-75% железа, 16-17% титана, 7-9% углерода) и с кремнием (ферросиликотитан: 50% железа, 30% титана, 20% кремния).
Вы можете купить перчатки сварщика цена конкурентная