дихромат калия для чего
Дихромат калия: получение, применение, волшебные реакции с участием реагента
Химические элементы, из которых состоит всё сущее, могут образовывать невероятные соединения. Они обладают уникальными свойствами и участвуют в синтезе важнейших веществ, применяемых в промышленности. Одним из таких соединений является дихромат калия, о котором расскажет данная статья.
Физические свойства
Температура плавления довольна низка и составляет всего 396 ⁰C. При 610 ⁰C происходит полное термическое разложение с образованием K2CrO4, трехокиси хрома (III) и кислорода.
Получение и очистка
Для получения K2Cr2O7 используется раствор натриевого хромпика и хлорида калия. Их смешивают и подвергают сильному нагреванию до температуры 1200 ⁰C. В таких условиях протекает реакция обмена:
Для очистки кристаллов в лабораторных условиях используют метод перекристаллизации. Готовят раствор, разводя 100 граммов дихромата калия в 1 литре горячей воды. Его тщательно перемешивают, фильтруют и подвергают упариванию так, чтобы от первоначального объёма осталось около 1/7. Остаток охлаждают при постоянном перемешивании. Таким путем образуются мелкие кристаллы, которые следует отфильтровать под тягой при помощи воронки Бюхнера. В процессе нужно провести три промывания очень холодной водой.
Трёхкратная перекристаллизация позволит получить образец с содержанием реагента дихромат калия от 99,92 до 100 %. Чтобы добиться такой чистоты готовят раствор из 100 граммов препарата и 150 мл кипятка. Его хорошо перемешивают и выливают тонкой струйкой в эксикатор или фарфоровую чашку. По мере охлаждения образуются кристаллы, которые фильтруют на пористой стеклянной воронке или платиновом конусе. Проводится сушка при 100 ⁰C в течение 2—2,5 часов. Полученное твердое образование дробят и продолжают прогревать при 200 ⁰C ещё в течение 12 часов. Такую последовательность действий повторяют 3 раза.
Окислительные свойства
Одним из сильнейших окислителей является дихромат калия. Химические свойства этого вещества можно наблюдать в следующих опытах:
Опыт «Извержение вулкана»
Одним из наиболее впечатляющих химических опытов является «извержение вулкана». Его демонстрация потребует специального оборудования, нацеленного на защиту органов дыхания. Для эксперимента придётся прикрыть кожные покровы и надеть респиратор, ведь продуктом реакции станет ядовитая трехокись хрома, которая вредна для человека.
На несгораемую подложку, в качестве которой можно использовать асбестовое полотно, кафель или кристаллизатор, помещается небольшая кучка двухромовокислого калия (альтернативный реагент (NH4)2Cr2O7). В центре сделайте углубление, капните спирт и подожгите его. По мере горения происходит разложение хромпика с образованием кислорода. Газ включается в реакцию и обеспечивает эффект синего пламени. На лабораторном столе бушует настоящий вулкан! Остальными продуктами горения станут K2CrO4, трехокись хрома (III). Эти вещества очень токсичны, при попадании на кожу вызывают ожоги и изъязвления.
«Фараонова змея»
Не менее интересен опыт под названием «фараоновы змеи» с использованием реактива дихромат калия. Реакции с его участием выглядят впечатляюще: растворы меняют цвет, кристаллы разлагаются с образованием окрашенного в зелёный оттенок оксида Cr2O3.
Чтобы получить «змею», разотрите в ступке смесь из равных частей хромпика и сахара, добавьте половину порции нитрата натрия. Все компоненты увлажните и подмешайте немного коллодия. Возьмите стеклянную трубочку и запрессуйте туда кашицу. Подожгите один конец сосуда, и вы увидите, как из другого начнёт выползать чёрная «змейка». Когда она остынет, то окрасится в зелёный цвет. При этом сахароза сгорает до углерода, нитрат натрия разложится с образованием O2 и NaNO2, а хромпик образует трехокись.
Выращивание кристаллов
Если приготовить насыщенный раствор бихромата калия, можно вырастить фантастические кристаллы. Выглядят они весьма впечатляюще, а сделать такую красоту очень просто. Достаточно поставить стакан с горячим раствором в место, защищённое от света, вибрации и сквозняка. Внутрь ёмкости опустите верёвочку и закрепите её на краю. Нужно подождать несколько дней, и вы увидите, как на нитке образуются красно-оранжевые кристаллы.
Применение в промышленности
Дихромат калия нашёл применение сразу в нескольких отраслях промышленности. Его используют в производстве пигментов для лакокрасочных изделий, для дубления кожи, дезинфекции семян. Окислительные свойства позволяют применять хромпик для создания спичечных головок, борьбы с коррозией металлов, изготовления пиротехнических изделий и сухих электролитов.
Смесь реагента с концентрированной серной кислотой — идеальное средство для мытья химической посуды.
Дихромат калия
| Дихромат калия | |
|---|---|
 | |
| Систематическое наименование | Дихромат калия |
| Традиционные названия | Бихромат калия, двухромовокислый калий, хромпик |
| Хим. формула | K2Cr2O7 |
| Состояние | оранжевые кристаллы |
| Молярная масса | 294,19 г/моль |
| Плотность | 2,676 г/см³ |
| Т. плав. | 396 °C |
| Т. кип. | 500 °C |
| Т. разл. | 500 °C |
| Энтальпия образования | −2033 кДж/моль |
| Растворимость в воде | 4,9 г/100 мл |
| Координационная геометрия | Тетраэдральная |
| Кристаллическая структура | Триклинная |
| ГОСТ | ГОСТ 2652-78 |
| Рег. номер CAS | 7778-50-9 |
| PubChem | 24502 |
| Рег. номер EINECS | 231-906-6 |
| SMILES | |
| Рег. номер EC | 231-906-6 |
| RTECS | HX7680000 |
| ChEBI | 53444 |
| ChemSpider | 22910 |
| ЛД50 | 25 мг/кг (крысы, орально) |
| Токсичность | высокотоксичен, канцероген, мутаген, аллерген, сильный окислитель |
| Пиктограммы СГС |      |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дихромат калия (двухромовокислый калий, бихромат калия, техн. хромпик) — неорганическое соединение, калиевая соль дихромовой кислоты с химической формулой K2Cr2O7, имеет вид оранжевых кристаллов. Обладает сильными окислительными свойствами, в связи с чем широко применяется в химии, фотографии, пиротехнике и различных областях промышленности. Высокотоксичен и канцерогенен.
Иногда хромпиком также называют дихромат натрия (Na2Cr2O7).
Содержание
Физические и химические свойства
Оранжевые кристаллы с температурой плавления 396 °C. Разлагается при нагреве выше 500 °C. Растворим в воде (г / 100 г): 4,6 (0 °C), 15,1 (25 °C), 37,7 (50 °C), незначительно растворим в этаноле. Сильный окислитель.
В кислой среде восстанавливается до солей хрома (III). Например, он окисляет галогенид-ионы галогенводородных кислот до свободных галогенов:
Также в кислой среде при pH 3,0—3,5 обладает способностью окислять металлическое серебро:
6Ag + Cr2O7 2− + 14H + ⟶ 6Ag + + 2Cr 3 + + 7H2O
Кристаллический дихромат калия при нагревании с серой и углеродом восстанавливается до оксида хрома (III):
Водные растворы дихромата калия обладают дубящими свойствами, в частности, задубливают желатину.
Получение
Получают действием хлорида калия на дихромат натрия:
2KCl + Na2Cr2O7 ⟶ K2Cr2O7 + 2NaCl
Применение
Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте (т. н. хромовую смесь) применяют для мытья стеклянной посуды в лабораториях. В лабораторной практике используется в качестве окислителя, в том числе в аналитической химии (хроматометрия).
В чёрно-белой фотографии применяется в качестве отбеливателя для удаления металлического серебра из эмульсии. Не применяется в цветной фотографии, так как для отбеливания требует кислой среды, а при pH ⩽ 4 красители, образовавшиеся в эмульсии при цветном проявлении, обесцвечиваются. Вместо этого в цветной фотографии для отбеливания используются составы на основе гексацианоферрата III калия и железной соли трилона Б.
Безопасность
Высокотоксичен, канцерогенен, аллерген, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. Среди соединений шестивалентного хрома наиболее токсичен. ПДК составляет 0,01 мг/м³ (в пересчёте на CrO3). При работе с дихроматом калия необходимо применять защиту органов дыхания и кожи.
Дихромат калия – название неорганического соединения, представляющего собой калиевую соль дихромовой кислоты. Давайте поговорим о данном веществе и узнаем много интересного.
Характеристика, формула и физические свойства
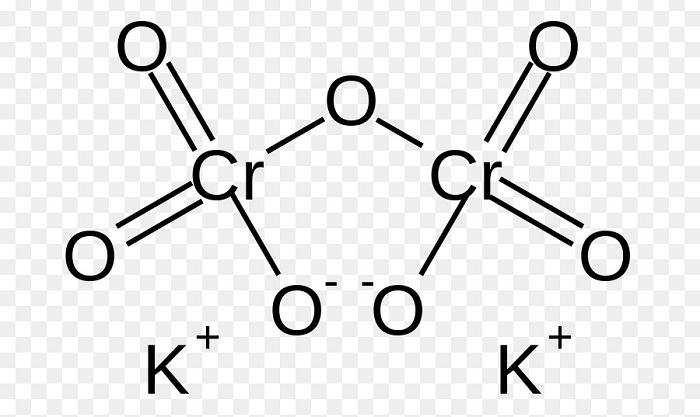
Структурная формула дихромата калия
Одной из особенностей дихромата калия является его ярко-оранжевый цвет и кристаллообразная структура.
Температура плавления соединения равна 396 0 C, а температура кипения и разложения — 500 0 C.
Ярко выражены окислительные свойства дихромата калия, по этой причине вещество широко применяется в фотографии, химии и промышленности.
Является канцерогеном, аллергеном, сильнейшим окислителем и токсичным веществом.
Химические свойства
Имеет высокую растворимость в воде (4,9 г/100 мл) и небольшую при взаимодействии с этиловым спиртом. В кислой среде происходит восстановление до солей хрома (III).
В качестве примера можно привести то, что он может окислять галогенид-ионы до свободных галогенов:
Если среда имеет pH от 3 до 3.5, двухромовокислый калий реагирует на металлическое серебро – окисляет его:
6Ag + Cr2O7 2- + 14H + => 6Ag + + 2Cr 3- + 7H2O.
При нагревании кристаллического бихромата калия с углеродом С и серой S происходит восстановление вещества до оксида хрома:
При электролитической диссоциации дихромат калия распадается на ионы калия и дихромат-ион:
Получение дихромата калия
В основе получения соединения лежит следующая химическая реакция:
Токсичность
Вещество относится к первому классу опасности. Это значит, что оно наиболее токсично и может нанести большой вред организму, поэтому при работе с ним требуется соблюдать меры безопасности.
Раствор бихромата калия повреждает органы дыхания и кожные покровы, нарушает хрящевую ткань и вызывает сильнейшие отравления при попадании в организм. Работая с данным соединением необходимо защищать кожу и дыхательные пути.
Применение калия двухромовокислого
Имеет широкий спектр применения, например:
для дубления, так как раствор двухромовокислого калия с водой имеет все свойства для этого;
применяется для мытья лабораторной посуды;
при обработке черно-белых фотографий бихромат калия используется в качестве отбеливающего реагента;
так как окислительные свойства соединения крайне высоки, то оно выступает окислителем при обработке фотографий и занятиях живописью, а также в спичечной промышленности и пиротехнике.
Бихромат калия
Бихромат калия
| Дихромат калия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Дихромат калия (VI) |
| Традиционные названия | Двухромовокислый калий, калиевый хромпик |
| Химическая формула | K2Cr2O7 |
| Молярная масса | 294.19 г/моль |
| Физические свойства | |
| Плотность вещества | 2.676 г/см³ |
| Термические свойства | |
| Температура плавления | 398 °C |
| Температура кипения | 500 °C |
| Энтальпия (ст. усл.) | -2033 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 4.9 г/100 мл |
| Структура | |
| Координационная геометрия | Тетраэдральная |
| Кристаллическая структура | Триклинная |
| Классификация | |
| номер CAS | 7778-50-9 |
| Номер UN | 3288 |
| Регистрационный номер EC | 231-906-6 |
| RTECS | HX7680000 |
Дихрома́т ка́лия (двухромовокислый калий, ка́лиевый хро́мпик) — K2Cr2O7.
Хорошо растворим в воде. Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте — хромовую смесь, применяют для мытья стеклянной посуды в лабораториях.
Высокотоксичен, канцерогенен, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. ПДК 0,01мг/м³ (В пересчете на CrO3). При работе с хромпиком необходимо применять защиту органов дыхания и кожи.
Полезное
Смотреть что такое «Бихромат калия» в других словарях:
бихромат калия — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN potassium dichromate … Справочник технического переводчика
бихромат калия — двухромовокислый калий, хромпик … Cловарь химических синонимов I
Бихромат серебра — Общие Систематическое наименование Бихромат серебра Традиционные названия Хромовокислое серебро Химическая формула Ag2Cr2O7 Физические свойства … Википедия
Калия бихромат — калия дихромат, двухромовокислый калий, K2Cr2O7, см. Дихроматы … Большая советская энциклопедия
Калия дихромат — калия бихромат, двухромовокислый калий, K2Cr2O7, см. Дихроматы … Большая советская энциклопедия
Бихромат аммония — Эту страницу предлагается переименовать в Дихромат аммония. Пояснение причин и обсуждение на странице Википедия:К переименованию/25 декабря 2012. Возможно, её текущее название не соответствует нормам современного русского языка и/или… … Википедия
Калия бихромат — Дихромат калия Общие Систематическое наименование Дихромат калия (VI) Традиционные названия Двухромовокислый калий, калиевый хромпик Химическая формула K2Cr2O … Википедия
Калия дихромат — Дихромат калия Общие Систематическое наименование Дихромат калия (VI) Традиционные названия Двухромовокислый калий, калиевый хромпик Химическая формула K2Cr2O … Википедия
Бихромат — Хроматы соли хромовой кислоты H2CrO4. Содержание 1 Получение 2 Химические свойства 3 Применение 4 … Википедия
Хромат калия — Хромат калия … Википедия
Дихромат калия для чего
Исследовательские работы и проекты
Проект по химии «Бихромат калия»
В процессе исследовательской работы по химии на тему «Бихромат калия» автором была поставлена цель изучить бихромат калия, его значение для различных промышленных отраслей и возможности безопасного использования данного вещества для человека. Учащийся в своем проекте о бахромате калия изучает характеристику вещества, его химические свойства, процесс получения и очистки, а также окислительные свойства бахромата калия.
Подробнее о работе:
В исследовательском проекте по химии «Бихромат калия» учащийся школы выдвигает гипотезу, которая заключается в том, что применение бихромата калия во многих процессах не заменимо и не имеет равносильных альтернатив. Святослав считает, что несмотря на немалую опасность для человека и природы – отказаться от применения данного вещества нельзя, так как его значение для различных промышленных отраслей очень большое.
В практической части индивидуального проекта по химии школьник проводит цветные опыты с бахроматом калия, такие как «Извержение вулкана» и «Фараонова змея», а также осуществляет выращивание кристаллов.
Оглавление
Введение
1. Теоретическая часть
1.1. Характеристика вещества
1.2. Химические свойства
1.3. Получение и очистка
1.4. Окислительные свойства
1.5. Применение в промышленности
1.6. Токсичность
1.7. Требования безопасности дихромата калия (калия бихромата, двухромовокислого калия, калиевого хромпика)
1.8. Упаковка, транспортировка и хранение
Глава 2. Практическая часть
2.1. Деревообрабатывающая промышленность
2.2. Цветные опыты
2.2.1. Опыт «Извержение вулкана»
2.2.2. «Фараонова змея»
2.2.3. Выращивание кристаллов
2.3 Отравление бихроматом и его лечение
Заключение
Литература
Введение
Ранее для производства бихромата калия использовали процесс, аналогичный существующему процессу производства бихромата натрия прокаливали известково-поташную шихту и выщелачиванием спека получали раствор хромата калия, который серной кислотой переходили в бихромат. Дороговизна поташа послужили причиной вытеснения бихромата калия дешевым бихроматом натрия. В настоящее время его применяют, главным образом, там, где бихромат натрия неприменим из-за гигроскопичности и наличия кристаллизационной воды. Поэтому изучение данной темы актуально.
Проблема исследовательской работы заключается в том, что несмотря на немалую опасность для человека и природы – отказаться от применения данного вещества нельзя, так как его значение для различных промышленных отраслей очень большое. Во многих процессах оно просто незаменимо и не имеет равносильных альтернатив.
Цель исследовательской работы изучить бихромат калия, его значение для различных промышленных отраслей и возможности безопасного использования данного вещества для человека.
– значение бихромата калия для различных промышленных отраслей и возможность безопасного использования данного вещества для человека.
Гипотеза исследовательской работы заключается в том, что применение бихромата калия во многих процессах не заменимо и не имеет равносильных альтернатив.
изучение литературы и других источников информации, наблюдение, анализ текста.
1.1 Характеристика дихромата калия
Структурная формула дихромата калия
Температура плавления соединения равна 3960C, а температура кипения и разложения — 5000C. Ярко выражены окислительные свойства дихромата калия, по этой причине вещество широко применяется в фотографии, химии и промышленности. Является канцерогеном, аллергеном, сильнейшим окислителем и токсичным веществом.
1.2 Химические свойства дихромата калия
Имеет высокую растворимость в воде (4,9 г/100 мл) и небольшую при взаимодействии с этиловым спиртом. В кислой среде происходит восстановление до солей хрома (III). В качестве примера можно привести то, что он может окислять галогенид-ионы до свободных галогенов:
Если среда имеет pH от 3 до 3.5, двухромовокислый калий реагирует на металлическое серебро – окисляет его:
6Ag + Cr2O72- + 14H+ => 6Ag+ + 2Cr3- + 7H2O
При нагревании кристаллического бихромата калия с углеродом С и серой S происходит восстановление вещества до оксида хрома:
2K2Cr2O7 + 3C => 2Cr2O3 + 2K2CO3 + CO2; K2Cr2O7 + S => Cr2O3 + K2SO4
При электролитической диссоциации дихромат калия распадается на ионы калия и дихромат-ион:
K2Cr2O7 => 2K+ + Cr2O72
1.3 Получение и очистка дихромата калия
Для получения K2Cr2O7 используется раствор натриевого хромпика и хлорида калия. Их смешивают и подвергают сильному нагреванию до температуры 1200 ⁰C. В таких условиях протекает реакция обмена: 2KCl+Na2CR2O7 → K2Cr2O7+2NaCl
Для очистки кристаллов в лабораторных условиях используют метод перекристаллизации. Готовят раствор, разводя 100 граммов дихромата калия в 1 литре горячей воды. Его тщательно перемешивают, фильтруют и подвергают упариванию так, чтобы от первоначального объёма осталось около 1/7. Остаток охлаждают при постоянном перемешивании. Таким путем образуются мелкие кристаллы, которые следует отфильтровать под тягой при помощи воронки Бюхнера. В процессе нужно провести три промывания очень холодной водой.
Трёхкратная перекристаллизация позволит получить образец с содержанием реагента дихромат калия от 99,92 до 100 %. Чтобы добиться такой чистоты готовят раствор из 100 граммов препарата и 150 мл кипятка. Его хорошо перемешивают и выливают тонкой струйкой в эксикатор или фарфоровую чашку. По мере охлаждения образуются кристаллы, которые фильтруют на пористой стеклянной воронке или платиновом конусе. Проводится сушка при 100 ⁰C в течение 2—2,5 часов. Полученное твердое образование дробят и продолжают прогревать при 200 ⁰C ещё в течение 12 часов. Такую последовательность действий повторяют 3 раза.
1.4 Окислительные свойства бихромата калия
В щелочной среде происходит восстановление реагента до оксидов. Растворите 3 грамма кристаллов в 50 мл дистиллированной воды. Долейте немного K2CO3. Произойдёт реакция с выделением CO2, раствор окрасится в жёлтый оттенок – образовался K2CrO4. При добавлении кислоты вновь образуется бихромат красно-оранжевого цвета.
Реагент способен восстанавливать галогены из соединений. Прокипятите 5 мл K2Cr2O7 и 3 мл соляной кислоты. В результате реакции выделится газообразный свободный хлор. Хромпик превратится в зелёную трехокись. Опыт проводится только под сильной тягой!
Хромовокислые соли свинца и серебра нерастворимы. Если к K2Cr2O7 добавить AgNO3, произойдёт реакция обмена с выпадением красно-коричневого осадка Ag2CrO4. Тот же механизм восстановления происходит при реакции с нитратом свинца, который даёт жёлтый нерастворимый остаток.
Сами кристаллы хромпика также обладают окислительными свойствами. Если их нагреть с серой, то реагент восстановит её до сульфида калия и трехокиси. Проведя ту же манипуляцию с углеродом, получите K2CO3, CO2 и оксид хрома (III).
1.5 Применение в промышленности бихромата калия
Бихромат калия – это соединение, имеющее огромное значение для различных отраслей. С его участием изготавливают неорганические пигменты, красители, сухие батареи (электролиты). Его задействуют в дублении кожи и овчины (в кожевенном производстве выступает дубителем).
Он является эффективным окислителем в значительном перечне направлений: пиротехническом производстве, спичечной промышленности, фотоделе, живописи и др. Не обходятся без него и органический синтез, и металлообработка. Он отлично ингибирует коррозионные проявления металлов и металлических сплавов. Может выступать протравой для посадочного материала, используемого в сельском хозяйстве.
Раствор двухромовокислого калия в концентрированной сульфатной кислоте, именуемый хромовой смесью, повсеместно используют в лабораториях. Прежде всего, с его помощью моют лабораторную посуду, выполненную из стекла: колбы, стаканы, пробирки и т.д. Также его задействуют в качестве окисляющего материала. Особую потребность в этом реагенте ощущает аналитическая химия (хроматометрия).
Находят применение и водные растворы хромпика. Ими пропитывают изделия из дерева, которые подвергаются влиянию влаги и вредных насекомых. Так удается обеспечить надежную защиту конструкций, в частности балок, от гниения и повреждения вредителями.
1.6 Токсичность бихромата калия
Раствор бихромата калия повреждает органы дыхания и кожные покровы, нарушает хрящевую ткань и вызывает сильнейшие отравления при попадании в организм. Работая с данным соединением необходимо защищать кожу и дыхательные пути.
1.7 Требования безопасности дихромата калия
1.8. Упаковка, транспортировка и хранение бихромата калия
Калия бихромат технический упаковывают в стальные барабаны, полиэтиленовые мешки-вкладыши, вложенные в четырех-пятислойные бумажные мешки или льно-джуто-кенафные мешки массой не более 50 кг. Допускается упаковывать калия бихромат технический в мягкие специализированные контейнеры разового использования массой не более 1000 кг.
Калия бихромат технический транспортируют всеми видами транспорта (кроме воздушного) в крытых транспортных средствах в соответствии с правилами перевозок, действующими на каждом виде транспорта. Продукт, упакованный в мягкие специализированные контейнеры разового использования, транспортируют открытым подвижным составом в прямом железнодорожном сообщении. Железнодорожным транспортом дихромат калия перевозят повагонно.
Калия дихромат хранят в закрытых складских помещениях в упаковке изготовителя.
Продукт, упакованный в мягкие специализированные контейнеры разового использования, хранят на незагрязненных открытых площадках, имеющих твердое покрытие со стоком вод и обеспечивающих работу грузовых механизмов.
Срок хранения дихромата калия не ограничен.
2.1 Бихромат калия в деревообрабатывающей промышленности
А вот после нанесения и высыхания раствора это вещество становится абсолютно безопасным. Дерево после такой обработки приобретает зеленоватый цвет, что происходит в результате химической реакции бихромата с древесиной. Образующаяся окись хрома надежно защищает не только от гниения, но и от поражения дерева личинками насекомых.
Некоторое время назад у нас продавалось средство «Сенеж», в состав которого входит бихромат калия. Надо сказать, что в США и Канаде этот рецепт используется давно — в магазинах продается уже обработанное бихроматом «зеленое дерево».
2.2 Цветные опыты с бихроматом калия
2.2.1 Опыт «Извержение вулкана»
Одним из наиболее впечатляющих химических опытов является «извержение вулкана». Его демонстрация потребует специального оборудования, нацеленного на защиту органов дыхания. Для эксперимента придётся прикрыть кожные покровы и надеть респиратор, ведь продуктом реакции станет ядовитая трехокись хрома, которая вредна для человека.
На несгораемую подложку, в качестве которой можно использовать асбестовое полотно, кафель или кристаллизатор, помещается небольшая кучка двухромовокислого калия (альтернативный реагент (NH4)2Cr2O7). В центре сделайте углубление, капните спирт и подожгите его. По мере горения происходит разложение хромпика с образованием кислорода. Газ включается в реакцию и обеспечивает эффект синего пламени. На лабораторном столе бушует настоящий вулкан! Остальными продуктами горения станут K2CrO4, трехокись хрома (III). Эти вещества очень токсичны, при попадании на кожу вызывают ожоги и изъязвления.
2.2.2 Опыт «Фараонова змея»
Не менее интересен опыт под названием «фараоновы змеи» с использованием реактива дихромат калия. Реакции с его участием выглядят впечатляюще: растворы меняют цвет, кристаллы разлагаются с образованием окрашенного в зелёный оттенок оксида Cr2O3. Чтобы получить «змею», разотрите в ступке смесь из равных частей хромпика и сахара, добавьте половину порции нитрата натрия.
Все компоненты увлажните и подмешайте немного коллодия. Возьмите стеклянную трубочку и запрессуйте туда кашицу. Подожгите один конец сосуда, и вы увидите, как из другого начнёт выползать чёрная «змейка». Когда она остынет, то окрасится в зелёный цвет. При этом сахароза сгорает до углерода, нитрат натрия разложится с образованием O2 и NaNO2, а хромпик образует трехокись.
2.2.3 Выращивание кристаллов из бихромата калия
Если приготовить насыщенный раствор бихромата калия, можно вырастить фантастические кристаллы. Выглядят они весьма впечатляюще, а сделать такую красоту очень просто.
Достаточно поставить стакан с горячим раствором в место, защищённое от света, вибрации и сквозняка. Внутрь ёмкости опустите верёвочку и закрепите её на краю. Нужно подождать несколько дней, и вы увидите, как на нитке образуются красно-оранжевые кристаллы.
2.3 Отравление бихроматом и его лечение
Шестивалентный хром в бихромате неспецифически связывается с белками и нуклеопротеинами и специфически поглощается эритроцитами и тромбоцитами. Он восстанавливается до трехвалентного хрома, но соединение, возможно, в совокупности с образующимся в качестве промежуточного продукта пятивалентным хромом вызывает тяжелое свободнорадикальное поражение митохондрий, особенно в почечных канальцах и гепатоцитах.
Заключение
Дихромат калия – это оранжево-красное, кристаллическое неорганическое соединение, которое выделяет токсичные пары хрома при нагревании. Дихромат калия является сильным окислителем. Это вещество используется в древесных консервантах, при производстве пигментов и в фотомеханических процессах, но в основном заменяется дихроматом натрия. Дихромат калия в первую очередь поражает дыхательные пути, вызывая одышку, бронхит, пневмонию и астму, но также может влиять на желудочно-кишечный тракт, печень, почки и иммунную систему. Это вещество является известным канцерогеном человека и связано с повышенным риском развития рака легких.
Внешне это оранжево-красные кристаллы. Никакого отличительного запаха. Может сильно раздражать глаза и дыхательные пути. Надо избегать контакта с органическими материалами. Негорючий. Используется в пиротехнических дисплеях с вольфрамом и железом.
Бихромат калия (K2Cr2O7) представляет собой неорганический химический реагент, который обычно используется в качестве окислителя в промышленных и лабораторных условиях. Он используется для окисления спиртов и превращения первичных спиртов в альдегиды, а иногда и из карбоновых кислот.
Вторичные спирты превращаются в кетоны, и дальнейшее окисление не требуется. Бихромат калия не окисляет третичные спирты. Химическое вещество потенциально опасно для здоровья человека и представляет собой кристаллическое ионное твердое вещество, которое имеет яркий красно-оранжевый цвет.
Использование бихромата калия:
Когда химическое вещество используется в водном растворе, цвет, который он изменяет, определяет наличие кетона или альдегида. Когда альдегиды находятся в смеси, цвет изменяется с оранжевого на зеленый.
Бихромат калия также используется в чистящих растворах. Как и другие соединения, изготовленные из хрома VI (дихромат натрия и триоксид хрома), его можно использовать для приготовления хромовой кислоты, которая используется для очистки посуды. Химическое вещество также используется в цементе для улучшения его текстуры и плотности, а также для замедления схватывания бетонной смеси.
Бихромат калия можно использовать для определения концентрации этанола. Для достижения титрования используется кислый дихромат калия. Когда это делается, весь этанол окисляется до уксусной кислоты, а избыток дихромата определяется титрованием тиосульфата натрия. Чтобы определить количество этанола, присутствующего в веществе, избыточный дихромат вычитают из исходного количества этанола, присутствующего в веществе. Этот аспект вещества используется в тестах на дыхание в полиции, поскольку он изменяется с желтого цвета на зеленый при присутствии алкоголя. Чем выше уровень алкоголя в дыхании человека, тем больше будет изменение цвета.
Бихромат калия также используется при работе с серебром. Когда вещество растворяется в растворе азотной кислоты (также называемом раствором Швертера), его можно использовать для определения чистоты серебра. Если металл или вещество чистые, раствор станет ярко-красным. Если это серебро, цвет изменится на темно-красный, и большинство серебряных монет превратят жидкость в коричневый цвет. Если тестируемое вещество составляет 50% серебра, цвет изменится на зеленый. Когда данное вещество используется для обработки дерева, дихромат калия меняет цвет и древесину и даже оказывает такое влияние на красное дерево.