дихромат аммония что это
Бихромат аммония
Не снимайте пометку о выставлении на переименование до окончания обсуждения.
Дата постановки — 25 декабря 2012.
| Бихромат аммония | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Дихромат аммония |
| Традиционные названия | Аммоний двухромовокислый |
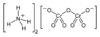
| Химическая формула | (NH4)2Cr2O7 |
| Физические свойства | |
| Молярная масса | 252,07 г/моль |
| Плотность | 2,115 г/см³ |
| Термические свойства | |
| Молярная теплоёмкость (ст. усл.) | 293 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -1810 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 20 ; 115 100 ; |
| Классификация | |
| Рег. номер CAS | 7789-09-5 |
| SMILES | [O-][Cr](=O)(=O)O[Cr]([O-])(=O)=O.[NH4+].[NH4+] |
| RTECS | HX7650000 |
| Безопасность | |
| Токсичность | Токсичен. Летальная доза 2 грамма |
Бихромат аммония (дихромат) — кристаллическое вещество оранжево-красного цвета, хорошо растворимое в воде.
Содержание
Получение
Бихромат аммония получают взаимодействием оксида хрома(VI) с разбавленным раствором аммиака:
Физические свойства
Оранжево-красные кристаллы принадлежат к моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,327 нм, b = 0,754 нм, c = 0,778 нм, β = 93,70°, Z = 4.
Плотность 2,15 г/см³. Растворяется в воде и этаноле, не растворяется в ацетоне.
Химические свойства
Применение
Применяются в металлообрабатывающей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности.
Токсичность
Ссылки
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Бихромат аммония» в других словарях:
бихромат аммония — двухромовокислый аммоний … Cловарь химических синонимов I
Бихромат серебра — Общие Систематическое наименование Бихромат серебра Традиционные названия Хромовокислое серебро Химическая формула Ag2Cr2O7 Физические свойства … Википедия
Дихромат аммония — Дихромат аммония … Википедия
Хромат аммония — Общие Систематическое наименование Хромат аммония Традиционные названия Хромовокислый аммоний Химическая формула (NH4)2CrO4 Физические свойства Состояние … Википедия
двухромовокислый аммоний — бихромат аммония … Cловарь химических синонимов I
Ammonium dichromate — Бихромат аммония, (NH4)2Cr2O7 … Краткий толковый словарь по полиграфии
Хром — (Chrom, Chrome, Chromium; при О = 16 атомн. вес Cr = 52,1) принадлежит к числу элементарных веществ металлического характера. Однако, занимая по своему атомному весу шестое место в том большом периоде естественной системы элементов, который… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Фтористый хромил — Общие Систематическое наименование Фтористый хромил Традиционные названия Диоксид дифторид хрома Химическая формула CrO2F2 Физические свойства … Википедия
Дихромат рубидия — Общие Систематическое наименование Дихромат рубидия Традиционные названия Бихромат рубидия; двухромовокислый рубидий Химическая формула Rb2Cr2O7 Физические свойства … Википедия
Хромат калия — Хромат калия … Википедия
Дихромат аммония
| Дихромат аммония | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Дихромат аммония |
| Традиционные названия | Аммоний двухромовокислый |
| Химическая формула | (NH4)2Cr2O7 |
| Физические свойства | |
| Молярная масса | 252,07 г/моль |
| Плотность | 2,115 г/см³ |
| Термические свойства | |
| Молярная теплоёмкость (ст. усл.) | 293 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -1810 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 20 ; 115 100 ; |
| Классификация | |
| Рег. номер CAS | 7789-09-5 |
| SMILES | [O-][Cr](=O)(=O)O[Cr]([O-])(=O)=O.[NH4+].[NH4+] |
| RTECS | HX7650000 |
| Безопасность | |
| Токсичность | Токсичен. Летальная доза 2 грамма |
Дихромат аммония— кристаллическое вещество оранжево-красного цвета, хорошо растворимое в воде.
Содержание
Получение
Дихромат аммония получают взаимодействием оксида хрома(VI) с разбавленным раствором аммиака:
Физические свойства
Оранжево-красные кристаллы принадлежат к моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,327 нм, b = 0,754 нм, c = 0,778 нм, β = 93,70°, Z = 4.
Плотность 2,15 г/см³. Растворяется в воде и этаноле, не растворяется в ацетоне.
Химические свойства
Применение
Применяются в металлообрабатывающей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности.
Токсичность
Ссылки
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Дихромат аммония» в других словарях:
Дихромат натрия — Дихромат натрия … Википедия
Дихромат лития — Общие Систематическое наименование Дихромат лития Традиционные названия Бихромат лития; хромовокислый литий Химическая формула Li2Cr2O7 Физические свойства … Википедия
Дихромат рубидия — Общие Систематическое наименование Дихромат рубидия Традиционные названия Бихромат рубидия; двухромовокислый рубидий Химическая формула Rb2Cr2O7 Физические свойства … Википедия
Дихромат калия — У этого термина существуют и другие значения, см. хромпик. Дихромат калия … Википедия
аммония дихромат — amonio dichromatas statusas T sritis chemija formulė (NH₄)₂Cr₂O₇ atitikmenys: angl. ammonium dichromate rus. аммония дихромат ryšiai: sinonimas – diamonio heptaoksodichromatas … Chemijos terminų aiškinamasis žodynas
Бихромат аммония — Эту страницу предлагается переименовать в Дихромат аммония. Пояснение причин и обсуждение на странице Википедия:К переименованию/25 декабря 2012. Возможно, её текущее название не соответствует нормам современного русского языка и/или… … Википедия
Хромат аммония — Общие Систематическое наименование Хромат аммония Традиционные названия Хромовокислый аммоний Химическая формула (NH4)2CrO4 Физические свойства Состояние … Википедия
Список неорганических соединений по элементам — Основная статья: Неорганические соединения Список неорганических соединений по элементам информационный список неорганических соединений, представленный в алфавитном порядке (по формуле) для каждого вещества, водородные кислоты элементов (при их… … Википедия
Хромат таллия(I) — Общие Систематическое наименование Хромат таллия(I) Традиционные названия Хромовокислый таллий Химическая формула Tl2CrO4 Физические свойства Состояние ( … Википедия
Страх и ненависть в бихромате аммония. Немного ламповой хемофобии
Такое мракобесие как хемофобия широко пустило корни в неокрепшие умы людей. На Пикабу частенько возникают посты написанные носителями данного недуга. Хотелось бы подробно препарировать один из них, дабы выделить основные его систематические признаки. Итак поциент: Все лучшее детям
Пост представляет собой истерический выкрик на тему «детей травят!», объектом проявления хемофобии выступает детский набор для проведения опыта по сжиганию бихромата аммония.
Детям от 3 лет в присутствии взрослых предлагается провести эксперимент «вулкан Бёттгера», который запрещен в школах многих стран!
Сходу наблюдаем явный признак псевдонаучного мышления – а именно ссылку на абстрактный авторитет. Важно помнить – для науки не существует авторитетов, в науке роль играют только факты, оценочные суждения немедленно вызывают ряд вопросов «кто запретил?», «когда?», «по какой причине?». Тезис про запрет тем более абсурден учитывая что опыты в школе, как не трудно догадаться, являются наглядным материалом в рамках некого курса, поэтому составители программ могут рекомендовать учителю провести тот или иной лабораторный практикум, запрещать учителю проводить конкретный опыт это примерно то же что запретить смотреть на восходящую луну через заднее плечо.
Так уж вышло, что безопасных веществ не существует. От слова совсем. Даже самое полезное для здоровья яблоко, оказавшись в дыхательных путях, приводит к смерти от асфиксии. Яблоко будет раздражать слизистые от контакта. То же яблоко будь оно съедено в количество 20кг за раз приведет к смерти от разрыва желудка, яблоко может привести к повреждению костей если движется на скорости 100м/c и кроме того любое яблоко радиотоксично так как содержит природный калий-40. Если длительное время есть много яблок то это приведет к проблемам с ЖКТ, кроме того все употреблявшие яблоки люди старше 150 лет мертвы. Вы все еще хотите покупать своему ребенку яблоки?
На данном этапе читатель уже приведен в нужную кондицию и поэтому автор даже не утруждается ссылками на авторитеты. И так схвают.
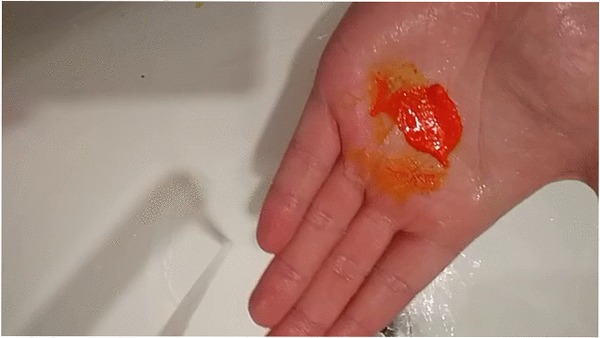
Но давайте подумаем как вообще происходит отстирывайте? В первейшем приближении это замачивание ткани в воде, которую меняют несколько раз, растворимые вещества растворяются и уходят в раствор, а нерастворимые удаляются механически, либо взаимодействуют со стиральным порошком, переходя в растворимую форму. Быть может это вещество совершенно нерастворимо? Однако первый же справочник сообщает нам, что растворимость бихромата составляет 356г в литре воды [1], то есть смыть его не труднее чес смыть поваренную соль.
Тезис про мгновенное всасывание бихромата кожей при попытке его смыть невозможно опровергнуть литературной ссылкой ибо нет исследований которые бы ставили в качестве своей цели такую дичь. Так что потехи ради поставлю эксперимент на себе. Бихромат интенсивно окрашен даже в малой концентрации так что в случае его всасывания он оставит яркие оранжевые пятна на коже.
Как видно все смылось без следа, я выложил этот пост, а значит все еще жив и у меня не вырос хвост.
Кстати, разлетающийся повсюду пепел оксида хрома, получающийся в процессе эксперимента, тоже небезопасен и вызывает дерматиты
Очередной бездоказательный тезис, содранный из статьи в Википедии. Тезис весьма странный, но что думает о токсичности оксида хрома гигиенический норматив для содержания веществ в воздухе рабочей зоны [2]? Согласно этому документу ПДК оксида хрома (3) составляет 1мг/м3, много это или мало? В той же таблице найдем диоксид кремния – в простонародии песок, для него ПДК составляет, внезапно все тот же 1мг/м3, то есть грубо говоря по опасности окись хрома равна песку из детской песочницы, он же один из главных компонентов бытовой пыли. Думаю, при длительном контакте с кожей, как и песок, окись хрома может вызвать дерматит, только как организовать этот длительный контакт? Натереться песком и не смывать его неделю? Но, тут уж явно не токсическая природа окиси проявляется.
Многие проводят этот эксперимент прямо у себя дома, предполагая, что открытая форточка или вытяжка на кухне сравнится по своим свойствам с лабораторным вытяжным шкафом!
Надеюсь, на данном этапе я в доставочной мере развенчал мифы, связанные с опасностью бихромата аммония, но для равновесия во Вселенной следует сказать и про реальные опасности. С реальной угрозой действия бихромата можно столкнуться на предприятиях где производят электрохимическое хромирование. Там применяют сернокислый электролит содержащий шестивалентный хром, в технологическом процессе неизбежно образование аэрозолей, которые могут попадать в организм работников, вызывая все те пресловутые последствия. Естественно чтобы говорить о риске нужно иметь ввиду регулярное воздействие на человека шестивалентного хрома в количестве долей грамма (а не те микрограммы, что разово могут попасть в организм при проведении опыта). Но даже при наличии такового воздействия проявление последствий процесс всегда вероятностный, поэтому очень странно писать «Вдыхание пыли приводит к онкологическим заболеваниям» Воздействие такой пыли может быть лишь одним из факторов риска, таким же как курение, наследственность или неблагоприятная экологическая обстановка.
Всем спасибо за внимание, развлекайте себя детей опытами, дружите с химией и не видитесь на бредни хемофобов.
[2] ГН 2.2.5.686-98 Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны
Меня так один знакомый с работы сплавом Розе пугал. Типа там висмут, высокотоксичный тяжёлый металл. Вот только висмут хоть и тяжёлый, но нетоксичен практически совсем, а в сплаве он безопаснее даже олова.
А ещё однажды в женской консультации ржала над двумя будущими мамашками, одна из которых пугала другую диоксидом титана. Мне даже медсестра замечание попыталась сделать.
Мракобесие было всегда, люди всегда боятся того, чего не понимают. А есть ещё те, кто убедительно несёт хуйню без пруфов и им верят. Взять тот же «бездрожжевой хлеб». Мол дрожжи это от лукавого и вообще их фашисты из трупов пленников вывели. Ебашим хлеб на закваске! А закваску кто квасит, сам Иисус чтоль? По факту там те же дрожжи, только неизвестно какого вида, в то время как пекарские дрожжи вида определённого.
Хотя ссделаю отступление, и скажу, что есть действительно говняный пластик, раз с каким-то татарским работали, люди в цеху чесаться начали, но тот совсем днищенский и предлагался лишь для нежилых помещений, как правило корпоративным клиентам для всяких складов. Чесаться. При варке углов. Даже ни сыпи, ничего такого, возможно массовая истерия или как её там, как было в одном посте про освежители, где товарищ поставил пустые картриджи, а жалобы не прекратились. Рабочие пожаловались, от пластика отказались. Я сам проработал на производстве несколько лет, самое неприятное это запах детской блевотины при варке углов и вонь свежей замазки стеклопакетов. Что-то много настрочил, простите, больная тема.
Хемофобия конечно не очень хорошая вещь. Но разоблачение всё же делать про что-то реально безопасное. Профанацией автора прям запахло, когда он стал писать про ПДК диоксида кремния, сравнивая действительно опасную пыль с песком в песочнице.
P.S. Писать про дихромат плохая идея, так как это всё же соединение переходного металла в высшей степени окисления, так еще и хромат анион воспринимается клеточными мембранами как сульфат, и может плавать там где хочет. И да, неплохо через кожу всасывается. Хоть сам постоянно руки в нём пачкал, зачем лишний раз рисковать и иммунитет нагружать раковыми клетками?
Paul H. ConnettKaren E. Wetterhahn Metabolism of the carcinogen chromate by cellular constituents // Inorganic Elements in Biochemistry pp 93-124
S. VENITT & L. S. LEVY Mutagenicity of chromates in bacteria and its relevance to chromate carcinogenesis // Nature volume 250, pages493–495(1974)
Roe, F. J. C., and Carter, R. L., Br. J. Cancer, 23, 172–176 (1969).
Gammelgaard X, Fullerton A, Avnstorp C, Menne T: Permeation of chromium salts through human skin in vitro. Contact Dermatitis 27:302-310, 1992.
Самое примечательное,что рука на видео не подаёт никаких признаков жизни:не гнется,не шевелит пальцами. Да и не видно что к ней с другой стороны человек прикреплён). Подозрительно!
Сам химик и понятное дело, что всё дело в дозе. Но всё таки ТС явно передёргивает на счёт яблока. Если на самом деле, как и писал первый автор, пусть и и истеричным тоном, бихромат аммония квалифицируется как онко-, муто- и иже с ними генный, то пренебрегать этими солями в доме я бы не стал. Ну и в этом опыте защитные очки, перчатки и вентиляция нужны, как и в других экспериментов с токсичными веществами.
Дураков учить- только дубину портить. (с)
Что скажете про такие утверждения:
Тоже страшилка? Или опять начнете сравнивать с ПДК в воздухе? Кстати, а кто сказал, что работа в условиях запыленности безвредна?
Напомню по диоксиду кремния, что вы сюда приплели:
У людей много страхов, обоснованных и не очень и бороться с ними бесполезно. С другой стороны, за историю человечества было множество вещей которые сначала считались безопасными, но потом оказывалось что это далеко не так, бывало и наоборот. С этой точки зрения ребенка лучше вообще не подпускать ни к чему что вы не пробовали на себе, да и то с рядом исключений. А в интернетах можно постить совершенно любую хуйню, никто не заморачивается поиском нормальных пруфов, а вот поверить могут многие.
Чет ору! Читать в посте опровержение про какое-то вещество и тут же писать про:
То же яблоко будь оно съедено в количество 20кг за раз приведет к смерти от разрыва желудка
ТС, я в замешательстве. С одной стороны есть такая ссыль http://www.inchem.org/documents/icsc/icsc/eics1368.htm вполне убедительно подтверждающая все заявленные ужасы этого соединения, а с другой стороны вроде как насыпали себе на руку и спокойно смыли, ничего через кожу не всосалось. Может и про опасность фтороводорода врут?
я выложил этот пост, а значит все еще жив
Вместо вот этой демагогии уровня раковых пабликов ВК достаточно было написать о том, что при соблюдении техники безопасности ничего ужасного не случится, но ведь тогда и плюсиков не поставят, да?
После слова «поциент» не стал читать дальше. Наверное познавательное что то.
Вся пиписька синяя!
С ним, насколько я помню, пробирки хорошо мыть было 🙂
Хумук, ты мне в комменты насрал ради лулзов? Их не будет, ты смыт игнор-лист
Подобная истерия была и с аттракционом «лизун», однако при его создании используется тетраборат натрия. Ну и бритвенная пена для чего-то там. Были признаки раздражения у детей при замешивании большого количества этой лабуты, и отзывв родителей. На этой волне серый, быстрый пиар решил срубить лайков и пошел, но видимо недошел до исконных «разрушителей мифов». Спокойствия, Бро! Пасиб за телегу, поугарал)))
Бихромат аммония прикольное соединение. В далёкие 90е, во времена тотального дефицита всего и вся, я разлагал его именно экзотермически и смешивая получившийся оксид хрома с парафином делал пасту ГОИ для полировки и доводки режущего инструмента, т.к. самой пасты тогда было не достать в наших краях. А бихромата пакет чудом нарылся в школьной лабе.
До сих пор теми запасами пользуюсь.
И вообще! Кроме бихромата, надо запретить переоксид водорода!
это всё ваши ГМО виноваты
БИХРОМАТЫ- входят в группу канцерогенов 1 IARC (международного агентство по изучению рака)
Они не игрушка, особенно для детей, если же проводить хим. опыты на дому, возможно загрязнение помещения, и следовательно длительное воздействие реагента на организм.Что возможно повлечёт за собой последствия, особенно у незнающий людей. Зачем лишний раз рисковать, опыт можно посмотреть в интернете. Ещё остаётся вероятность попадания бихромата оральным путём, что может повлечь за собой ожоги слизистой и отравления. В итоге опыт следует проводить только знающим людям, понимающих все возможные последствия неправильного обращения с реактивом, вне жилого помещения, приняв все методы предосторожности. Я за проведения наглядных хим. опытов, они могут заставить человека заинтересоваться химией, но абсолютно против пренебрежительного отношения к техники безопасности.
Блин столько слов, я все ждал когда он вулкан сделает из этой соли(
Не вкуриваю, почему сравнивается порошкообразное вещество с яблоком? Лучше уж с солью например.
Я конечно не паникер и не хемофоб. Но я вот не понял, как можно сравнивать реально ядовитое и токсичное хим. вещество с яблоками? Яблоки убивают при вдыхании? Яблоки разедают глаза при попадании? Сравнение не очень, да и сам пост как-то не особо рассказывает об этом веществе. Минусуйте кто хочет.
Коротко о содержании: «голактеко опасносте, детишкам в качестве игрушки дают опасный реагент!»
Коротко о содержании: «Ох уж эти хемофобы, для вас тогда и яблоки опасны, ибо ими подавиться можно»
Сосбтна, именно к последнему и претензии, которые я кратко уже высказывал в комментариях. Начнем, пожалуй со ссылок на НД (нормативную документацию) по ПДК (предельно допустимым концентрациям) опасных веществ. Автор в своих рассуждениях в качестве пруфа приводит «ГН 2.2.5.686-98 Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны». Итак, что же такое предельно допустимая концентрация? Обращаясь к приведенному же самим автором документу это:
Ыть. А норматив-то относится только к производственным зданиям, в которых человек работает не более 8 часов в день, а действию веществ имеющих ПДК вообще подвергается несколько минут, а никак не жилым домам. В чем отличия производственного помещения от жилого, помимо того, что в последних вы находитесь существенно больше? Да всего лишь в том, что в производственном помещении:
1. Не принимают пищу.
2. Нет детей и животных.
3. Нет ковров, мебели и прочих элементов интерьера, засераемых всем, что летает в воздухе
4. Рабочие места, где осуществляются химические реакции обустроены всем необходимым, например, приточно-вытяжной вентиляцией
Все это никак не учитывается в представленном документе. Что сие значит? А то, что все цифры в посте-опровержении, взятые оттуда, абсолютно не актуальны в ситуации, когда ты с детьми проводишь эксперимент дома.
Если Мамырбаев для автора не авторитет, то вот, что нам говорит ГОСТ 2652-78 «КАЛИЯ БИХРОМАТ ТЕХНИЧЕСКИЙ»:
«Шестивалентный хром в бихромате неспецифически связывается с белками и нуклеопротеинами и специфически поглощается эритроцитами и тромбоцитами. Он восстанавливается до трехвалентного хрома, но соединение, возможно, в совокупности с образующимся в качестве промежуточного продукта пятивалентным хромом вызывает тяжелое свободнорадикальное поражение митохондрий, особенно в почечных канальцах и гепатоцитах.»
— Острые эффекты. Большие дозы могут индуцировать головокружение, жажду, боль в животе, рвоту, олигурию, анурию, шок, припадки, тяжелую коагулопатию, внутрисосудистый гемолиз и гепаторенальный синдром.
— Изучение отдельных случаев. 15-летняя девочка проглотила несколько гранул бихромата калия. После этого у нее началась рвота, больная потеряла сознание и через 12 ч умерла. Концентрация хрома в крови составляла 3,5 мг/100 мл. Высокие концентрации хромата были также обнаружены в печени, почках и желудке.
Шо там? Очередная яжмамка-пикабучница пукнула постом о том, что дитачки в опасносте?
Всегда интересно было, почему «хемо». Опять корявый перевод от корня chemo?
Правда ли, что опасно пить воду после повторного кипячения?
Авторы многочисленных статей в интернете утверждают, что воду нельзя кипятить больше одного раза, иначе она становится вредной для здоровья. Мы разобрали основные доводы в пользу этого тезиса.
Нередко бывает так, что вы включили чайник, отвлеклись и вспомнили о желании выпить горячего чаю, когда вода уже остыла. На русском языке доступны десятки материалов, призывающих в такой ситуации вылить содержимое чайника, наполнить его заново и ещё раз вскипятить, ведь повторное кипячение опасно. Доводов масса: от повышения концентрации солей до образования опасных соединений фтора, от возможного отравления мышьяком до (. ) преобразования обычной воды в «тяжёлую» дейтериевую. Давайте разберём эти аргументы.
При повторном закипании вода преобразуется в дейтерий
Дейтерий (или тяжёлый водород) — изотоп водорода с атомной массой, равной 2. В отличие от самого распространённого изотопа — протия, ядро атома дейтерия состоит из протона и нейтрона. В природе дейтерий составляет около 0,015% всего объёма водорода. Боязнь появления этого изотопа в обычном чайнике появилась в русскоязычной среде благодаря известному историку русской кухни Вильяму Похлёбкину, который написал об этом в 1968 году в своей книге о чае. Год спустя советские учёные подсчитали: чтобы концентрация дейтерия превысила природную в десять раз, в чайнике нужно вскипятить 2×10³³ кг воды, что на несколько порядков больше массы Земли. Из-за ничтожно малого КПД дейтерий добывают не кипячением, а с помощью ионного обмена или электролиза.
При повторном закипании в воде резко повышается концентрация мышьяка
Авторы нескольких материалов ссылаются на утверждение Всемирной организации здравоохранения (ВОЗ) о том, что мышьяк — самое опасное вещество, которое может оказаться в питьевой воде. В беднейших странах это действительно серьёзная проблема, но в большинстве государств концентрация мышьяка в водопроводной воде строго регламентируется. Например, в США предельный показатель — 0,01 мг/л, аналогичная норма действует и в России. ВОЗ считает опасным регулярное потребление воды с концентрацией мышьяка от 0,05 мг/л. Если вы полностью наполните чайник объёмом 1,7 л, то для получения такой пропорции вам нужно будет выкипятить около 80% воды. Для получения раствора, который может вызвать резкое отравление, нужно раз за разом кипятить чайник объёмом в 10 000 л.
При повторном закипании образуются фториды, которые замедляют развитие ребёнка
Пагубное влияние фтора на здоровье человека — это целая конспирологическая теория, у которой есть множество приверженцев. Рассказывая о вредоносности этого элемента и его солей, авторы проверенных нами материалов достают из рукава козырь: ссылаются на исследование Гарвардского университета. Такая статья действительно существует, её авторы также обозревали имевшиеся на тот момент сведения о влиянии фтора на неврологическое развитие. Вот только в этом исследовании ничего не сказано о кипячении. Мы можем провести такие же расчёты, что и с мышьяком. Возможно, дело в том, как кипячение влияет на концентрацию. Самая высокая (и при этом предвзятая) оценка токсичности фторидов для человека — 0,8 мг на кг массы тела, норматив содержания фторидов в питьевой воде в России — 1,5 мг/л. Чтобы чашка чая стала опасной из-за высокого содержания фтора, нужно выпарить до её объёма (350 мл) около 40 л воды.
При повторном закипании содержащиеся в воде нитраты преобразуются в канцерогены
Нитраты — вещества, содержащие нитрат-ион, — действительно могут содержаться в питьевой воде. При этом кипение не является условием для перехода такого соединения в канцероген нитрозамин. Исследование 2011 года показало, что кипячение может снизить концентрацию некоторых нитрозаминов в воде, а на концентрацию других вовсе не влияет. Преобразование нитратов в опасные канцерогены в куда большей степени зависит от того, какую очистку прошла вода перед тем, как вы начали её использовать.
При повторном закипании в воде повышается концентрация солей
По поводу этого аргумента справедливо всё то, что было сказано выше про мышьяк и фториды. Установленные нормы по содержанию солей в питьевой воде таковы, что их концентрация очень далека от опасных значений. Чтобы её достичь, воду нужно будет выпарить в несколько раз — двух кипячений для этого явно недостаточно. При этом, если сама вода недостаточно очищена и содержит опасные примеси, ни одно, ни два кипячения не сделают её менее вредной. Такую воду опасно пить в любом случае.
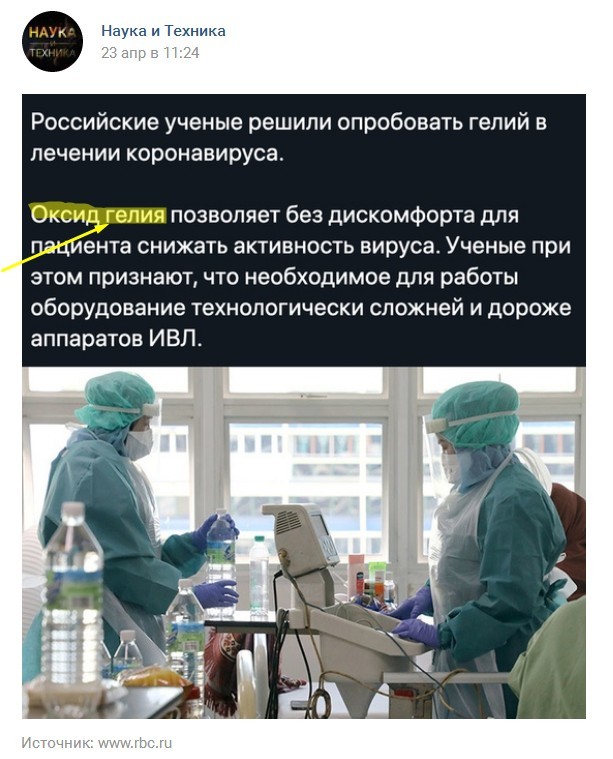
Оксид гелия
Проверяйте достоверность информации, которую получаете в Интернете.
Может быть, кому-то из вас покажется нормальной замена «смесь гелия и кислорода» названием несуществующего соединения.
Но смесь водорода и кислорода не становится водой, если не пройдёт реакция, в связи с чем не рекомендую варить суп из смеси водорода и кислорода=) Точно так же не рекомендую считать смесь гелия и кислорода оксидом гелия.
С одной стороны Интернет способствует распространению знаний, а с другой каждый пишет, что хочет. Но я считаю непозволительной роскошью сообществ Вконтакте с аудиторией почти 4 млн.человек и заявленной научной тематикой публиковать такие вот статьи из непроверенных источников.
Немного о химии Ч.1.
Теперь, когда с долгим вступлением закончено, перейдём непосредственно к теме поста. Недавно я заметил в Лиге Химиков пост про пахучие молекулы. После его прочтения и наложения жгута на шею, дабы остановить кровь из глаз, я обратился в комменты с вопросами. Ответы были ещё шикарнее.
В процессе разговора он апеллировал к тому, что учился, живёт и работает в нерусcкоговорящей стране (этот нюанс будет важен). Исходя из имеющихся данных я могу сделать вывод, что человек работает в парфюмерной компании на административной должности, так как имеет доступ к их складу. В химии он не смыслит ни капельки, но оставляет посты и люди ему верят. Рассмотрим проблемы в виде списка:
1) Пикабушник не различает склад и лабораторию, вследствие чего, выкладывает фото склада с подписью «лаборатория», пытаясь доказать, что он в ней работает.
2) Все названия (за редким исключением) написаны неверно, что невозможно для человека с профильным образованием, так как номенклатуру изучают ещё в школе, а потом забивают её в подкорку. Более того, если страна не русскоговорящая, то с большой долей вероятности, они используют латиницу, так как кириллицу использует не так много стран, а все страны с иероглифами и вязью (хинди, китайский, японский, грузинский и пр) используют латиницу для записи названий соединений. Неграмотно писать названия химик попросту не может, так как номенклатура едина для всех языков.
3) Этот пункт чрезвычайно обширен, поэтому нам понадобится список в списке, тут мы разберём провалы по порядку (прошу прощения, что разберу не все до единого):
первый пост автора
а) «Первое, что я помню, когда пришел на собеседование в лабораторию, в коридоре очень пахло фасолью, очень вкусно приготовленной фасолью». Напомню, автор говорит, что он работает не на постсоветском пространстве (где такое вероятно). Если только он не работает в Индии, то подобное невозможно. Все лаборатории оснащены вытяжками, тем более те, которые работают с пахучими веществами. Иначе бы весь персонал давно передох. Ну и собеседование проводят не в лаборатории (но оставим это на неточность формулировки).
б) «образец помещают в GS system, система газовой хроматографии». Ладно бы это была разовая опечатка, но далее по тексту он повторяет GS, так что опечатка исключается. Тут даже химию не надо знать, достаточно открыть гуглопереводчик: хроматография начинается на буксу «C», а не «S».
в) Соотнесение данных с базой происходит за секунды, ну несколько минут в случае большого списка. Хотя это можно списать на древнее оборудование.
г) «Далее лаборант смешивает все компоненты, смесь помещается на миксер с подогревом до 30 градусов. При более высоких температурах некоторые составляющие быстро испаряются.» Человек плохо представляет себе рабочий процесс. Для начала, подобная промышленность происходит не в цехах, а в вытяжных шкафах, поэтому там не может быть столитрового реактора. А лабораторную перемешивающую аппаратуру миксером не называют ни на одном языке. Ну и в открытой посуде подобное не делают, поэтому испарение роли не играет. К слову и при 30 градусах все пахучие молекулы отлично улетели бы из колбы, таковы их свойства.
д) «После конечных испытаний формула записывается в базу данных и проводятся окончательные подсчеты физических и химических свойств, таких как плотность, возгораемость и т.д». О какой формуле речь, если всю дорогу разговор был про смесь веществ? Ну а от словосочетания «подсчёты химических свойств» слабонервный химик может упасть в обморок, химические свойства исключительно экспериментальные, их даже для одной молекулы предсказать не всегда можно, а тут целая мешанина. С физическими проще, как минимум плотность смеси рассчитать можно, чего не скажешь о возгораемости.
второй пост автора
е) «все эти запахи не совсем похожи на натуральные». И сразу речь про лимонен, который является природным терпеном. А вообще, в целом, вы не задумывались, откуда берутся запахи в природе? Тоже из пахучих молекул. А тот же лимонен, вытянутый из цитруса или сделанный в колбе, ничем не отличается, это же не деревянная нога, а та же молекула. Безусловно, существуют синтетические аналоги, но они скорее исключения.
ж) Ошибки в номенклатуре. Я в курсе, что уже упоминал это, но автор не считает их большой проблемой, поэтому можно и снова упомянуть.
з) «Хороший пример – запах банана. Вы когда-нибудь ели кексы, или что-то с ароматом банана? Похоже на банан? Нет, это Iso Amyl Acetate. Это то, что нам подсовывают под видом банана» Isoamyl acetate (пишется так) является основным пахучим компонентом в природных бананах. Именно в тех, которые на пальмах, так что под видом банана вам подсовывают банан, а не то, что этот пикабушник думает.
и) «которые выдержат разную кислотность и низкую концентрацию». Учитывая химическую природу пахучих молекул, то первое требование вообще ахинея, они настолько стабильны, что проблема будет только если их варить в серной кислоте (можно даже разбавленной) или щелочи. Нюанс в том, что условия, в которых человеческая тушка уже перестанет подавать признаки жизни, для этих молекул всё ещё будут курортной зоной. За концентрации однозначно говорить не буду, я синтетик, а не парфюмер, но терпены и эфиры имеют свойство вонять даже в минимальных концентрациях.
На первый пост в серии этого более чем достаточно. Я не особо горю желанием заниматься «разоблачениями», но меня попросили, а разоблачать было что. В дальнейшем я хотел бы сфокусироваться на историях из опыта и попытках научпопа. Думаю, что стоит рассмотреть вопрос «там одна химия» и «тут всё натуральное». Всего вам доброго и будьте благоразумны.