димер что это в химии
Димер
Диме́р (от др.-греч. δι- — «два» и μέρος — «часть») — сложная молекула, составленная из двух фрагментов более простых молекул, называемых мономерами данной молекулы.
Димеры могут состоять как из одинаковых мономеров (тогда их называют симметричные Д.), либо из разных мономеров (тогда их называют несимметричные Д.)
Димеры могут быть как из органических мономеров, так и из неорганических.
Применение
Примером использования неорганических димеров может служить Эксимерный лазер
См. также
Полезное
Смотреть что такое «Димер» в других словарях:
димер — сущ., кол во синонимов: 1 • молекула (10) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Димер — * дымер * dimer молекула, состоящая из двух мономерных субъединиц (напр., функциональный фермент состоит из двух полипептидных цепочек). Две идентичные субъединицы димера образуют гомодимер, неидентичные гетеродимер, напр., гексозаминидаза… … Генетика. Энциклопедический словарь
димер — dimeras statusas T sritis chemija apibrėžtis Dviejų tokių pat molekulių susijungimo produktas. atitikmenys: angl. dimer rus. димер … Chemijos terminų aiškinamasis žodynas
Димер — іменник чоловічого роду районний центр в Україні … Орфографічний словник української мови
Димер хлорида золота(III) — Общие Систематическое наименование Димер хлорида золота(III) Химическая формула Au2Cl6 Физические свойства Состояние (ст. усл.) рубиново … Википедия
Димер иодида золота(III) — Общие Систематическое наименование Димер иодида золота(III) Химическая формула Au2I6 Физические свойства Состояние (ст. усл.) серо зелёны … Википедия
Димер хлорида золота(II) — Общие Систематическое наименование Димер хлорида золота(II) Традиционные названия Хлористое золото Химическая формула Au2Cl4 Физические свойства … Википедия
Димер, Карл — преподаватель французского языка 5 гимн. в СПб. 1874 г. <Венгеров>… Большая биографическая энциклопедия
Пиримидиновый димер — DNA Lesion Thymine Dimer Пиримидиновый димер дефект ДНК, возникающий в результате образования ковалентной связи между двумя соседними пиримидиновыми основаниями (тимидином или цитозином) под действием ультрафиол … Википедия
D-димер — Эта статья содержит текст, переведённый из статьи D dimer из … Википедия
Atas Dimer — Высококонцентрированное моющее средство
Информация от производителя:
Высококонцентрированное щелочное моющее средство, позволяющее обойтись без использования мочалки или щетки при мойке любого типа автотранспорта.
Продукт двухкомпонентный, обезжиривает и чистит, эффективен в борьбе с органическими или неорганическими жирными пятнами, смогом, землей, чернилами для печатей, пятнами крови и нефтяным осадком на кузове, бортах и алюминиевых деталях, тканях, шасси и колесах автомобиля. Содержащиеся в составе ПАВ с повышенной диспергидрируемостью и секвестранты позволяют продукту не терять своих чистящих свойств даже в воде с высоким содержанием солей.
Средство можно использовать согласно процедурам, предусмотренным системой контроля НАСС, для очищения и проведения санитарной обработки полов и оборудования мясокомбинатов, колбасных заводов и маслобоен.
Способ применения:
Разбавить продукт водой в следующем отношении:
1:70-100 для предварительной мойки
1:40-50 для обычной мойки
1:6-10 для очистки внешней части двигателя, колес и промышленного оборудования
1:40-60 для полов и оборудования мясокомбината, колбасного завода и маслобойни.
Равномерно распылить раствор снизу вверх, оставить на некоторое время, после чего смыть большим количеством воды с помощью автомойки без подогрева воды.
Предупреждения:
Т.к. продукт щелочной, рекомендуется особенно летом использовать его в тени на охлажденных поверхностях. При использовании концентрированного раствора избегать продолжительного контакта средства с алюминием и его сплавами.
Внешний вид — двухкомпонентная желто-зеленая жидкость
Запах — ароматизирован
Плотность при t°=20°C1,150
pH (водородный показатель) примерно 13 при t°=20°C
Равновесие молекул-димер
Вы будете перенаправлены на Автор24
Силы отталкивания, притяжения и образование химической связи
Между молекулами действуют силы притяжения, вызванные взаимодействием постоянных диполей полярных связей, а также индуцированными диполями. Действие сил притяжения влияет на химические свойства соединений.
Силы притяжения способствуют образованию молекулярных кристаллов и жидкостей, увеличивают скорость химической реакции.
При дальнейшем сближении молекул, начинают действовать силы отталкивания между заполненными валентными оболочками. В равновесных системах между силами притяжения и отталкивания наблюдается равновесие, а минимальное расстояние, на которое могут сблизиться молекулы, определяется ван-дер-ваальсовыми радиусами атомов.
Но, возможны ситуации, когда расстояние между молекулами становится меньше, чем ван-дер-ваальсовы радиусы (например, при конденсации пара в жидкость и твердое тело). Это указывает на то, что между молекулами устанавливается химическая связь. Образовавшаяся связь может быть слабой, средней силы или сильной.
Динамика реакции получения димера
Готовые работы на аналогичную тему
Непрореагировавшие пары молекул в результате теплового движения могут распасться, потом снова дать новые пары. Часть новых пар будет подходяще ориентирована, все время будет увеличиваться степень димеризации, но часть молекул димера будут вновь распадаться на мономерные молекулы. Таким образом, установится положение равновесия, соответствующее температуре образца.
Нарушение равновесия молекула-димер
Молекулы одного и того же соединения могут принимать участие в различных равновесиях.
Любой сдвиг в таком равновесии, который может быть обусловлен либо изменениями концентрации и температуры или взаимодействием с растворителем, отражается на спектральных изменениях, что справедливо и для ультрафиолетовой и инфракрасной спектроскопии, и по отношению к ядерному магнитному резонансу.
Важным равновесным состоянием является ассоциация молекул растворенного вещества. Равновесие сильно подвержено влиянию как природы растворителя, так и концентрации растворенного вещества.
Самоассоциация молекул
Образовавшийся самоассоциат может быть линейным или циклическим. Для ассоциации мономер-n-мер справедливо отношение
Величина наблюдаемого химического сдвига линейного типа имеет вид
для циклического самоассоциата
Методы предельного наклона и Липперта позволяют точно определить порядок ассоциации.
А димер ( / ˈ d аɪ м ər / ) (ди-, «два» + -мер, «части») является олигомер состоящий из двух мономеры связаны узами, которые могут быть сильными или слабыми, ковалентный или же межмолекулярный. Период, термин гомодимер используется, когда две молекулы идентичны (например, A – A) и гетеродимер когда это не так (например, A – B). Обратную димеризацию часто называют диссоциация. Когда два противоположно заряженных иона объединяются в димеры, их называют Пары Бьеррума. [1]
Содержание
Нековалентные димеры
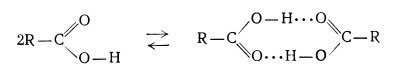
Карбоновые кислоты образуют димеры за счет водородной связи кислого водорода и карбонильного кислорода, когда безводный. Например, уксусная кислота образует димер в газовой фазе, где мономерные звенья удерживаются вместе за счет водородные связи. В особых условиях большинство ОН-содержащих молекул образуют димеры, например в димер воды.
Эксимеры и эксиплексы находятся в восторге конструкции с коротким сроком службы. Например, благородные газы не образуют стабильных димеров, но они (димеры) образуют эксимеры Ar2*, Kr2* и Xe2* под высоким давлением и электростимуляцией.
Ковалентные димеры
Молекулярный димеры часто образуются в результате реакции двух идентичных соединений, например: 2A → A-A. В этом примере мономер Говорят, что «A» димеризуется с образованием димера «A-A». Примером является диаминокарбен, димеризу тетрааминоэтилен:
Карбены обладают высокой реакционной способностью и легко образуют связи.
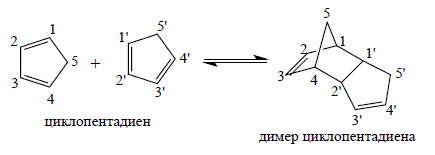
Дициклопентадиен представляет собой асимметричный димер двух циклопентадиен молекулы, которые прореагировали в Реакция Дильса-Альдера отдать продукт. При нагревании он «трескается» (подвергается ретро-реакции Дильса-Альдера) с образованием идентичных мономеров:
Многие неметаллические элементы встречаются в виде димеров: водород, азот, кислород, то галогены, т.е. фтор, хлор, бром и йод. Благородные газы могут образовывать димеры, связанные между собой облигации Ван-дер-Ваальса, Например дигелий или же диаргон. Меркурий встречается в виде катиона ртути (I) (Hg2 2+ ), формально димерный ион. Другие металлы могут образовывать часть димеров в своих парах. Известные металлические димеры включают Ли2, Na2, K2, Руб.2 и CS2.
Многие небольшие органические молекулы, особенно формальдегид, легко образуют димеры. Димер формальдегида (CH2O) есть диоксетан (C2ЧАС4О2).
Полимерная химия
В контексте полимеры, «димер» также относится к степень полимеризации 2, независимо от стехиометрии или реакции конденсации.
Это применимо к дисахариды. Например, целлобиоза димер глюкоза, даже если реакция образования производит воды:
Здесь димер имеет стехиометрию, отличную от пары мономеров.
Аминокислоты также могут образовывать димеры, которые называются дипептиды. Примером является глицилглицин, состоящий из двух глицин молекулы соединены пептидная связь. Другие примеры: аспартам и карнозин.
Биохимические димеры
Димеры пиримидина сформированы фотохимическая реакция из пиримидина Основания ДНК. Это перекрестное связывание вызывает Мутации ДНК, который может быть канцерогенный, вызывая рак кожи.
А димер ( / ˈ d аɪ м ər / ) (ди-, «два» + -мер, «части») является олигомер состоящий из двух мономеры связаны узами, которые могут быть сильными или слабыми, ковалентный или же межмолекулярный. Период, термин гомодимер используется, когда две молекулы идентичны (например, A – A) и гетеродимер когда это не так (например, A – B). Обратную димеризацию часто называют диссоциация. Когда два противоположно заряженных иона объединяются в димеры, их называют Пары Бьеррума. [1]
Содержание
Нековалентные димеры
Карбоновые кислоты образуют димеры за счет водородной связи кислого водорода и карбонильного кислорода, когда безводный. Например, уксусная кислота образует димер в газовой фазе, где мономерные звенья удерживаются вместе за счет водородные связи. В особых условиях большинство ОН-содержащих молекул образуют димеры, например в димер воды.
Эксимеры и эксиплексы находятся в восторге конструкции с коротким сроком службы. Например, благородные газы не образуют стабильных димеров, но они (димеры) образуют эксимеры Ar2*, Kr2* и Xe2* под высоким давлением и электростимуляцией.
Ковалентные димеры
Молекулярный димеры часто образуются в результате реакции двух идентичных соединений, например: 2A → A-A. В этом примере мономер Говорят, что «A» димеризуется с образованием димера «A-A». Примером является диаминокарбен, димеризу тетрааминоэтилен:
Карбены обладают высокой реакционной способностью и легко образуют связи.
Дициклопентадиен представляет собой асимметричный димер двух циклопентадиен молекулы, которые прореагировали в Реакция Дильса-Альдера отдать продукт. При нагревании он «трескается» (подвергается ретро-реакции Дильса-Альдера) с образованием идентичных мономеров:
Многие неметаллические элементы встречаются в виде димеров: водород, азот, кислород, то галогены, т.е. фтор, хлор, бром и йод. Благородные газы могут образовывать димеры, связанные между собой облигации Ван-дер-Ваальса, Например дигелий или же диаргон. Меркурий встречается в виде катиона ртути (I) (Hg2 2+ ), формально димерный ион. Другие металлы могут образовывать часть димеров в своих парах. Известные металлические димеры включают Ли2, Na2, K2, Руб.2 и CS2.
Многие небольшие органические молекулы, особенно формальдегид, легко образуют димеры. Димер формальдегида (CH2O) есть диоксетан (C2ЧАС4О2).
Полимерная химия
В контексте полимеры, «димер» также относится к степень полимеризации 2, независимо от стехиометрии или реакции конденсации.
Это применимо к дисахариды. Например, целлобиоза димер глюкоза, даже если реакция образования производит воды:
Здесь димер имеет стехиометрию, отличную от пары мономеров.
Аминокислоты также могут образовывать димеры, которые называются дипептиды. Примером является глицилглицин, состоящий из двух глицин молекулы соединены пептидная связь. Другие примеры: аспартам и карнозин.
Биохимические димеры
Димеры пиримидина сформированы фотохимическая реакция из пиримидина Основания ДНК. Это перекрестное связывание вызывает Мутации ДНК, который может быть канцерогенный, вызывая рак кожи.