дисиммуноглобулинемия что это такое
Что такое вторичный иммунодефицит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Бычковой Е.Ю., остеопата со стажем в 22 года.
Определение болезни. Причины заболевания
Вторичный иммунодефицит формируется у людей старше 6 лет с исходно нормальным иммунитетом. До этого возраста происходит созревание иммунной системы, особенно полноценных механизмов противоинфекционной защиты, поэтому частое развитие инфекционных заболеваний у детей младше 6 лет не является признаком патологии.
Появление вторичного иммунодефицита обычно связано с воздействием окружающей среды или каких-либо других факторов, но у многих из пациентов можно выявить генетическую предрасположенность к нарушению иммунитета.
Иммунологически здоровый организм способен контролировать и предотвращать развитие инфекций и опухолевых процессов, то есть осуществлять иммунологический контроль внутренней среды.
Когда можно заподозрить вторичный иммунодефицит
Причины развития вторичных иммунодефицитных состояний:
Иммунодефицитные состояния у детей
Развитию иммунодефицита у детей, как и у взрослых, способствуют:
Дисбактериоз у матери является причиной дисбактериоза у ребёнка с последующим замедлением и неполноценным созреванием иммунной системы. Каждый курс антибиотикотерапии может усугубить это состояние.
Проявления иммунодефицита зависят от степени его выраженности, они сопровождаются частыми ОРВИ с инфекционными осложнениями, эпизодами лихорадки, болезненностью, увеличением лимфоузлов, болью в животе, рвотой и нарушением стула.
Симптомы вторичного иммунодефицита
Как проявляется вторичный иммунодефицит
Клинические проявления вторичного иммунодефицита разнообразны. Очень часто на первый план выходят симптомы основного заболевания, которое привело к развитию иммунодефицита. Но основные проявления проблем с иммунитетом, которые указывают на необходимость иммунологического обследования, всё же присутствуют. К ним относятся:
Все хронические инфекции и воспаления протекают на фоне ослабленной иммунной защиты. Поэтому любая хронизация инфекции будет указывать на несостоятельность иммунитета, который не может справиться с болезнью в ходе острого воспалительного процесса.
Патогенез вторичного иммунодефицита
В течение жизни организм подвергается воздействию различных повреждающих факторов, вызывающих вторичный иммунодефицит. Они приводят к угнетению реакций клеточного иммунитета, снижению лейкоцитов и интерферонов — белков иммунной системы, которые вырабатываются лейкоцитами и иммунными клетками и блокируют распространение вируса. Вследствие этого появляются хронические инфекционно-воспалительные процессы, часто рецидивирующие.
Опухоли, возникающие в организме с ослабленной иммунной защитой, истощают иммунитет по мере своего роста, а проводимое лечение (операция, лучевая и химиотерапия) усугубляют возникший иммунодефицит. В этом случае страдает клеточное звено иммунитета:
Классификация и стадии развития вторичного иммунодефицита
По причине возникновения выделяют:
По форме вторичный иммунодефицит может быть:
По продолжительности выделяют два типа вторичного иммунодефицита:
По локализации основного дефекта различают:
Установить локализацию повреждения иммунной системы, основываясь только на симптомах, без лабораторного исследования иммунного статуса, практически невозможно: сходная клиническая картина может наблюдаться при разных типах вторичного дефицита. Например, склонность к вирусным инфекциям может встречаться как при Т-клеточном дефиците, так и при дефиците системы интерферонов.
Осложнения вторичного иммунодефицита
Вторичный иммунодефицит, развивающийся на фоне инфекции и/или воспаления, становится причиной тяжёлых жизнеугрожающих состояний. Без своевременной коррекции иммунитета патологический круг замыкается: течение основной болезни ухудшается.
Наиболее частыми осложнениями вторичного иммунодефицита являются тяжёлые инфекционные заболевания: пневмония, сепсис, абсцесс и флегмона. Их основные проявления: высокая температура и признаки воспаления. При пневмонии наблюдается одышка, кашель и боль в грудной клетке. Сепсис является жизнеугрожающим состоянием, он развивается при попадании в кровь инфекции, сопровождается системной воспалительной реакцией и полиорганной недостаточностью. При абсцессах и флегмоне в организме присутствует очаг гнойного воспаления с выраженной болью, отёком и гиперемией (покраснением).
Диагностика вторичного иммунодефицита
Диагноз «вторичный иммунодефицит» ставится на основании истории болезни, физикального обследования и оценки статуса иммунной системы.
Чтобы назначить эффективных мер по коррекции иммунитета, важно выявить факторы, которые поспособствовали развитию иммунодефицита. Поэтому на консультацию к врачу-иммунологу стоит принести все имеющиеся обследования, а врач будет очень подробно расспрашивать о перенесённых заболеваниях, проведённом лечении, операциях и образе жизни пациента.
Как распознать вторичный иммунодефицит
При подозрении на вторичный иммунодефицит врач назначает анализ крови и иммунограмму — иммунологические тесты, которые оценивают компоненты иммунной системы с точки зрения количества и качества.
Схема обследования различных звеньев иммунной системы (иммунограмма):
На вторичный иммунодефицит могут указывать как пониженные, так и повышенные показатели иммунограммы.
При подозрении на дисбаланс ключевых нутриентов (витаминов, микроэлементов и т. д.) врач-иммунолог может назначить исследования:
В своём заключении врач-иммунолог может указать «вторичный иммунодефицит» как основной или сопутствующий диагноз. Всё зависит от клинической картины.
Лечение вторичного иммунодефицита
Лечение пациента с вторичным иммунодефицитом проводится совместно с врачом, который курирует пациента по поводу основного заболевания. Задача врача-иммунолога заключается в подборе иммунокорригирующей терапии.
«Коррекция иммунитета» в данном случае подразумевает восстановление ослабленной иммунной защиты, исправление дисбаланса её компонентов и иммунных реакций, ослабление патологических иммунных процессов и подавление аутоиммунных реакций.
Лечение вторичного иммунодефицита начинают с определения и устранения его причины. Например, при нарушении иммунитета, вызванном инфекционно-воспалительным процессом, устраняются очаги хронического воспаления.
Если вторичный иммунодефицит возник в результате витаминно-минеральной недостаточности, то назначаются комплексы, содержащие дефицитные компоненты. Например, при истощении лимфоузлов и старении вилочковой железы назначают витамины В6. При обострении или начале аутоиммунных и лимфопролиферативных заболеваний показаны витамины Е.
Важными минералами для иммунной системы являются цинк, йод, литий, медь, кобальт, хром, молибден, селен, марганец и железо. Эти микроэлементы помогают активировать ферменты, которые участвуют в иммунных реакциях. К примеру, цинк предотвращает гибель клеток иммунной системы.
Заместительное лечение вторичного иммунодефицита
Заместительная терапия помогает предотвратить инфекции. Для этого применяют:
Иммунотропное лечение вторичного иммунодефицита
При остром инфекционном воспалении иммуностимуляторы позволяют:
При хроническом инфекционном воспалении иммуномодуляторы:
На степень эффективности иммунокоррекции влияет кратность приёма и стадия заболевания. Срок действия иммуномодуляторов зависит от характера препарата, показателей иммунного статуса и вида заболевания, вызвавшего вторичный иммунодефицит.
Устранение дефицита одного звена иммунитета может привести к компенсации другого звена, так как иммунная система работает по принципу взаимосвязанных модулей.
Может быть назначен как один иммуномодулятор, так и несколько, то есть их комбинация. При комбинированной иммунокоррекцией последовательно или одновременно принимают несколько модуляторов, обладающих разными механизмами действия. Таких иммуномодулирующих препаратов сейчас довольно много.
Показаниями для комбинированной иммунотерапии являются:
ВАЖНО: Самостоятельно назначать себе иммунокорректоры нельзя, так как их бесконтрольное применение может спровоцировать развитие вторичного иммунодефицита.
Прогноз. Профилактика
При вторичном иммунодефиците работа иммунной системы нарушена слабее, чем при первичном. В большинстве случаев выявляется несколько факторов, подавляющих иммунный ответ.
Прогноз определяется тяжестью основного заболевания. Например, если иммунодефицит возник из-за нехватки витаминов или нарушения режима труда и отдыха, он намного легче компенсируется, чем иммунодефицит, спровоцированный опухолевым процессом, сахарным диабетом или ВИЧ-инфекцией.
У детского организма отдельные звенья иммунной системы ещё незрелы: Т-лимфоциты только начинают «знакомиться» с различными инфекциями, поэтому ребёнок часто болеет ОРВИ. Со временем нарабатываются «клетки памяти». По мере взросления формируется широкий «репертуар» Т-лимфоцитов, способных распознавать и быстро запустить иммунный ответ, в связи с чем заболеваемость снижается.
С возрастом иммунная система стареет: в ответ на новые антигены участвует меньше Т-клеток, ухудшается кооперация между клетками иммунной системы, фагоциты хуже поглощают вирусы и мёртвые клетки. Поэтому многие инфекционно-воспалительные заболевания у пожилых людей протекают значительно тяжелее и чаще дают осложнения.
Первичная профилактика вторичного иммунодефицита заключается в ведении здорового образа жизни, сбалансированном питании, отказе от курения. Всё это позволяет предупредить развитие различных заболеваний.
Вторичная профилактика направлена на своевременное лечение инфекционных и общесоматических заболеваний.
Людям с вторичным иммунодефицитом нужны «особые условия», которые не позволят усугубить нарушение иммунитета. Пациентам следует:
Вакцинотерапия
Вакцинация проводится в соответствии с национальным календарем прививок. Перед введением вакцины нужно скомпенсировать иммунодефицит: пропить курс витаминов, минералов и иммуномодуляторов по назначению врача. Это позволит сформировать иммунный ответ на прививку и снизить риск осложнений.
Дисиммуноглобулинемия что это такое
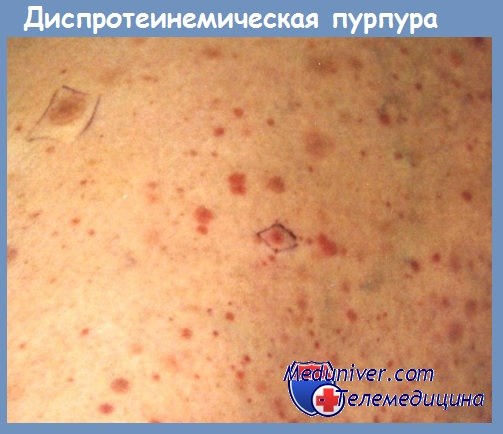
Дисгаммаглобулинемические или гипергаммаглобулинемические пурпуры, известные уже давно, обособились с точки зрения их механизма и клинической сущности когда Вальденштрем дал описание макроглобулинемической пурпуры. Ее следует отличать от гипергаммаглобулинемических пурпур в течение злокачественных пролиферации, имеющих моноклинальный характер, с гиперсекрецией IgM, и от гипергаммаглобулинемических пурпур при реактивных пролиферациях, поликлонального характера на почве роста нескольких классов Ig, а также и на почве расстройств последних, разделенных на 7 типов дисгаммаглобулинемий, описанных за последние несколько лет (Berceanu). При последних в капиллярной стенке преципитируют макроагрегаты иммунных комплексов антиген-антитело, которые часто встречаются при автоиммунных заболеваниях, таких как красная волчанка или хронические селфпродолжающиеся васкулиты, как это описано в связи с хронической пурпурой Шенлейн-Геноха с эволюцией к висцерализации.
Особая форма пурпурового васкулита появляется и при первичных или вторичных амилоидозах, иногда в рамках лимфом, в том числе болезни Ходжкина, и миэлом с длительной эволюцией, но и при красной волчанке и дисгаммаглобулинемии после вялотекущего эндокардита.
При всех этих васкулопатиях существуют некоторые общие механизмы образования пурпуровых сосудистых поражений, а также и других геморрагических явлений. В основном, моноклональные глобулиновые агрегаты, как IgM и реже IgG или IgA при миеломах, или поликлональные, по поводу иммунных комплексов или агрегатов IgG — IgM (ревматоидный фактор) при красной волчанке, детерминируют изменения сосудистой пермеабильности благодаря поражениям эндотелия, сопровождающихся или не сопровождающихся воспалительными реакциями.
Кроме этого, глобулиновые комплексы в избытке, наряду с физико-плазматическими изменениями с повышением вязкости, с модификациями циркуляторной динамики депонируются и обволакивают оболочки эритроцитов, лейкоцитов и тромбоцитов и ингибируют их аггрегацию в первичной фазе коагуляции. Взаимосвязь тромбоциты — сосуд глубоко альтерирована, так как оба компонента оказываются модифицированными благодаря отложению глобулиновых аггрегатов. К этому следует добавить, что в особенности при моноклональных формах происходят альтерации факторов коагуляции, особенно факторов V, VII, X, XI, XII.
Происходят ингибиции во время реакции выведения тромбоцитарных факторов с пониженными высвобождениями F3, а также и физические изменения фибриногена,, который порочно полимеризуется в фибрин. Вместе с криоглобулинами, которые могут появляться в этих условиях, может появляться и криофибриноген, который глубоко альтерирует последнюю фазу коагуляции. Комплексное участие нескольких патогенетических факторов объясняет, почему при некоторых геморрагических синдромах по поводу дисглобулинемий преобладают пурпуровые синдромы, в то время как при других появляются геморрагии типа коагулопатии. Первые происходят по поводу альтерации сосудистых стенок и тромбоцитов. В остальных преобладает интерференция факторов коагуляции.
Существуют также и случаи моноклональных и поликлональных гипергаммаглобулинемий при хронических гепатических заболеваниях, которые усугубляют геморрагические расстройства другого рода в этих условиях.
Среди различных форм васкулопатий по поводу гаммапатий недавно были выделены две специальные группы, сами по себе весьма гетероморфные: криоглобулинемии, обычно с тяжелой эволюцией, и доброкачественные гипергаммаглобулинемические пурпуры, причем последние известны уже давно (Schwartz и Frei, Kyle и сотр., Goltz и Good). Как упоминалось выше, говоря о разнообразных условиях возникновения дисгаммаглобулинемии, существует возможность появления макроаггератов благодаря криофибриногену.
Сосудистые пурпуры при доброкачественных моноклональных гаммапатиях происходят посредством того же механизма — преципитации гаммаглобулиновых аггрегатов; следует отметить возможность возникновения лимфоидной или плазмоцитарной злокачественной пролиферации, как это указывалось еще в первые наблюдения (Kyle и сотр.). Из наших собственных наблюдений вытекает, что пурпуровые синдромы при доброкачественных моноклональных гаммапатиях встречаются редко (Sighetea и сотр.).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Дефицит иммуноглобулинов: виды и причины
В статье мы расскажем:
Иммуноглобулины или антитела — один из факторов специфической защиты против различных, незаконно вторгшихся на территорию организма патогенных агентов: вирусов, бактерий, грибов, а также аллергенов. Их строение, механизм активации и процесс реализации функции достаточно сложен — это не просто универсальные киллеры, а четко разграничивающие “свое” и “чужое” исполнительные фигуры на шахматной доске иммунитета.
Как переизбыток, так и дефицит иммуноглобулинов, в целом или определенного класса, может быть признаком различных заболеваний, поэтому определение их концентрации является важным, а иногда и наиболее ранним этапом диагностических мероприятий, что позволяет вовремя установить вид возбудителя, а, значит, назначить и правильное лечение.
Строение антител
Все иммуноглобулины содержат в своей структуре две разновидности цепей, связанные между собой химическими (дисульфидными) связями: тяжелые (или Н-) и легкие (L-) — и именно вариации первых способствуют разделение антител на классы. Специфическое сочетание отдельных участков цепей, свернутых в шарики-глобулы — доменов — приводит к образованию так называемого паратопа или антигенсвязывающего центра — ключевой структуры, что, в сущности, и обеспечивает создание комплекса “антитело-чужеродный агент”.
Кроме того, каждый иммуноглобулин имеет фрагменты, что способствуют его связыванию с макрофагами — такими себе “клетками-мусорщиками”, которые проглатывают и пожирают микробные бактерии. Это еще раз говорит о неразрывности двух звеньев иммунитета: клеточного и гуморального. Кстати, в качестве еще одного неоспоримого доказательства в пользу данного важного для понимания природы иммунного ответа и механизмов его осуществления, является и тот факт, что некоторые классы антител способны выступать в роли облегчающих факторов ранее упомянутого процесса фагоцитоза.
Примечательно и то, что антитела, продуценты которых — плазмоциты — последними из всех защитников-полицейских добираются в очаг воспаления — циркулируют не только в крови, но обнаруживаются и в некоторых выделяемых человеческим телом секретах. Речь идет о секреторных формах — которой, в частности, обладает представитель такого класса, как иммуноглобулин А, обнаруживающийся, скажем, в составе компонентов слезной жидкости, а также обеспечивающий защиту эпителиальным клеткам желудочно-кишечного тракта. Существование подобной формы требует не только определенной перестройки в “изначальной” молекуле антитела, но и наличия дополнительной (кроме стандартных легких и тяжелых) цепи.
Механизм образования антител
Продуцентами антител, как уже ранее было сказано, являются плазмоциты — конечные продукты развития (дифференциации) В-лимфоцитов, что в норме образовываются в красном костном мозге, подобно другим клеткам крови, а затем отправляются на своеобразное обучение за границей — в такие органы, как селезенка и лимфоузлы. Здесь, за школьными партами и под контролем опытных преподавателей они проходят серьезное обучение, целью которого — сформировать четкое и окончательное понимание, что “своё”, а что “чужое” и подлежит уничтожению.
Финальный выпускной экзамен суров — судей подкупить невозможно, и малейший сбой в программе незамедлительно приводит к инактивации путем смертного приговора “неправильного” клона. Подобный четкий регламент правил имеет весьма внушительные основания: ведь, начни сбрендившая и вырвавшаяся из-под общего контроля клетка образовывать подобные пули и стрелы против тканей собственного организма, начнется настоящая неразбериха и хаос, каким обычно представляется аутоиммунный процесс.
Впрочем, справедливости ради, стоит все же отметить, что не всегда такая строгая селекция приносит плоды результата: и все кроется в таких особенностях человеческого тела, как существование гистогематических барьеров — в норме непроницаемых границ, отделяющих некоторые органы. Бесспорно, все слышали о ГЭБ — гематоэнцефалическом барьере — тем таможенным контролем, что разграничивает нервную ткань головного мозга и циркулирующую по сосудам кровь.
Именно благодаря существованию подобных ограничивающих преград — их всего пять — во время эмбрионального развития иммунная система лишена возможности познакомиться с антигенами “забарьерных” органов — таким образом, сталкиваясь при той или иной патологии с ними, она, без всяких раздумий, расценивает их в качестве чужеродных а, следовательно, задействует свою внушительную арматуру — в частности, антителопродукцию. Наблюдается нарушение естественной иммунологической толерантности.
Однако, ни В-лимфоциты, ни их зрелые формы — плазмоциты — не способны самостоятельно активироваться при контакте с большинством патогенных агентов (хотя есть и редкие исключения) — для этого им нужен стимулирующий сигнал от Т-клеток: такой себе пинок к действию, осуществляемый на молекулярном и клеточном уровнем. Предоставляют им такую возможность Т-хелперы, разношерстная популяция ранее упомянутого вида лимфоцитов: они, секретируя определенные молекулы, разрываются сиреной тревоги.
Впрочем, если бы сам процесс на этом этапе закончился, было бы скучно и, в некотором роде, примитивно. Однако природа — та еще кудесница. Т-хелперы — это посредники, что только передают услышанную информацию о внезапном вторжении: сами они с врагами не борются и разведчиков не пытают. Их единственная задача — распознать и доложить вышестоящему руководству.
Итак, давайте по порядку. В организм каким-либо путем попадает чужеродное вещество, что, в зависимости от состояния иммунитета и других функциональных систем, на одной из таможенных границ перехватывается и поглощается полицейским-макрофагом — в нем оно пробудет до дальнейшего разбирательство в зале суда и вынесения окончательного и беспристрастного приговора. “Пожирание” нарушителей порядка приводит к некоторым изменениям в структуре их надзирателя — в частности, на своей поверхности он экспрессирует определенные белковые комплексы, что и будут представлять представителям определенных популяций Т-лимфоцитов (а точнее их рецепторам) частицы чужеродного антигена. Дальше, путем сложных каскадных механизмов передачи различного рода сигналов, произойдет распознавание врага и выбор тактики боя: с подключением антителопродукции или сугубо клеточными силами.
Классификация антител
В зависимости от того, при какой температуре иммуноглобулины образуют комплексы с антигеном — чужеродным для данного конкретного организма веществом — все антитела можно разделить на две группы:
Тепловые — “склеивают” антиген при температуре тела — то есть при 37 градусах;
Холодовые — взаимодействуют с антигенами, в среднем, при +4.
Исходя из способности образовывать большую (макромолекулярную) структуру, вступая в реакцию взаимодействия с патогенным агентом, иммуноглобулины бывают полными и неполными.
Основная, наиболее часто применяемая классификация иммуноглобулинов основывается на том, какой вид тяжелой цепи лежит в основе их природы. Так, выделяют 5 классов:
Иммуноглобулины М (IgM) — образуются в момент первой встречи иммунокомпетентных клеток с антигенами. Процесс этот достаточно длительный и характеризуется внушительной латентной фазой — так, диагностически значимые титры антител появляются только ко 2-й недели заболевания — в среднем, на 10-14-е сутки.
Итак, данный класс антител — своеобразные первопроходцы, которым доводиться знакомиться с нежеланными гостями и, только после не самого радужного чаепития, переключать антителопродукцию на синтез их несколько отличающихся собратьев.
Иммуноглобулины G — именно на их долю приходится большая часть антител в сыворотке крови (до 80%). Обладая небольшими размерами и маленькой молекулярной массой, они являются единственным классом антител, что проходит через плацентарный барьер и обеспечивает, таким образом, естественный пассивный иммунитет плода — впрочем, он длится не более полугода.
В целом, неспособность большинства иммуноглобулинов преодолевать эту преграду, которая четко разграничивают кровь матери и плода, играет двоякую роль — как положительную, так и отрицательную. Так, скажем, одна из ведущих причин развития менингита, воспаления оболочек головного мозга бактериальной природы, что вызывается некоторыми условно-патогенными штаммами кишечной палочки, связана как раз с неприступностью для основной массы антител таможенной границы в виде плаценты.
Как уже было ранее сказано, при первичном контакте с чужеродным веществом, на фабрике по антителопродукции запуск партийного образования IgG происходит не сразу — и в этом заключается отличие реакций организма при дальнейших повторных свиданиях. Наше тело уникально: оно обладает собственными архивами памяти, где неустанно фиксируется характер каждого из вражеских набегов.
Итак, при второй, третьей, десятой встрече латентная фаза, в течение которой сонных мух в виде иммунокомпетентных клеток растормаживают, длится в несколько раз меньше: вместо 3-5 суток — всего несколько часов. К тому же, нет и переключения: сразу начинается синтез иммуноглобулинов различных классов. Организм, несмотря на неожиданность вторжения, хорошо подготовлен теоретически и в состоянии дать куда более быстрый отпор.
С точки зрения правильного установления стадии болезни, диагностически важным является то, что, несмотря на куда более позднее появление, IgG имеет достаточно продолжительный период полувыведения, что в среднем составляет 23 дня, — по сравнению с 2-3 у IgM.
Таким образом, можно сделать еще одно важное заключение: обнаружение в крови пациента антител класса М — яркое свидетельство протекающего патологического процесса, в то время как выявление IgG может говорить как о недавно проведенной вакцине (ведь, по сути, она содержит мертвых или ослабленных возбудителей или же фрагменты их молекул) или об анамнестическом процессе.
IgA — могут быть представлены как в сывороточной (до 10%), так и в секреторной формах. Последняя, кстати, является лидирующей и обеспечивает противомикробный местный иммунитет по отношению к слизистым оболочкам желудочно-кишечного тракта, бронхов, мочевыводящих путей.
Несмотря на то, что они не способны проходить через плаценту, эти иммуноглобулины передаются новорожденному вместе с материнским молоком — еще один важный нюанс в сторону неоспоримой пользы грудного вскармливания.
Интересно, что некоторые возбудители патогенных заболеваний, инвазирующие, как правило, слизистые оболочки тех или иных органов, обладают специфическим факторам защиты против полицейских человеческого организма: ферментами-протеазами, способными расщеплять химические связи в белковых молекулах антител.
Секреторная форма иммуноглобулина А способна специфически узнавать и связываться с определенными участками антигенов — эпитопами — в структурах как бактерий, так вирусов и даже токсинов.
IgD — малоизученный класс антител с очень низким содержанием в крови. Их роль в работе иммунной системы более, чем не ясна.
Предполагается, что они участвуют в аутоиммунных реакциях, а также выступают в качестве рецепторов В-лимфоцитов.



IgE — их концентрация в сыворотке не превышает 0.004% от общего количества антител. Впрочем, такое небольшое содержание не мешает им выполнять одну из важнейших задач: участие в аллергических реакциях. Последние протекают при появлении в сыворотке аллергенов — чужеродных веществ, что вызывают развитие повышенной чувствительности со стороны организма. При этом происходит их своеобразное “связывание” IgE, фиксированными на тучных клетках — представителях компонентов соединительной ткани. Таким образом, организм впервые знакомиться с незнакомым им веществом.
При повторном попадании аллергена, уже осведомленная иммунная система, незамедлительно активируется: происходит высвобождение депонирующихся в гранулах тучных клеток медиаторов воспаления (в частности, гистамина), что способствует дальнейшему повреждению тканей.
Как правило, к подобным процессам относятся анафилаксия, возникающая при парентеральном (то есть в обход желудочно-кишечного тракта) введении чужеродных веществ, а также атопии, развивающиеся у генетически предрасположенной категории людей, и включающие в себя:
поллинозы или аллергические риниты;
Аллергия и псевдоаллергия
Для правильного и четкого понимая проблемы, с которой к вам обращается клиент, необходимо точно различать эти, в корне отличающиеся друг от друга, термины:
Псевдоаллергия — патологический процесс, который по манифестации клинических проявлений и симптомов схож или даже идентичен тем, что возникают при аллергии. Однако в механизме его развития отсутствует иммунологическая стадия — то есть нет предварительного связывания IgE аллергенов, а сразу наблюдается непосредственное высвобождение медиаторов воспаления — в частности, гистамина.
1. Патология иммунной системы.
1. Обусловлена повышенным уровнем гистамина.
2. Высокий уровень IgE.
2. Нормальный уровень IgE.
3. Уровень гистамина в пределах нормы.
3. Повышение концентрации гистамина.
4. Реакция возникает на введение малых доз аллергена.
4. Реакция — на большие дозы аллергенов.
5. Предварительная сенсибилизация (повышение чувствительности) тучных клеток при первичном контакте.
5. Непосредственное воздействие на клетки-мишени.
6. Специфичность реакций — возникают на одно вещество.
6. Отсутствие специфичности.
Нормы антител
Референсные значения для общего IgE (мЕ/л) по Martins T. et al. (2014)