для чего используется азотная кислота в быту
Азотная кислота. Свойства, добыча, применение и цена азотной кислоты
В полумраке же, кислота с водой легко смешивается в любых пропорциях. У вещества есть и кристаллическое состояние.
Оно может быть моноклинным и ромбическим. Это указывает на форму ячеек кристаллической решетки.
Моноклинная составлена из наклоненных параллелепипедов, а ромбическая, соответственно, из ромбов.
Свойства азотной кислоты
В обычных условиях кристаллическую кислоту можно лицезреть лишь в жарких странах.
В твердое состояние бесцветная жидкость переходит лишь при 42-ух градусах Цельсия. До этой отметки вещество остается жидким и парит.
При этом, реагент источает резкий, удушливый запах. С ним, собственно, связана история открытия азотной кислоты. Обнаружил ее Даниэль Резерфорд.
Ученый отметил, что вещество не поддерживает горение и непригодно для дыхания.
Позже, выяснилась формула азотной кислоты: — HNO3. Получается, вещество одноосновное.
Поэтому, существует концентрированная азотная кислота и неконцентрированная.
Первая активно дымит, то есть, летуча. Химические свойства концентрата разнятся с разбавленой версией.
Отсюда вывод, в какой таре нужно хранить вещество. Золотые и платиновые фляги, конечно, не выгодны.
А вот емкости из железа и алюминия и бюджетны, и надежны, поскольку закрывают кислоту от света. Главное, не выбрать тару из меди. Азотная кислота ее растворит.
Реагируя с металлами, концентрированный раствор азотной кислоты выделяет бурый газ. Его формула: — NО2.
Параллельно, образуются соли кислоты. В зависимости от растворенного металла, реакции разнятся.
Если к кислоте присоединится соль любого металла после меди, металл отделится. Вместе с ним выделяются бурый газ и кислород.
Разбавленная азотная кислота реагирует с большинством тех же металлов, но, окисляется при этом до аммиака.
К такому исходу приводит взаимодействие, к примеру, с цинком и элементами щелочноземельной группы. В реакцию вступает и железо.
Так что, разбавленную кислоту в емкостях из сплавов с феррумом лучше не хранить.
Самый редкий вариант – закись азота. Ее даст, к примеру, реакция с магнием. С остальными металлами азотная кислота образует оксид азота.
По этой же схеме проходят реакции кислоты с неметаллами, только, вместо солей формируется серная кислота.
Ее так назвали, поскольку вещество растворяет даже золото – металл правителей, сильных мира сего.
Добыча азотной кислоты
В малых количествах вещество возможно добывать даже из воздуха, причем, в прямом смысле. Не секрет, что азот – одна из составляющих атмосферы.
Он-то и реагирует с водой, взвесь которой, как известно, имеется в воздухе. Вступая в контакт с облаками, туманом, бурый газ переходит в азотную кислоту.
Массовая доля азотной кислоты в атмосфере столь мала, что вещество не наносит вред человеку, да и другим живым организмам.
Для промышленной добычи кислота из воздуха тоже не годится. На заводах пользуются иными схемами.
Первая: — производство азотной кислоты из аммиака. Сначала, проводят его конверсию, то есть, дробление состава исходной газовой смеси.
Реакция проходит на платинородиевых сетках при температуре около 1000 градусов Цельсия. Так получают оксид азота. Его окисляют до диоксида.
Это вторая стадия процесса. После, оксиды азота абсорбируют водой. В итоге, получается азотная кислота и чистая вода.
Описанный метод приводит к образованию разбавленной кислоты. Возможна последующая концентрация.
Поэтому, метод наиболее популярен, ведь потребителям нужна, как насыщенная, так и ненасыщенная кислоты.
Работая с аммиаком, промышленники «убивают одним выстрелом двух зайцев».
Второй метод производства реактива приводит сразу к получению концентрата. Речь о прямом синтезе из оксидов азота. Берут жидкие.
Они взаимодействуют с водой и кислородом. Такие реакции с азотной кислотой проходят под давлением в 5 мегапаскалей.
Получается диоксид азота. В обычных условиях он переходит в жидкое состояние. Окисление аммиака дает двойной оксид азота.
В газовой смеси его около 11%. Сжижжают диоксид под давлением. При стандартных условиях переход невозможен.
Применение азотной кислоты
Прежде чем апробировать и продать драгоценный металл, его нужно добыть. В этом тоже помогают азотная кислота и царская водка.
Ими обрабатывают руды, выводя нужные элементы в раствор. Остается осадить металлы и осушить, очистить от примесей. Так добывают не только благородные, но и неблагородные элементы.
Ее примешивают к топливу, получая оксид. Азотная кислота выступает в роли окислителя.
В его присутствии процесс сгорания эффективнее, выделяется больше тепла. Так что, часть реагента производят для ракетного топлива.
Все это соли, объединенные названием «селитры». Азот позволяет растениям быстро развиваться, повышает урожайность.
Чем больше освоенной энергии, тем лучше развитие трав, кустарников, деревьев.
Слово «селитра» на слуху и у пиротехников. Азотная кислота – основа взрывчатых веществ.
Цена азотной кислоты
Азотная кислота, как и большинство востребованных кислот, бывает чистой и технической, отягощенной примесями. Последняя дешевле.
Чистый реагент дороже. Для справки, ГОСТ 4461-77 – норма для очищенной кислоты.
Реагент российского производства стоит в районе 30-55-ти рублей за килограмм. Ценник зависит от концентрации раствора.
Для технической кислоты верхний ценовой предел, обычно, составляет 40 рублей за кило. Предусмотрена и большая фасовка.
Есть, к примеру, 25-литровые канистры, в которые разливается азотная кислота.
Купить реагент с максимальной выгодой позволяют оптовые заказы. Такие уходят на предприятия, где знают правила обращения с реагентом.
Он разъедает не только металлы, но и слизистые. Пары вещества могут затруднить дыхание, повредить трахеи, выстилающие ткани носа.
Поэтому, с кислотой работают лишь в масках. При нарушении правил, кроме трудностей с дыханием, наступает отравление.
Интоксикация выражается в рвоте, чесотке, нарушениях зрения, обоняния. Более-менее безобидны лишь слабые растворы реагента.
Именно такие, к примеру, используют в школьных лабораториях. Учиться обращению с химическими реагентами стоит с малых лет.
Азотная кислота. Получение и применение.
Автор: Tyorkin · Опубликовано 26 января, 2013 · Обновлено 7 июля, 2018
Современная химия — это наука, которая оперирует большим числом реагентов. Это могут быть соли, реагенты, щелочи. Но самая многочисленная группа — кислоты. Это сложные соединения, основанные на водороде. При этом, сторонние атомы здесь могут заменяться атомами металла. Используются кислоты в самых разных отраслях человеческой жизнедеятельности. К примеру, в медицине, пищевой промышленности, при производстве товаров бытового назначения. Именно поэтому следует особенно тщательно изучать данную группу реагентов.
Основные сведения об азотной кислоте
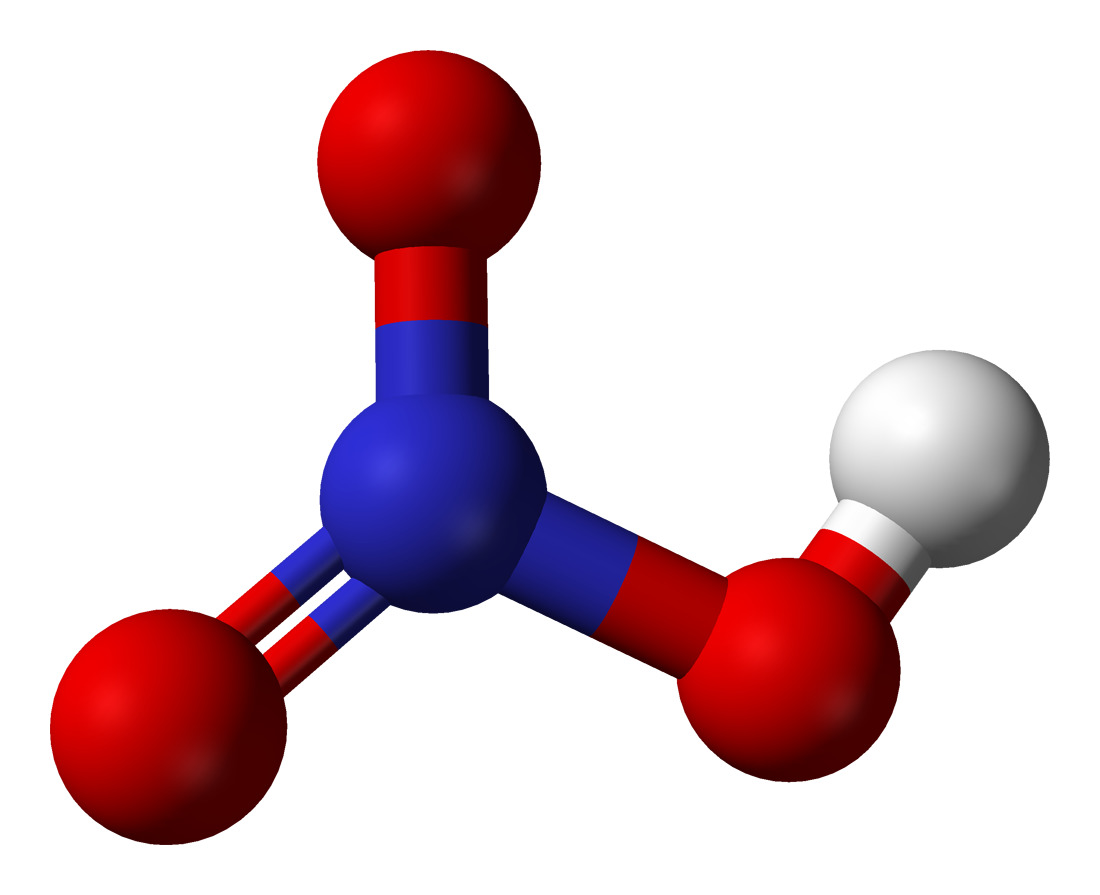
Это сильный реактив, который относится к разряду односоставных кислот. С виду это обычная прозрачная жидкость. Порой отмечается наличие желтоватого оттенка. Связано это с тем, что при теплой температуре на поверхности скапливается оксид азота. Диоксид азота также может проявиться в виде бурого осадка. Но происходит это под солнечными лучами. При любых контактах с воздухом кислота начинает сильно дымиться. Кроме того, нормально вступает в реакции с металлами. Отлично растворяется в воде, а вот в случае с эфиром есть ряд ограничений.
Процесс получения
Сегодня он не различается как в случае с сильной, так и слабой концентрацией. Его можно разделить на несколько этапов.
• Происходит кристаллическое окисление синтетика аммиака.
• Необходимо дождаться, когда образуются нитрозные газы.
• Вся вода, имевшаяся в составе, впитывается.
• На завершающем этапе необходимо дождаться, пока кислота достигнет необходимой концентрации.
Как происходит хранение и транспортировка?
Данный реагент не относится к разряду особо агрессивных. Поэтому и требований к хранению и транспортировке не так уж и много. Держать кислоту требуется в герметичных емкостях, выполненных из алюминия или же хромистой стали. Также подойдет лабораторное стекло. Что касается резервуаров, то на них должна быть пометка «Опасно». Это же касается и маленьких тар.
Меры предосторожности при использовании
Данный химический реактив относится к сильным кислотам. Он имеет III класс опасности. Те лица, которые допускаются к работе с данным веществом, должны пройти соответствующий инструктаж. В помещении необходимо находиться в специальной одежде. Она включает в себя комбинезон, рукавицы, респираторы, очки. Необходимы индивидуальные средства защиты органов дыхания и зрения. Последствия при несоблюдении требований безопасности могут быть серьезными. Если кислота попадет на кожу, то приведет к образованию ожогов и язв. Вдохнете ее? Тогда сильно отравитесь или даже получите отек легких. Так что в лабораториях необходимо организовывать постоянный контроль, просить сотрудников проходить инструктаж по мерам безопасности.
Где применяется азотная кислота?
Благодаря своим химическим свойствам, данная кислота применяется во многих отраслях. Отдельно следует выделить несколько. В первую очередь это промышленность. С помощью нее можно запросто синтезировать искусственное волокно. Кроме того, часто азотная кислота — это основной компонент при изготовлении моторного масла. Наверняка вы знаете, что она используется в металлургии. С помощью нее можно растворять и травить металлы. Существует специальная промышленная азотная кислота, которая лучше справляется с решением описанных задач.
Применение в быту
Из нее изготавливают средства, позволяющие эффективно очистить ювелирные украшения в домашних условиях. Но нужно быть крайне осторожным, не допускать контактов данных средств с кожей. При капельном поливе азотную кислоту можно применить в качестве очистителя. Концентрации в 60% будет достаточно для того, чтобы избавиться от солей или растворить осадок в капельной системе.
Каково применение в медицине?
Если вы посмотрите на состав некоторых медицинских средств, то увидите, что там содержится азотная кислота. К примеру, 30%-я используется для борьбы с бородавками. Также часто данный компонент добавляют в средства по борьбе с язвенными болезнями. Это отличный антисептик, обладающий вяжущими свойствами.
Использование в сельском хозяйстве
Агрономам необходимы минеральные удобрения для того, чтобы сделать урожай более богатым. В составе некоторых из них можно отыскать азотную кислоту. Но необходимо четко рассчитывать дозу для того, чтобы полученные овощи и фрукты не нанесли никакого вреда здоровью. Если кислоты будет слишком много, то в культурах будут скапливаться нитраты. Можно выделить несколько видов удобрений на основе кислоты: амидные, аммиачные, нитратные.
Но данный реагент имеет соли, которые в сельском хозяйстве используются даже чаще. Их добавляют в некоторые лекарственные препараты, которые дают животным.
Что можно сказать в заключении?
Как видите, азотная кислота — это очень важный компонент, применяющийся в огромном количестве отраслей. Без нее невозможно было бы представить современную жизнь. А химики на регулярной основе придумывают, где еще можно использовать данный реагент.
Азотная кислота [HNO3]: структура Льюиса / свойства / применение
Это очень агрессивное и токсичное вещество, которое может вызвать серьезные повреждения кожи при использовании без мер предосторожности. Кислота вступает в реакцию с оксидами, гидроксидами и металлами, такими как серебро, медь и железо, образуя нитратные соли.
Обычно азотная кислота, доступная в магазинах, представляет собой 68-процентный водный раствор. Когда ее концентрация (в воде) превышает 86 процентов, она называется дымящейся азотной кислотой. Она хранится в плотно закрытой емкости в сухом, прохладном и хорошо проветриваемом помещении.
Ниже мы рассмотрим, как производится эта кислота, как она выглядит в молекулярном масштабе, каковы ее химические и физические свойства и где она в основном используется.
Азотная кислота HNO3 свойства
Молярная масса: 63,012 г / моль
Внешний вид: Бесцветная или дымящаяся жидкость желто-красного цвета
Запах: неприятно горький или острый, удушающий
Структура
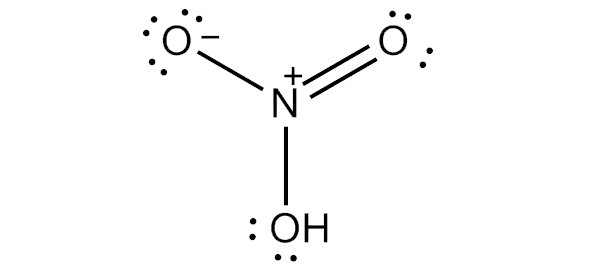
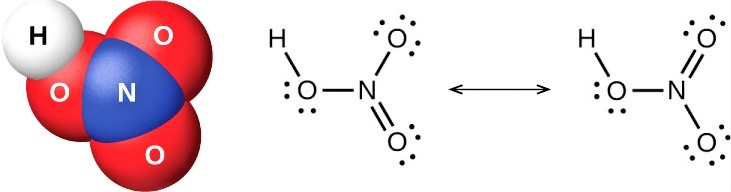
Поскольку кислород имеет большую тенденцию притягивать к себе общие электроны, чем азот, он несет отрицательный заряд, а атом азота несет положительный заряд.
Структура Льюиса
Чтобы нарисовать льюисовскую структуру азотной кислоты, нам нужно подсчитать общее количество валентных электронов в молекуле HNO3.
Это дает нам общее количество валентных электронов (5 + 1 + 18) в одной молекуле HNO3. Поскольку у азота больше валентных электронов, чем у кислорода, мы можем поместить атом азота в центр структуры.
Наконец, нам нужно минимизировать заряды на атомах, чтобы сделать структуру стабильной. Это может быть сделано путем преобразования одинокой пары на одном атоме кислорода в связь. Конечная структура состоит из двух одиночных связей между атомом азота и двумя атомами кислорода, а также двойной связи между атомом азота и оставшимся атомом кислорода.
Есть два правильных способа нарисовать структуру Льюиса HNO3. Таким образом, он имеет две основные формы резонанса. Двунаправленная стрелка на изображении выше указывает на то, что существует более одного способа нарисовать структуру азотной кислоты.
Как она производится?
Для производства HNO3 используются два метода. Первый использует окисление, конденсацию и абсорбцию для синтеза слабой HNO3 с концентрациями от 30 до 70 процентов. Второй метод производит сильную HNO3 (с концентрацией 90 процентов) из слабой HNO3 путем объединения процессов обезвоживания, отбеливания, конденсации и абсорбции.
Производство слабой азотной кислоты
Большая часть азотной кислоты образуется в результате высокотемпературного каталитического окисления аммиака. Это называется процессом Оствальда. Он состоит из трех этапов:
1) Окисление аммиака
Смесь аммиака и воздуха (1:9) окисляется до высокой температуры (750-800 ℃) при прохождении через каталитический преобразователь. Катализатор обычно изготавливается из 90% платины и 10% родиевой сетки. Эта (экзотермическая) реакция приводит к образованию оксида азота и воды в виде пара.
2) Окисление оксида азота
Окись азота, образовавшаяся в предыдущей реакции, окисляется: она некаталитически реагирует с остаточным кислородом с образованием диоксида азота. Это медленная, однородная реакция, которая сильно зависит от давления и температуры. При высоком давлении и низких температурах эта реакция приводит к образованию максимального количества диоксида азота за очень короткое время.
3) Поглощение
В конечной реакции оксид азота поглощается водой. Это дает желаемый продукт (азотную кислоту в разбавленной форме) вместе с оксидом азота. Концентрация HNO 3 зависит от давления, температуры, количества стадий абсорбции, а также от концентрации оксидов азота, поступающих в абсорбер.
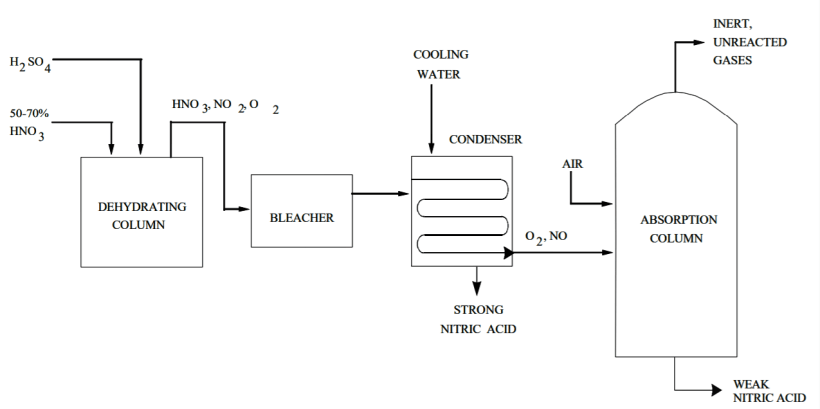
Производство сильной азотной кислоты
Высокопрочная HNO 3 получается путем концентрирования слабой HNO 3 экстрактивной дистилляцией. Дистилляция проводится в присутствии дегидратирующего агента, например 60% серной кислоты.
Процесс протекает следующим образом: сильная серная кислота и слабая азотная кислота попадают в насадочную дегидратирующую колонну при атмосферном давлении. Концентрированная HNO 3 выходит из верхней части колонны в виде 99% пара. Он также состоит из небольшого количества кислорода и оксида азота от диссоциации азотной кислоты.
Кислота проходит через отбеливатель и попадает в систему конденсатора, который отделяет ее от оксида азота и кислорода. Абсорбционная колонна забирает эти побочные продукты и объединяет оксид азота со вспомогательным воздухом для получения диоксида азота. Этот газообразный диоксид азота затем рекуперируется в виде слабой HNO 3, а небольшие непрореагировавшие и инертные газы выбрасываются в атмосферу.
Производство в лаборатории
В лаборатории HNO 3 обычно синтезируется путем термического разложения нитрата меди. Это дает оксид меди, диоксид азота и кислород. Последние два пропускаются через воду для получения азотной кислоты.
А затем реализовать процесс Оствальда
В последние пару десятилетий исследователи разработали электрохимические средства для получения безводной кислоты из концентрированного HNO 3. Этот процесс осуществляется путем регулирования тока электролиза до тех пор, пока не будут получены необходимые продукты.
Свойства
68% раствор HNO 3 имеет температуру кипения 120,5 °C при давлении 1 атм. С другой стороны, чистая HNO 3 кипит при 83 °C. При комнатной температуре эта концентрированная форма выглядит как бесцветная жидкость.
Поскольку азотная кислота имеет свойство разлагаться на открытом воздухе, ее хранят в стеклянных бутылках.
Оксиды азота, образующиеся в результате реакции разложения, полностью или частично растворяются в кислоте, вызывая незначительные изменения давления пара над жидкостью. Когда он остается растворенным, он дает кислотно-желтый цвет или красный при более высоких температурах.
Концентрированная азотная кислота выделяет белые пары при контакте с воздухом, в то время как кислота, растворенная в диоксиде азота, образует красновато-коричневые пары.
По концентрации сильную HNO 3 можно разделить на две группы: красная и белая дымящаяся азотная кислота. Первый содержит 84% азотной кислоты, 13% тетроксида диазота и 1-2% воды. Напротив, белая дымящаяся азотная кислота содержит не более 2% воды и очень небольшое количество растворенного диоксида азота (0,5%).
HNO3 с растворенным оксидом азота
Среди нескольких важных реакций HNO3 можно выделить следующие –
А так как это сильный окислитель, то он бурно реагирует с различными неметаллическими веществами. Продукты таких взрывных реакций зависят от температуры, концентрации кислоты и используемого восстановителя.
Области применения
Химические и физические свойства азотной кислоты делают ее ценным веществом. Она имеет несколько различных применений в различных областях, особенно в химической и фармацевтической промышленности.
Удобрения: Почти 80% производимой азотной кислоты используется для производства удобрений. Точнее, она используется для производства аммиачной селитры (NH 4 NO 3) и кальций-аммиачной селитры, которые находят применение в качестве удобрений.
Красители и пластмассы: Нитрат кальция и аммония используется в некоторых упаковках со льдом/гелем в качестве альтернативы аммиачной селитре. Она также используется для производства химикатов и растворов, которые используются в производстве красителей и пластмасс.
Ракетное топливо: красная и белая дымящаяся азотная кислота используется в жидкостных ракетах в качестве окислителя. Во время Второй мировой войны немецкие военные использовали дымящуюся красную азотную кислоту в нескольких ракетах.
Деревообработка: Очень слабая HNO3 (с концентрацией 10%) используется для искусственного старения древесины сосны и клена. Придает дереву винтажный вид с масляной отделкой.
Другие применения: слегка концентрированный раствор под названием Nital используется для травления металла, чтобы выявить его структуру на микроуровне. Рефлюксная азотная кислота используется в процессах очистки углеродных нанотрубок. В электрохимии HNO3 используется в качестве химического легирующего агента для органических полупроводников.
Вопросы и ответы
Проводит ли HNO3 электричество?
Как и другие сильные кислоты, азотная кислота является хорошим проводником электричества. Исследования показывают, что обработка материала этой кислотой может улучшить его электропроводность до 200 раз.
Растворяет ли HNO3 золото?
Азотная кислота не реагирует с некоторыми драгоценными металлами, такими как металлы платиновой группы и чистое золото. Однако она может растворять некоторые сплавы золота, содержащие менее благородные металлы, такие как серебро и медь. Цветное золото, например, растворяется в азотной кислоте и меняет цвет своей поверхности.
Хотя чистое золото не проявляет никакого эффекта при контакте с азотной кислотой, оно реагирует с царской водкой, смесью азотной и соляной кислот, оптимально в молярном соотношении 1:3. Некоторые ювелирные магазины используют азотную кислоту как дешевое средство для быстрого обнаружения сплавов с низким содержанием золота (менее 14 карат).
Как нейтрализуется HNO 3?
При более высоких концентрациях выделение азотной кислоты может быть весьма значительным, и поэтому необходима хорошая вентиляция. Ее можно нейтрализовать любым неорганическим основанием, например, гидроксидом натрия или известью.
Такие реакции нейтрализации выделяют много тепла. Например, нейтрализация 10% раствора азотной кислоты приведет к повышению температуры на 20 °C, а нейтрализация 70% раствора приведет к повышению температуры на 120 °C, что достаточно для того, чтобы вызвать паровые взрывы.