для чего нужна таблица растворимости
Как пользоваться таблицей растворимости в химии
Функции таблицы растворимости
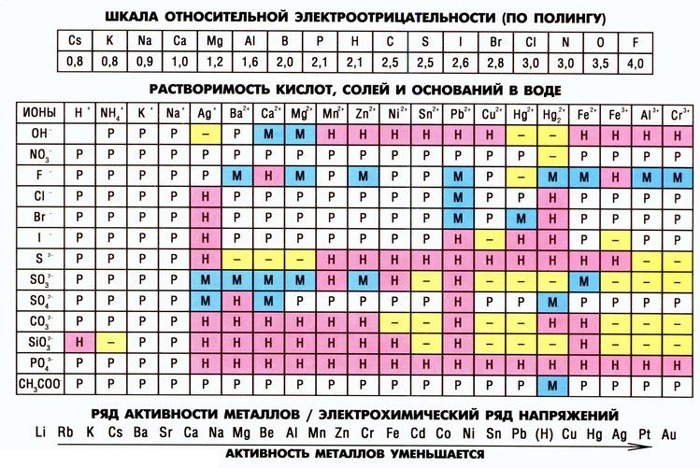
Таблица Менделеева — не единственный помощник в работе химика. Не менее важным инструментом для решения химических уравнений является таблица растворимости веществ. Прежде всего она помогает определить, растворяется ли вещество в воде. Если оно не растворяется, можно узнать каким будет осадок и решить ионное уравнение.
Растворимость веществ
Если вещество может образовать с другим однородное соединение, значит оно растворимо. Степень растворимости у всех веществ разная. В зависимости от этого все вещества делят на группы:
Каждое вещество имеет коэффициент растворимости, показывающий величину массы, которую оно может растворить. На растворение зачастую влияет температура и давление, при которых происходит реакция.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Полная таблица растворимости
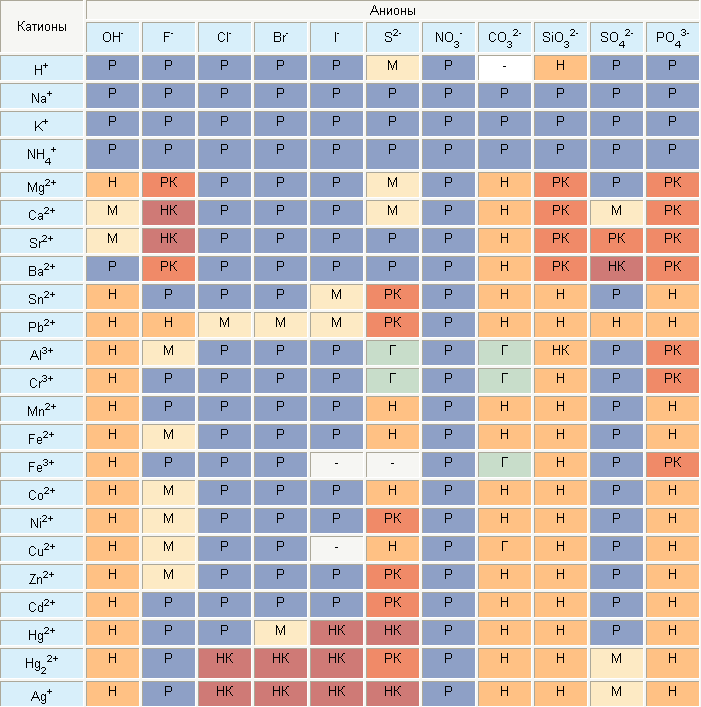
В школьном курсе химии используется упрощенная таблица растворимости. Для более высокого уровня изучения или работы необходима полная, где приводятся данные о большем количестве реакций и включено больше химических элементов и соединений.
Школьная таблица растворимости
Полная таблица растворимости
Условные обозначения
В таблице указаны названия химических элементов и соединений, а также условные обозначения, говорящие о степени растворимости. Часть обозначений действительна и для школьной. В полной таблице учтена способность веществ растворяться в кислотах.
Как применять таблицу
Растворимость
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20 o С:
Растворимость, г на 100 г H2O
Растворимость, г на 100 г H2O
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20 o С растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
«Прочерк» и «вопрос» в таблице растворимости.
При подготовке к ЕГЭ, а также на уроках химии в школе периодически приходится пользоваться таблицей растворимости. Помимо привычных и понятных обозначений «Р», «Н», «М», там также можно увидеть знаки вопроса и прочерки. Когда ученик встречает такие отметки в таблице, то у него часто возникает непонимание. Что это значит? Почему не смогли такое вещество получить? Если уж они не знают, то куда мне до этого? А еще часто встречается крайне вредное и ошибочное утверждение: если в ходе реакции получился продукт «с вопросом или прочерком», то такая реакция не идет. Идет! Но давайте по порядку.
Основных причин отметок для вещества «?» или «-», по сути, две:
1) протекание окислительно-восстановительной реакции между катионом и анионом;
2) необратимый гидролиз соединения в водном растворе.
К первому случаю в рамках ЕГЭ можно отнести, как минимум, три соединения: йодид меди (II), йодид железа (III), сульфид железа (III). При попытке их получить по обменной реакции будет протекать ОВР:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
Все эти реакции идут, однако ожидаемых CuI2, FeI3 и Fe2S3 там не получается в силу протекания окислительно-восстановительной реакции. Атом металла снижает свою степень окисления на единицу.
Второй случай встречается даже более часто и охватывает реакции, сопровождающиеся гидролизом продукта. В рамках ЕГЭ типичными примерами являются карбонат алюминия, сульфид алюминия и хрома (III), карбонат железа (III). При попытке получить такие вещества по обменной реакции в растворе будет наблюдаться взаимное усиление гидролиза:
Снова наблюдаем, что реакции вполне себе идут, однако ожидаемых Al2(CO3)3, Cr2S3, Al2S3, Fe2(CO3)3 не образуется. Вместо них получатся соответствующие по степени окисления гидроксиды металлов.
Стоит отметить, что сульфиды алюминия и хрома (III) существуют в твердом состоянии, их можно получить при сплавлении простых веществ. Однако, они тоже реагируют с водой, гидролизуются необратимо:
Таким образом мы видим, что бояться вопроса или прочерка для вещества в таблице растворимости не нужно. Реакция с гипотетическим образованием такого продукта точно идет. Но не стоит писать его формулу в продуктах, а нужно вспомнить сообразно реагентам, что там будет происходить: ОВР или гидролиз.