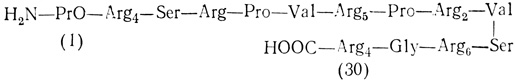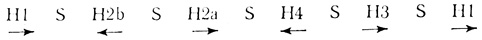для чего нужны белки гистоны
Гистоны
Гистоны — основной класс нуклеопротеинов, ядерных белков, необходимых для сборки и упаковки нитей ДНК в хромосомы. Существует пять различных типов гистонов, названных H1/Н5, H2A, H2B, H3, H4. Последовательность аминокислот в этих белках практически не различается в организмах различного уровня организации. Гистоны — небольшие, сильно основные белки, связывающиеся непосредственно с ДНК. Гистоны принимают участие в структурной организации хроматина, нейтрализуя за счёт положительных зарядов аминокислотных остатков отрицательно заряженные фосфатные группы ДНК, что делает возможной плотную упаковку ДНК в ядре.
Благодаря этому 46 молекул ДНК диплоидного генома человека общей длиной около 2 м, содержащих в сумме 6·10 9 пар оснований (п.о.), могут поместиться в клеточном ядре диаметром всего 10 мкм.
По две молекулы каждого из гистонов Н2А, Н2В, Н3 и Н4 составляют октамер, обвитый сегментом ДНК длиной 146 п.о., образующим 1,8 витка спирали поверх белковой структуры. Эта частица диаметром 7 нм называется нуклеосомой. Участок ДНК (линкерная ДНК), непосредственно не контактирующий с гистоновым октамером, взаимодействует с гистоном Н1.
Группа негистоновых белков высоко гетерогенна и включает структурные ядерные белки, множество ферментов и факторов транскрипции, связанных с определёнными участками ДНК и осуществляющих регуляцию генной экспрессии и других процессов.
Гистоновые белки интересны со многих точек зрения. Благодаря высокому содержанию лизина и аргинина они, как уже упоминалось, проявляют сильно основные свойства. Кроме того, последовательность аминокислот гистонов, то есть их первичная структура, мало изменилась в процессе эволюции. Это хорошо видно при сравнении аминокислотной последовательности гистонов млекопитающих, растений и дрожжей. Так, Н4 человека и пшеницы отличаются лишь несколькими аминокислотами. К тому же размер молекулы белка и её полярность довольно постоянны. Из этого можно заключить, что гистоны были оптимизированы ещё в эпоху общего предшественника животных, растений и грибов (более 700 млн лет назад). Хотя с тех пор в гистоновых генах происходили бесчисленные точковые мутации, все они, очевидно, приводили к вымиранию мутантных организмов.
Гистоны в октамере имеют подвижный N-концевой фрагмент («хвост») из 20 аминокислот, который выступает из нуклеосом и важен для поддержания структуры хроматина и контроля за генной экспрессией. Так, например, формирование (конденсация) хромосом связано с фосфорилированием гистонов, а усиление транскрипции — с ацетилированием в них остатков лизина. Детали механизма регуляции до конца не выяснены.
Некоторые детали механизма регуляции смотри: Белки группы polycomb
Гистоны: характеристика, строение, виды и функции
Содержание:
В гистоны являются основными белками, которые взаимодействуют с ДНК для образования нуклеосом, составляющих нити хроматина, из которых состоят хромосомы у эукариотических организмов.
Нуклеосомы, комплексы, состоящие из ДНК и белков, были открыты в 1974 году, и именно гистоны собирают этот базальный уровень организации хроматина. Однако о существовании гистоновых белков было известно еще до 1960-х годов.
Гистоны организованы таким образом, что двухполосная ДНК обвивает белковый центр, состоящий из этих белков, которые тесно взаимодействуют друг с другом. Гистоновый центр имеет форму диска, а ДНК повторяется в 1,7 раза.
Множественные водородные связи позволяют ДНК связываться с белковым центром, образованным гистонами в каждой нуклеосоме. Эти связи образуются по большей части между аминокислотными скелетами гистонов и сахарно-фосфатным скелетом ДНК. Также участвуют некоторые гидрофобные взаимодействия и ионные связи.
Белки, известные как «комплексы ремоделирования хроматина», ответственны за разрыв и образование соединений между ДНК и гистонами, позволяя транскрипционному аппарату проникать в ДНК, содержащуюся в нуклеосомах.
Гистоны могут подвергаться различным модификациям, которые генерируют множество вариантов, что делает возможным существование множества различных форм хроматина, которые обладают свойством модулировать экспрессию генов различными способами.
характеристики
Они являются одними из наиболее консервативных эукариотических белков в природе. Например, было показано, что гистон H4 гороха отличается только двумя из 102 положений аминокислот белка H4 коровы.
Во время сборки нуклеосом сначала образуются специфические димеры H3-H4 и H2A-H2B. Затем два димера H3-H4 соединяются вместе с образованием тетрамеров, которые позже объединяются с димерами H2A-H2B, образуя октамерный центр.
Все гистоны синтезируются в основном во время S-фазы клеточного цикла, а нуклеосомы собираются в зарождающихся спиралях ДНК сразу после репликационной вилки.
Состав
Общая структура гистонов включает область основной аминокислоты и область глобулярного карбоксила, высоко консервативную среди эукариотических организмов.
Структурный мотив, известный как «гистоновая складка», состоящий из трех альфа-спиралей, соединенных двумя шпильками и образующих небольшой гидрофобный центр, отвечает за белок-белковые взаимодействия между гистонами, составляющими нуклеосому.
Именно эта складка гистонов составляет глобулярный карбоксильный домен этих нуклеосомных белков у всех эукариот.
Гистоны также имеют небольшие аминоконцевые и другие карбоксиконцевые «хвосты» или участки (доступные для протеаз) длиной не более 40 аминокислот. Обе области богаты основными аминокислотами, которые могут подвергаться множественным посттрансляционным ковалентным модификациям.
Связывание гистонов
У эукариот есть два семейства связывающих гистонов, отличающихся друг от друга своей структурой. Некоторые из них имеют трехчастную структуру с описанным выше глобулярным доменом, фланкированным «неструктурированными» N- и C-концевыми доменами; в то время как другие имеют только C-концевой домен.
Хотя большинство гистонов консервативны, специфические варианты могут возникать во время эмбриогенеза или созревания специализированных клеток у некоторых организмов. Некоторые структурные вариации связаны с посттрансляционными модификациями, например следующие:
–Фосфорилирование: Считается, что это связано с изменением степени конденсации хроматина и обычно встречается в остатках серина.
–Ацетилирование: связаны с транскрипционно активными участками хромосом. Обычно это происходит на боковых цепях остатков лизина. Когда это происходит на этих остатках, их положительный заряд уменьшается, тем самым уменьшая сродство белков к ДНК.
–Метилирование: это может происходить как моно-, ди- или триметилирование остатков лизина, которые выступают из ядра белка.
За эти ковалентные модификации гистонов отвечают определенные ферменты. Эти ферменты включают гистонацетилтрансферазы (HAT), гистоновые деацетилазные комплексы (HDAC) и гистоновые метилтрансферазы и деметилазы.
Типы
Характеристика гистонов была проведена с помощью различных биохимических методов, среди которых выделяются хроматографии, основанные на слабых катионообменных смолах.
Некоторые авторы устанавливают форму классификации, в которой различают 5 основных типов гистонов у эукариот: FI с белками 21 кДа; F2A1 или FIV плюс-минус 11,3 кДа; F2A2 или FIIbI, 14,5 кДа; F2B или FIIb2 с молекулярной массой 13,7 кДа и F3 или FIII с 15,3 кДа.
Все эти типы гистонов, за исключением группы IF, обнаруживаются в клетках в эквимолярных количествах.
Другая классификация, с такой же достоверностью и, возможно, наиболее широко используемая сегодня, предполагает существование двух разных типов гистонов, а именно: тех, которые являются частью октамера нуклеосомы, и связывающих или мостиковых гистонов, которые соединяют нуклеосомы между да.
Некоторые варианты также могут встречаться между видами, и в отличие от гистонов ядра, варианты синтезируются во время интерфазы и вставляются в предварительно сформированный хроматин посредством процесса, зависящего от энергии, высвобождаемой при гидролизе АТФ.
Нуклеосомные гистоны
Центр нуклеосомы состоит из пары каждого из четырех составляющих гистонов: H2a, H2b, H3 и H4; на котором намотаны сегменты ДНК примерно из 145 пар оснований.
Гистоны H4 и H2B в принципе инвариантны. Однако очевидны некоторые вариации в гистонах H3 и H2A, биофизические и биохимические свойства которых изменяют нормальную природу нуклеосомы.
Вариант гистона H2A у человека, белок H2A.Z обладает большой кислотной областью и может способствовать стабильности нуклеосом в зависимости от вариантов гистона H3, с которыми он связан.
Эти гистоны демонстрируют некоторую вариабельность между видами, особым случаем является гистон H2B, для которого первая треть молекулы сильно вариабельна.
Связывание гистонов
Связывающие или мостиковые гистоны представляют собой гистоны класса H1. Они несут ответственность за объединение нуклеосом и защиту ДНК, которая выступает в начале и в конце каждой частицы.
В отличие от нуклеосомных гистонов, не все гистоны H1-типа обладают глобулярной областью гистоновой «складки». Эти белки связываются с ДНК между нуклеосомами, облегчая смещение баланса хроматина в сторону более конденсированного и менее активного состояния, говоря транскрипционно.
Исследования связывают эти гистоны со старением, репарацией ДНК и процессами апоптоза, поэтому считается, что они играют решающую роль в поддержании целостности генома.
Характеристики
Все аминокислотные остатки гистонов тем или иным образом участвуют в их взаимодействии с ДНК, что объясняет тот факт, что они столь консервативны среди царств эукариотических организмов.
Участие гистонов в упаковке ДНК в хроматиновой форме имеет большое значение для сложных многоклеточных организмов, в которых различные клеточные линии могут специализироваться только за счет изменения доступности их генов для транскрипционного аппарата.
Транскрипционно активные области генома плотно расположены в нуклеосомах, что позволяет предположить, что ассоциация ДНК с гистоновыми белками имеет решающее значение для отрицательной или положительной регуляции их транскрипции.
Аналогичным образом, на протяжении всей жизни клетки ответ на большое количество стимулов, как внутренних, так и внешних, зависит от небольших изменений хроматина, которые обычно связаны с ремоделированием и посттрансляционной модификацией гистонов, обнаруженных в тесная связь с ДНК.
Множественные гистоновые переменные выполняют разные функции у эукариот. Один из них связан с участием варианта гистона H3 в формировании центромерных структур, ответственных за сегрегацию хромосом во время митоза.
Аналог этого белка у других эукариот, как было показано, важен для сборки кинетохоры белка, с которой микротрубочки веретена связываются во время митоза и мейоза.
Гистоны
| Гистона | Молекулярная масса | Количество аминокислотных остатков | Содержание основных аминокислот (% от общего количества аминокислот) | |
|---|---|---|---|---|
| Лизин | Аргинин | |||
| H1 * | 21130 | 223 | 29,5 | 11,3 |
| H2A * | 13960 | 129 | 10,9 | 19,3 |
| H2B * | 13774 | 125 | 16,0 | 16,4 |
| H3 | 15273 | 135 | 19,6 | 13,3 |
| H4 | 11236 | 102 | 10,8 | 13,7 |
| Размеры несколько различны в зависимости от вида, данные приведены для бычьих белков |
Гистоны — основной класс белков, необходимых для упаковки молекул ДНК в хроматин. Гистоны имеют небольшую молекулярную массу (от 11 до 21 кДа) и очень богатые основные аминокислоты (аргинин и лизин), благодаря чему взаимодействие между гистонами и ДНК стабилизируется ионными связями. Для всех гистонов характерно наличие общего структурного мотива, представленного тремя α-спиралями, объединенными двумя петлями. В большинстве клеток масса гистонов примерно равна массе ДНК, а их количество составляет около 60 млн. В эукариот гистоны локализуются в клеточном ядре, в архей типа Euarchaeota — в цитоплазме. В компактизации ДНК остальных архей и бактерий могут принимать гистоноподибни белки, однако настоящих гистонов у них нет.
Белки-гистоны были открыты 1884 Альбрехтом Косселем в экстрактах ядер эритроцитов птиц. К сороковым годам XX века многие исследователи считали именно их носителями наследственной информации.
Существует пять различных типов гистонов, а именно H1, H2A, H2B, H3 и H4. Последовательность аминокислот в этих белках мало отличается среди эукариот различного уровня организации. Наиболее консервативной она у гистонов H3 и H4: так с гистоны H4 коровы и горошка отличаются только двумя из 102 аминокислотных остатков, а человека и дрожжей — восьмая, несколько больше различаются между видами эукариот последовательности гистонов H1, H2A и H2B. Такая консервативность их структуры свидетельствует об исключительной важности для организма, а также о том, что почти каждый аминокислотный остаток в составе этих белки функционально важным. Эта гипотеза была проверена на клетках дрожжей, путем замены нормальных генов гистонов на мутировавшие. Выяснилось, что большинство изменений в аминокислотной последовательности гистонов является летальной, а и небольшая доля мутаций, не были смертельными, одинаково приводили к серьезным нарушениям экспрессии генов и других аномалий.
Гистоны не только обеспечивают упаковки ДНК, но и играют важную роль в регуляции экспрессии генов, перестройке хроматина и тому подобное. Каждый из них может быть субстратом для различных модификаций: метилирования, ацетилирования, АДФ-рибозилирования, фосфорилирования, гликозилирования, убиквитинування, сумолювання. Поскольку эти изменения влияют на заряд и форму гистонов, то приводят к изменению структуры хроматина. Кроме того существуют варианты некоторых гистонов, которые играют особую роль в метаболизме ДНК.
Варианты белков гистонов
Кроме пяти «канонических» гистонов, существуют также минорные формы, является видоизменениями первых. Таких вариантов было больше выявлено для гистонов H2A и H3. Гены этих белков экспрессируются в течение всего клеточного цикла, и встраиваются в хроматин независимо от процесса репликации. Для этого нужны специальные гистоновые шапероны и комплексы ремоделирования хроматина. Варианты гистонов могут замещать блики недостающие в нуклеосомами, или встраиваться в специфические участки генома. Большинство из них, как и канонические формы, является эволюционно консервативными, что указывает на незаменимую роль в жизнедеятельности клеток. Однако некоторые варианты, например H2A-Bdb-образные гистоны, быстро эволюционируют и выполняют тканино- а также клетки-специфические функции в яичках и мозга.
Примеры некоторых вариантов гистонов
| Гистона H2A.Z |
| Гистона H2A.Z найден во многих эукариот. Ассоциированный в основном из транскрипционно активными участками. Его функции до конца не выяснены, вероятно, что он участвует в установлении и поддержании структуры промотора, благоприятной для присоединения РНК-полимеразы II. Также существуют данные о том, что наличие этого варианта гистонов в нуклеосомами препятствует их взаимодействия друг с другом, таким образом способствуя более открытом состояния хроматина. |
| Гистона H2A.X |
| Гистона H2A.X связан с репапрациею и рекомбинацией ДНК. Недостаток этого белка у мышей влечет генетическую нестабильность и мужском бесплодии. Небольшие количества нуклеосом, содержащих H2AX, разбросанные по всему геному; если поблизости такой нуклеосомы происходит двухниточный разрыв ДНК, H2AX фосфорилируется по остатку Ser 139, который расположен в SQ-мотиве на C-конце. Последнее событие необходима для сбора аппарата репарации в этом месте |
| Гистона MacroH2A |
| Гистона MacroH2A является вариантом H2A, что является специфическим только для позвоночных животных. Месит большой «макродомен» на C-конце. Участвует в инактивации X-хромосомы в гомогаметным пола. |
| Гистона H2A.Bdb |
| Гистона H2A.Bdb — вариант, имеющийся только у человека, експресуюеться в яичках и головном мозге. Функции H2A.Bdb не выяснены. |
| Гистона H2A.Lap1 |
| Гистона H2A.Lap1 — это мышиная изоформа H2A.Bdb, экспрессируется в тех же органах. Известна роль этого варианта в пространственной и временной активации генов, специфичных для ткани яичек. |
| Гистона H3.3 |
| Гистона H3.3 — вариант гистона H3 и замещает его в транскрипционно активных участках. |
| Гистона CenH3 |
| Гистона CenH3 — вариант гистона H3, имеющийся в участках центромер. CenH3 — общее название, обозначающее белки Cse4 у дрожжей, CENPA у людей и мышей, Cid у дрозофилы и тому подобное. Этот гистона необходим для сбора кинетохор, к которым крепятся нити веретена деления. |
Гены гистонов
Однако другие гистоновые варианты, как MacroH2A, экспрессируются независимо от цикла клетки и имеют стандартную мРНК.
Модификации белков-гистонов
«Хвосты» гистонов, то есть их N-концевые последовательности, выступающие наружу нуклеосомы, могут быть местами различных посттрансляционным модификаций (ПТМ) — присоединение определенных химических групп, таких как метильная, ацетильных, фосфатный, гликозильна, АДФ-рибозильна, а также белков убиквитина и SUMO. Эти изменения являются обратимыми, они осуществляются специфическими строго регулируемыми ферментами и имеют сложные биологические последствия, зависят не только от химической группы, присоединяется, но и от ее положения и общего контекста. Для гистонов были открыты фактические все возможные ПТМ белков, и открытие новых сайтов модификации продолжается, однако биологическое значение не всех этих изменений доказано.
Для чего нужны белки гистоны
Гистоны
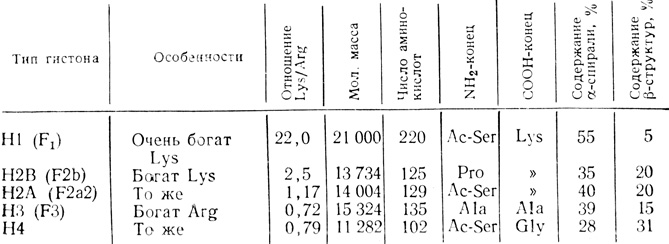
Таблица 2.1. Параметры гистонов из тимуса теленка
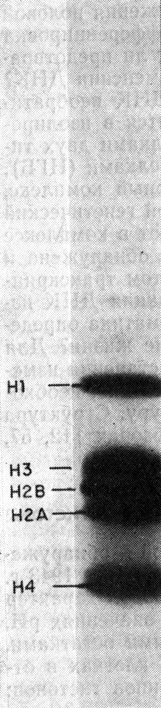
Рис. 2.1. Электрофореграмма гистонов в полиакриламидном геле
Важное свойство всех гистонов состоит в том, что их положительно заряженные лизиновые и аргининовые остатки образуют кластеры в особых областях полипептидной цепи. Этим и объясняется наличие во вторичной структуре гистонов вытянутых β-структур. Очевидно, эти положительно заряженные β-структуры связываются с отрицательно заряженными фосфатными группами ДНК сильнее, чем с другими группами. Нейтрализация положительных зарядов в гистонах должна приводить к их отделению от ДНК. Из табл. 2.1 видно, что гистоны H2A, H2B, Н3 и Н4, находящиеся внутри нуклеосом, имеют больше вытянутых β-структур, чем гистон Н1, расположенный между нуклеосомами.
Прокариоты не имеют гистонов. Появление гистонов совпало с возникновением ясно выраженных ядер, хромосом и процесса дифференцировки. Гистоны подавляют синтез РНК [167] и ДНК [142] in vitro. При полном или частичном удалении гистонов из хроматина сильно увеличивается его матричная активность. Однако маловероятно, чтобы гистоны контролировали или регулировали транскрипцию генов, так как: а) имеется только пять основных видов гистонов, тогда как геном эукариотов содержит несколько тысяч генов; б) количество гистонов обычно постоянно в клетках всех типов и во всех периодах жизни; в) количество гистонов одинаково в метаболически активных и метаболически неактивных клетках. Следовательно, можно предположить, что гистоны включены в структуру и организацию хроматина и действуют как общие репрессоры его активности.
Гистон Н1
При изучении последовательности аминокислот подфракций гистона Н1 было показано, что в отличие от остальных четырех гистонов он имеет основной концевой COOH-участок. Концевая NH2-область (1-40) также имеет основной характер (24-39). В концевой NH2-области изогистонов Н1 найдено большое число аминокислотных замен. Эти замены, по-видимому, определяют функциональные различия изогистонов Н1 во взаимодействии с НГБ и эффекторами, а также в связывании с ДНК. Концевая NH2-область представляет собой неупорядоченную спираль. Центральный участок [(39±4)-(116±4)] кроме большого числа аминокислот кислотного характера и двух ароматических аминокислот содержит неполярные аминокислоты. Этот участок способен к образованию вторичной глобулярной структуры. Он в основном инвариантен и весьма консервативен, т. е. все гистоны Н1 различных организмов имеют в этой области практически одну и ту же последовательность аминокислот. По-видимому, она играет существенную роль в структуре хроматина.
Концевая COOH-область является сильно основной из-за наличия большого числа лизиновых остатков и весьма консервативна внутри одного вида. Поэтому она может играть общую роль во всех гистонах Н1. Она также представляет собой неупорядоченную спираль. Эта область в основном ответственна за связывание с ДНК. Предполагают, что основные области гистона Н1 связываются с ДНК, а неполярная и глобулярная центральная область взаимодействует с другими молекулами [77, 89, 154]. Стафилококковая дезоксирибонуклеаза специфически расщепляет хроматин между нуклеосомами, в результате чего образуются фрагменты ДНК, связывающие две соседние нуклеосомы. Показано, что гистон Н1 соединяется приблизительно с 30-60 парами оснований этих фрагментов ДНК, т. е., по-видимому, гистон Н1 не участвует в образовании структуры нуклеосомы, а располагается в областях между нуклеосомами. Положительный заряд гистона Н1 выше, чем у других гистонов. Он первым вытесняется из хроматина кислотой или щелочью и в большей степени подвержен разрушению протеазами, когда еще находится в связанном состоянии в комплексе хроматина [26, 263]. Если гистон Н1 добавить к хроматину с недостаточным содержанием этого гистона, то хроматин сжимается [46, 47]. Если же гистон Н1 смешать с двухцепочечной ДНК, то образуются структуры, имеющие форму бублика (тора) [166]; другие гистоны в подобных условиях участвуют в образовании глобул, похожих на нуклеосомы. Таким образом, гистон Н1, вероятно, участвует в образовании структур хроматина высшего порядка, а именно способствует закручиванию нитей нуклеосом в сверхспиральный виток с диаметром
20 нм [47]. Аналогичные структуры образует с ДНК гистон Н5. Вероятно, различные подфракции гистона Н1 могут быть связаны с различными межнуклеосомными (линкерными) областями хроматина и участвуют в образовании разных сверхспиралей. В интерфазном хроматине ДНК свернута в несколько тысяч раз, благодаря чему она умещается по длине метафазной хромосомы. Определенную роль в этой конденсации ДНК может играть гистон Н1.
Гистон Н1 отличается от остальных гистонов быстрым обменом в культуре клеток [16]. В то время как синтез остальных четырех гистонов связан с синтезом ДНК и происходит только в S-фазе, синтез Н1 в клетках штаммов Friend и HeLa может происходить и в отсутствие синтеза ДНК, т. е. в G1-фазе [385]. В клетках ВНК синтез гистона Н1 также частично происходит в G1-фазе,[343].
Таблица 2.2. Сравнение свойств гистона Н1 и нуклеосомных гистонов
Гистоны Н2А, Н2В, Н3 и Н4
Гистон Н5
Кроме гистонов пяти типов, которые присутствуют во всех клетках и тканях, имеющие ядро эритроциты низших позвоночных, рыб, амфибий, рептилий и птиц содержат другой гистон, Н5, который во многом похож на гистон Н1. Он был впервые обнаружен в эритроцитах цыпленка в 1961 г. [266], и позднее его существование было подтверждено [159]. Гистон Н5 содержит приблизительно 197 аминокислотных остатков, дает полосу рядом с гистоном Н1 при электрофорезе в полиакриламидном геле и имеет молекулярную массу
23000. Ему свойствен молекулярный полиморфизм, а расположен он между нуклеосомами. Гистон Н5 связан с А-Т-областью ДНК и, так же как гистон Н1, оказывает стабилизирующее влияние на хроматин. Он тоже богат лизином, который составляет 23% его аминокислотных остатков. С помощью метода ЯМР установлено, однако, что он отличается от гистона Н1, и, возможно, его эволюция происходила самостоятельно [78]. Лизиновые остатки гистона Н5 ацетилированы в большей степени, чем у гистона Н1, но не так сильно фосфорилированы. Он содержит большое число сериновых остатков (21), и у него, в отличие от гистона Н1, не наблюдается специфического образования кластеров из основных аминокислот на NH2-конце. В противоположность гистону Н1 его NH2-конец имеет структуру глобулы.
Протамины
45 аминокислот. Они богаты аргинином и не содержат лизина и триптофана; аргинин составляет две трети всех аминокислот. Собирающиеся в кластеры аргининовые остатки образуют длинные участки, с помощью которых протамины связываются с ДНК сперматид. После образования этой связи транскрипционная активность хроматина полностью подавляется. Если удалить протамины, то хроматин принимает вид бусинок и становится чувствительным к микрококковой нуклеазе. При добавлении протаминов эта структура исчезает и хроматин становится невосприимчивым к нуклеазе. Сериновые остатки протаминов могут быть фосфорилированы и дефосфорилированы. Полагают, что эта ковалентная модификация необходима для правильного связывания протаминов с ДНК [105], Ниже показана структура типичного протамина рыб:
Протамины, как и гистоны, синтезируются в цитоплазме. Их короткие мРНК транслируются на дирибосомах. Эти РНК в отличие от мРНК гистонов содержат на 3′-конце полиадениловую кислоту [169]. На 5′-конце они имеют 7-метилгуанин. Хотя в семенниках форели протамины синтезируются на стадии сперматиды, транскрипция их мРНК происходит значительно раньше, а именно на стадии первичного сперматоцита [170]. мРНК так же, как и рибонуклеопротеидные частицы, до наступления стадии сперматиды остается неактивной. Аналогичная ситуация наблюдается и в случае гистонов. Ооциты Xenopus содержат мРНК материнских гистонов в неактивной форме, которые активируются и транслируются во время деления яйца. Протамины содержатся только в сперматоцитах, однако неизвестно, почему экспрессия их генов происходит только в этих клетках и как она начинается на соответствующей стадии развития этих клеток.
Гены гистонов
В исследованиях на Drosophila показано, что гены гистонов расположены в хромосоме II. Пять структурных генов пяти гистонов богаты парами G-C и тандемно повторяются. Они разделены участками, богатыми парами А-Т, которые не транслируются. Вся область кодирования генов гистона содержит 6000-7000 пар оснований ДНК. Ниже показаны расположение и длина генов в яйце морского ежа вместе со спейсерными участками (S) [39].
Структурные гены гистонов не содержат интронов, или нетранслируемых областей, как гены глобина, яичного альбумина и иммуноглобулина, а также не транскрибируются как более длинные предшественники РНК [312]. Спейсерные области не имеют небольших повторяющихся последовательностей оснований, как это наблюдается у генов рРНК и 5S-PHK. У всех видов морских ежей порядок расположения и направления транскрипции гистоновых генов одинаковы, тогда как у разных видов Drosophila они различны [230]:
Синтез и обновление гистонов
Гены гистонов транскрибируются в направлении 5′→3′ с помощью РНК-полимеразы II, так как процесс транскрипции чувствителен к α-аманитину [225]. По-видимому, мРНК пяти гистонов транскрибируются отдельно, а не как единая полицистронная мРНК [205]. Они имеют коэффициент седиментации приблизительно 9S и могут быть разделены в полиакриламидном геле [187]. На 3′-конце мРНК гистонов нет полиадениловой кислоты [5], а на их 5′-конце присутствуют последовательности m 7 G(5′)pppN m или m 7 G(5′)pppN m pN [260].
Синтез гистонов тесно связан с синтезом ДНК. мРНК гистонов синтезируются в начале S-фазы, а затем переходят в цитоплазму, где они соединяются с рибосомами для синтеза гистонов [293, 303, 310, 331]. мРНК гистонов существуют приблизительно столько же времени, сколько длится S-период, т. е. 10-12 ч. Есть сообщение, что для транскрипции мРНК гистонов необходимы фосфорилированные НГБ [194], но оно требует подтверждения.
Если синтез ДНК затормозить с помощью цитозинарабинозида или оксимочевины, то синтез мРНК гистонов также прекращается, уже образовавшиеся мРНК разрушаются и синтез гистонов останавливается. Как только это происходит, прекращается также синтез ДНК [188, 366, 379]. Таким образом, клетка обладает механизмом, «включающим» и «выключающим» гены гистонов в соответствии с синтезом ДНК. Стехиометрическое соотношение синтезированных гистонов Н1:Н2А:Н2В:Н3:Н4 равно 0,5:1:1:1:1. Это свидетельствует о том, что четыре гена нуклеосомных гистонов транскрипционно связаны, и их трансскрипция, вероятно, скоординирована. По-видимому, матрица для гистона Н1 не связана с другими генами, поскольку количество синтезированного гистона Н1 составляет только половину количества других гистонов. У Drosophila, расположение гистоновых генов у которой отличается от расположения генов у морского ежа, ген гистона Н1 отделен от гена гистона Н3 1200 парами оснований ДНК. Следовательно, он может иметь самостоятельный промотор [230]. Более того, синтез гистона Н1 в фазе G1 в три раза интенсивнее синтеза других гистонов [343].
Судьба четырех нуклеосомных гистонов в процессе деления клетки изучалась с помощью 3 Н-лизина и других меченых аминокислот [220]. На примере культуры in vitro миобластов цыпленка показано, что, когда клетка делится, уже существовавшие нуклеосомные гистоны остаются в одной из дочерних клеток, а вновь синтезированные гистоны переходят в другую клетку. Таким образом, новые гистоны, по-видимому, не смешиваются со старыми, и какое-то время их состав сохраняется неизменным. Последовательно синтезирующиеся нуклеосомы располагаются в основном рядом друг с другом. Более того, гистоны в них существуют в неизменном виде в течение трех-четырех поколений. Каким образом это достигается, неизвестно. По-видимому, существует механизм, с помощью которого дифференцированное состояние материнской клетки может передаваться дочерним. В работе с использованием 3 Н-аргинина и 125 I-иоддезоксиуридина в культуральной среде, содержащей клетки мыши [153], было показано, что нуклеосомные гистоны сохраняются в течение многих поколений. Этот факт очень важен, так как ново-синтезированные гистоны связаны с новообразованной ДНК [353]. Высказано предположение, что некоторые НГБ также сохраняются в процессе деления клетки [122]. Такая консервация нуклеосом и НГБ вместе с последующей транскрипционной специфичностью может служить тем механизмом, с помощью которого достигается и сохраняется дифференцировка клетки. Гистон Н1, однако, в течение одного клеточного поколения обновляется на 15% [141]. Кроме того, он интенсивно фосфорилируется в конце фазы G2 клеточного цикла, что совпадает по времени с конденсацией хромосомы [48]. Быть может, фосфорилирование является пусковым механизмом митоза.