для чего нужны качественные реакции в химии
Качественные реакции
Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны. Качественный анализ в водных растворах основан на ионных реакциях и позволяет обнаружить катионы или анионы.
Качественные реакции
Примеры качественных реакций на катионы
| Катион | Воздействие и реактив | Наблюдаемая реакция |
|---|---|---|
| Li + | Пламя | Карминово-красное окрашивание |
| Na + | Пламя | Желтое окрашивание |
| K + | Пламя | Фиолетовое окрашивание |
| Ca 2 + | Пламя | Кирпично-красное окрашивание |
| Sr 2 + | Пламя | Карминово-красное окрашивание |
| Ba 2 + | 1. Пламя |
2.
2. Выпадение белого осадка, не растворимого в кислотах.
Литература
Полезное
Смотреть что такое «Качественные реакции» в других словарях:
Качественный анализ (химия) — Качественный анализ совокупность химических, физико химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют… … Википедия
Молочная кислота — Молочная кислота … Википедия
Антраниловая кислота — ароматическая аминокислота. Производные антраниловой кислоты применяются в производстве … Википедия
Качественный анализ — совокупность химических, физико химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые,… … Википедия
Гликозиды — Гликозид кверцетина Гликозиды органические соединения, молекулы которых состоят из двух частей: углеводного (пиранозидного или фуранозидного) ос … Википедия
Е270 — Молочная кислота Молочная кислота α оксипропионовая кислота, CH3CH(OH)COOH. tпл 25–26 °С оптически активная + или – форма. tпл 18 °C рацемическая форма. Молочная кислота образуется при молочнокислом брожении сахаров, в частности в прокисшем… … Википедия
Лактат — Молочная кислота Молочная кислота α оксипропионовая кислота, CH3CH(OH)COOH. tпл 25–26 °С оптически активная + или – форма. tпл 18 °C рацемическая форма. Молочная кислота образуется при молочнокислом брожении сахаров, в частности в прокисшем… … Википедия
Полимер — (Polymer) Определение полимера, виды полимеризации, синтетические полимеры Информация об определении полимера, виды полимеризации, синтетические полимеры Содержание Содержание Определение Историческая справка Наука о Полимеризация Виды… … Энциклопедия инвестора
ЖЕЛУДОК — ЖЕЛУДОК. (gaster, ventriculus), расширенный отдел кишечника, имеющий благодаря наличию специальных желез значение особо важного пищеварительного органа. Ясно диференцированные «желудки» многих беспозвоночных, особенно членистоногих и… … Большая медицинская энциклопедия
Железо — (техн.) Ж. есть наиболее распространенный и наиболее употребительный из металлов. Ж. было известно еще египтянам во время постройки пирамид; у греков упоминается о нем в Илиаде Гомера, причем о нем говорится, как о трудно обрабатываемом металле,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Видеоурок «Качественные реакции в химии»
Многие вещества, которые нас окружают, мы можем определить по их специфическим признакам и свойствам. Например, алюминий несложно отличить от других металлов. Он легче, также легко изменяет свою форму, при трении о бумагу или белую ткань оставляет серую полосу. Медь — металл красного цвета, имеет металлический блеск, хорошо проводит электрический ток, поэтому медь применяют при изготовлении проводов.
Такие жидкости, как уксусная кислота и этиловый спирт, также легко различить. Уксусная кислота очень хорошо растворима в воде. Этиловый спирт имеет характерный запах и хорошо смешивается с водой.
Кристаллы медного купороса имеют синий цвет, легко растворяются в воде, образуя голубой раствор.
У всех в аптечке есть марганцовка, её также несложно распознать. Марганцовка представляет собой тёмно-фиолетовые кристаллы, которые хорошо растворяются в воде и образуют раствор ярко-розового цвета.
Однако многие вещества определить достаточно сложно. Как распознать кислород и углекислый газ, ведь эти газы бесцветны и не имеют запаха? Или как узнать, какое вещество находится в пробирке: раствор кислоты или соли? Какой газ находится в сосуде?
Для этого проводят химические реакции, в результате которых происходят изменения с веществами. Эти специфические признаки мы можем определить с помощью наших органов чувств: зрения, обоняния, слуха. Такие химические реакции называются качественными.
То есть качественные реакции — это химические превращения, сопровождающиеся характерными признаками, с помощью которых проводят распознавание веществ.
Основными признаками химических реакций являются: изменение окраски, выпадение осадка, выделение газа, появление запаха, выделение тепла и света.
Такие явления при проведении качественных реакций называются аналитическими сигналами.
Если опустить тлеющую лучинку в пробирку с кислородом и углекислым газом, то в одной пробирке лучинка гаснет, а в другой — ярко вспыхивает. Этот опыт позволяет определить, в какой пробирке кислород, а в какой — углекислый газ. В той пробирке, где лучинка гаснет, находится углекислый газ, так как углекислый газ не поддерживает горение. В той пробирке, где лучинка вспыхнула, находится кислород, потому что кислород поддерживает горение.
А как отличить, например, углекислый газ от азота, ведь азот, как и углекислый газ, не поддерживает горение? Для этого существует качественная реакция на углекислый газ.
Если в стакан с углекислым газом добавить небольшое количество известковой воды и встряхнуть жидкость в стакане, то жидкость мутнеет. Таким образом, с помощью известковой воды или раствора гашёной извести можно обнаружить углекислый газ.
Если в пробирку с прозрачной известковой водой опустить стеклянную трубку и продуть через неё выдыхаемый воздух, то раствор мутнеет. Значит, и в выдыхаемом воздухе есть углекислый газ.
То есть вещество, с помощью которого проводят качественную реакцию, называется реактивом на определяемое вещество.
В нашем случае известковая вода является реактивом на углекислый газ и углекислый газ является реактивом на известковую воду.
Чтобы реакцию можно было считать качественной, аналитический сигнал на определённый реактив должен появляться только при взаимодействии с одним или немногими веществами. В противном случае трудно будет сделать вывод о том, какое вещество мы обнаружили с помощью реактива.
Например, крахмал можно обнаружить с помощью раствора йода и наоборот. Если капнуть несколько капель йодной настойки на кусочек картофеля, то наблюдается появление сине-фиолетовой окраски. Данная реакция является качественной на крахмал и подтверждает наличие крахмала в картофеле.
Таким образом, с помощью качественных реакций проводят распознавание веществ. Качественная реакция сопровождается аналитическим сигналом. Кислород и углекислый газ можно распознать с помощью тлеющей лучинки. Реактивом на углекислый газ является известковая вода и наоборот. Реактивом на крахмал является раствор йода.
Качественные реакции в химии
Урок 11. Химия. Вводный курс. 7 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Качественные реакции в химии»
Многие вещества, которые нас окружают, мы можем определить по их специфическим признакам и свойствам. Например, алюминий несложно отличить от других металлов. Он легче, также легко изменяет свою форму, при трении о бумагу или белую ткань оставляет серую полосу. Медь – металл красного цвета, имеет металлический блеск, хорошо проводит электрический ток, поэтому медь применяют при изготовлении проводов.
Такие жидкости, как уксусная кислота и этиловый спирт, также легко отличить. У каждого из вас дома наверняка есть уксусная кислота. Определить её вы можете по специфическому резкому запаху. Уксусная кислота очень хорошо растворима в воде. Этиловый спирт имеет характерный запах и хорошо смешивается с водой.
Кристаллы медного купороса имеют синий цвет, легко растворяются в воде, образуя голубой раствор. У всех у вас в аптечке есть марганцовка, её также несложно отличить. Марганцовка представляет собой тёмно-фиолетовые кристаллы, которые хорошо растворяются в воде и образуют раствор ярко-розового цвета.
Однако многие вещества распознать достаточно сложно. Как распознать кислород и углекислый газ, ведь эти газы бесцветны и не имеют запаха? Или как узнать, какое вещество находится в пробирке: раствор кислоты или соли? Какой газ находится в сосуде? Для этого проводят химические реакции, в результате которых происходят изменения с веществами. Эти специфические признаки мы можем определить с помощью наших органов чувств: зрения, обоняния, слуха. Такие химические реакции называются качественными.
То есть качественные реакции – это химические превращения, сопровождающиеся характерными признаками, с помощью которых проводят распознавание веществ.
Основными признаками химических реакций являются: изменение окраски, выпадение осадка, выделение газа, появление запаха, выделение тепла и света.
Такие явления при проведении качественных реакций называются аналитическими сигналами.
Если опустить тлеющую лучинку в пробирку с кислородом и углекислым газом, то в одной пробирке лучинка гаснет, а в другой – ярко вспыхивает. Этот опыт позволяет определить, в какой пробирке кислород, а в какой – углекислый газ. В той пробирке, где лучинка гаснет, находится углекислый газ, так как углекислый газ не поддерживает горение. В той пробирке, где лучинка вспыхнула, находится кислород, потому что кислород поддерживает горение.
А как отличить, например, углекислый газ от азота, ведь азот, как и углекислый газ, не поддерживает горение? Для этого существует качественная реакция на углекислый газ.
Если в стакан с углекислым газом добавить небольшое количество известковой воды и встряхнуть жидкость в стакане, то жидкость мутнеет. Таким образом, с помощью известковой воды, или раствора гашёной извести, можно обнаружить углекислый газ.
Если в пробирку с прозрачной известковой водой опустить стеклянную трубку и продуть через неё выдыхаемый воздух, то раствор мутнеет. Значит, и в выдыхаемом воздухе есть углекислый газ.
То есть вещество, с помощью которого проводят качественную реакцию, называется реактивом на определяемое вещество.
В нашем случае известковая вода является реактивом на углекислый газ и углекислый газ является реактивом на известковую воду.
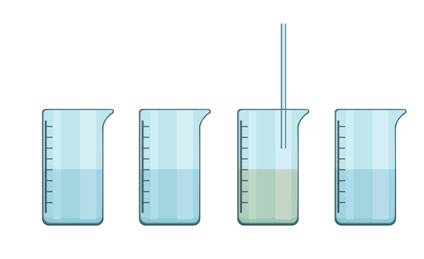
Проведём небольшой эксперимент. В четырёх стаканах у нас находятся: вода, раствор поваренной соли, раствор сахара и известковая вода. Определим, в каком стакане известковая вода. Для этого нужно пропустить через жидкость в каждом стакане выдыхаемый воздух, который обогащён углекислым газом. В третьем стакане появилось помутнение, значит, здесь находится известковая вода.
Чтобы реакцию можно было считать качественной, аналитический сигнал на определённый реактив должен появляться только при взаимодействии с одним или немногими веществами. В противном случае трудно будет сделать вывод о том, какое вещество мы обнаружили с помощью реактива.
Например, крахмал можно обнаружить с помощью раствора йода и наоборот. Если капнуть несколько капель йодной настойки на кусочек картофеля, то наблюдается появление сине-фиолетовой окраски. Данная реакция является качественной на крахмал и подтверждает наличие крахмала в картофеле.
Что такое качественная реакция
Содержание статьи
Качественные реакции на катионы и анионы
Чтобы определить катион серебра, нужно провести реакцию с каким-нибудь хлоридом. Взаимодействие Ag(+) и Cl(-) дает в итоге белый осадок AgCl↓. Катионы бария Ba2+ обнаруживаются в реакции с сульфатами: Ba(2+)+SO4(2-)=BaSO4↓ (белый осадок). Столь же верно и обратное: чтобы обнаружить в растворе хлорид-ионы или сульфат-ионы, нужно провести реакцию, соответственно, с солями серебра и бария.
Для определения катионов Fe(2+) используют гексацианоферрат (III) калия K3[Fe(CN)6], а точнее, комплексный ион [Fe(CN)6](3-). Образующийся темно-синий осадок Fe3[Fe(CN)6]2 называется «турнбуллевой синью». Для выявления катионов железа (III) берут уже гексацианоферрат (II) калия K4[Fe(CN)6], дающий при взаимодействии с Fe(3+) темно-синий осадок Fe4[Fe(CN)6]3 – «берлинскую лазурь». Обнаружить Fe(3+) можно также в реакции с роданидом аммония NH4CNS. В результате образуется малодиссоциирующий роданид железа (III) – Fe(CNS)3 – и раствор приобретает кроваво-красный цвет.
Избыток катионов водорода H+ создает кислую среду, в которой соответственно меняются окраски индикаторов: оранжевый метилоранж и фиолетовый лакмус становятся красными. В избытке же гидроксид-ионов OH- (щелочной среде) лакмус становится синим, метилоранж – желтым, а бесцветный в нейтральной и кислой средах фенолфталеин приобретает малиновое окрашивание.
Чтобы понять, есть ли в растворе катион аммония NH4+, нужно добавить щелочь. При обратимом взаимодействии с гидроксид-ионами NH4+ дает аммиак NH3↑ и воду. Аммиак имеет характерный запах, а влажная лакмусовая бумажка в таком растворе посинеет.
В качественной реакции на аммиак используется реагент HCl. В процессе образования из аммиака и хлороводорода хлорида аммония HN4Cl можно наблюдать белый дым.
Карбонат- и гидрокарбонат-ионы CO3(2-) и HCO3(-) можно обнаружить при добавлении кислоты. В результате взаимодействия этих ионов с катионами водорода выделяется углекислый газ и образуется вода. При пропускании полученного газа через известковую воду Ca(OH)2 раствор мутнеет, поскольку образуется нерастворимое соединение – карбонат кальция CaCO3↓. При дальнейшем пропускании углекислого газа образуется кислая соль – растворимый уже гидрокарбонат кальция Ca(HCO3)2.
Реагент для обнаружения сульфид-ионов S(2-) – растворимые соли свинца, дающие в реакции с S(2-) черный осадок PbS↓.
Обнаружение ионов при помощи горелки
Качественные реакции в органической химии
Фенол в растворе хлорида железа (III) образует комплексное соединение с FeCl3 и дает фиолетовое окрашивание. Вещества, содержащие альдегидную группу, дают реакции «серебряного зеркала» с аммиачным раствором оксида серебра. Раствор йода при внесении в него крахмала становится фиолетовым, а пептидные связи белков обнаруживаются в реакции с насыщенным раствором сульфата меди и концентрированным едким натром.
56. Методы познания в химии. Химия и жизнь  Читать 0 мин.
Читать 0 мин.
56.74. Качественные реакции в химии
Вещество, ион
Реагенты,
условия реакции
Признаки реакции, уравнения
Газообразные вещества
Хлопок или резкий лающий звук в зависимости от степени чистоты
Известковая вода (раствор Са(ОН)2)
При длительном пропускании осадок растворяется:
Желто-зеленый газ, запах
Запах жженых спичек
Фильтровальная бумага, смоченная раствором КMnO4
Запах нашатырного спирта
Катионы
Красный цвет раствора
Розовый цвет раствора
Выделение газа с резким запахом, изменяющего окраску влажной фенолфталеиновой бумаги в малиновый цвет
Белый творожистый осадок, быстро темнеющий на воздухе
Коричневый аморфный осадок:
Осадок белого цвета:
Белый кристаллический осадок:
Белый мелкокристаллический осадок, нерастворимый в азотной кислоте:
Голубой аморфный осадок:
Раствор ярко-синего цвета:
Оранжевый аморфный осадок:
Зеленоватый аморфный осадок:
Красная кровяная соль
Темно-синий осадок (турнбулева синь)
Бурый аморфный осадок:
Желтая кровяная соль
Белый аморфный осадок, растворяющийся в избытке щелочи:
Синий аморфный осадок, при нагревании переходящий в розовый:
Светло-зеленый аморфный осадок:
Желтый аморфный осадок:
Синевато-серый аморфный осадок:
Анионы
Фенолфталеин – малиновый, лакмус – синий, метиловый оранжевый – желтый
Выделение бурого газа:
Осадок белого цвета:
Белый творожистый осадок, быстро темнеющий на воздухе, растворимый в растворе аммиака:
Желтоватый творожистый осадок, растворимый в растворе аммиака:
Желтый творожистый осадок, НЕ растворимый в растворе аммиака:
Белый мелкокристаллический осадок, нерастворимый в азотной кислоте:
Запах жженых спичек:
Бурное выделение газа без запаха:
Органические вещества
(любые вещества с кратными
Водный раствор КMnO4
Бромная вода (раствор Br2 в воде)
Медная проволока, покрытая черным налетом оксида меди, становится блестящей, запах зеленого яблока (ацетальдегид):
Ярко-синий раствор
(раствор Br2 в воде)
Белый осадок:
Раствор фиолетового цвета:
Красный осадок:
Серебряный налет на стекле:
Раствор красного цвета
Раствор красно-коричневого цвета
Раствор красного цвета
Красный осадок:
Серебряный налет на стекле:
5HCOOH + 2KMnO4 + 3H2SO4 →
(раствор Br2 в воде)
Водный раствор КMnO4
Ярко-синий раствор, при нагревании → красный осадок
Серебряный налет на стекле:
Раствор сине-фиолетового цвета
(раствор Br2 в воде)
Белый осадок:
Белок яичный (альбумин) раствор
Осадок желтого цвета (реакция по бензольным кольцам, ксантопротеиновая реакция)
Раствор фиолетового цвета
(реакция по пептидным связям, биуретовая реакция)
(серосодержащие остатки аминокислот, цистеиновая реакция)
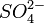
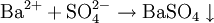
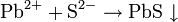
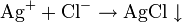
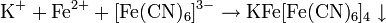














 Читать 0 мин.
Читать 0 мин.