для водных растворов солей alcl3 и na2co3 верно что
Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
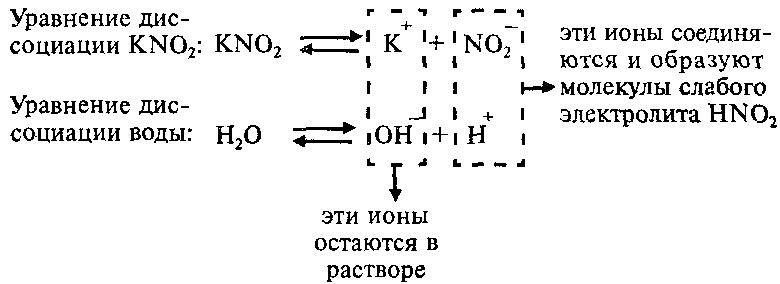
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
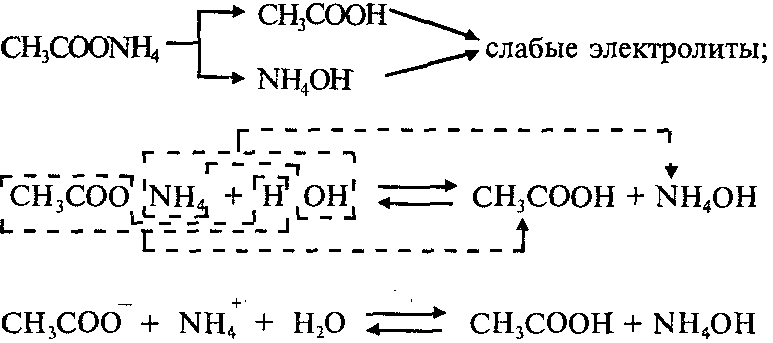
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
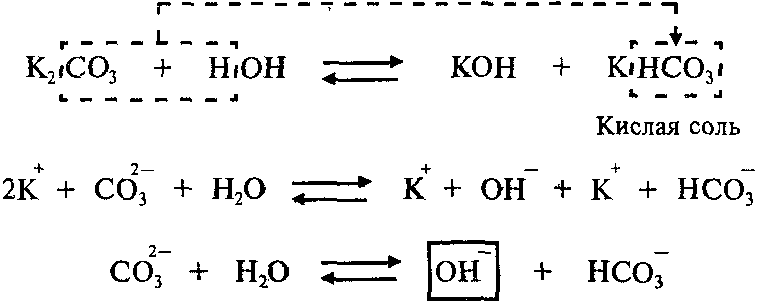
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Для водных растворов солей alcl3 и na2co3 верно что
В ходе урока мы изучим тему «Гидролиз. Среда водных растворов. Водородный показатель». Вы узнаете о гидролизе – обменной реакции вещества с водой, приводящей к разложению химического вещества. Кроме того, будет введено определение водородному показателю – так называемому РН.
I. Механизм гидролиза
Гидролиз – это обменная реакция вещества с водой, приводящая к его разложению.
Попробуем разобраться в причине данного явления.
Электролиты делятся на сильные электролиты и слабые. См. Табл. 1.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Степень диссоциации при 180С в растворах с концентрацией электролита 0,1 моль/л близка к 100%. Диссоциируют практически необратимо.
Степень диссоциации при 180С в растворах с концентрацией электролита 0,1 моль/л значительно меньше 100%. Диссоцииация необратима.
Вода относится к слабым электролитам и поэтому диссоциирует на ионы лишь в незначительной степени
Ионы веществ, попадающие в раствор, гидратируются молекулами воды. Но при этом может происходить и другой процесс. Например, анионы соли, которые образуются при её диссоциации, могут взаимодействовать с катионами водорода, которые, пусть и в незначительной степени, но все-таки образуются при диссоциации воды. При этом может происходить смещение равновесия диссоциации воды. Обозначим анион кислоты Х-.
Но, по правилу Ле Шателье, при уменьшении концентрации ионов водорода равновесие смещается в первой реакции в сторону их образования, т. е. вправо. Ионы водорода будут связываться с ионами водорода воды, а гидроксид ионы – нет, и их станет больше, чем было в воде до прибавления соли. Значит, среда раствора будет щелочная. Индикатор фенолфталеин станет малиновым.
Аналогично можно рассмотреть взаимодействие катионов с водой. Не повторяя всю цепочку рассуждений, подытоживаем, что если основание слабое, то в растворе будут накапливаться ионы водорода, и среда будет кислая.
II. Классификация катионов и анионов
К сильным кислотам относятся:
Ниже приведен список слабых кислот:
III. Отношение к гидролизу солей разных типов
Поскольку и катионы и анионы, согласно данной классификации, бывают двух типов, то всего существует 4 разнообразных комбинации при образовании их солей. Рассмотрим, как относится к гидролизу каждый из классов этих солей.
1. Гидролиз не возможен (гидролиз соли, образованной сильным основанием и сильной кислотой)
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается нейтральной.
2. Гидролиз по катиону (в реакцию с водой вступает только катион, т.е. это гидролиз соли, образованной слабым основанием и сильной кислотой)
В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3,MgSO4) гидролизу подвергается катион:
В результате гидролиза образуется слабый электролит, ион H + и другие ионы.
рН раствора Подведем итог тому, что вы узнали о гидролизе по катиону:
1) по катиону соли, как правило, гидролизуются обратимо;
2) химическое равновесие реакций сильно смещено влево;
3) реакция среды в растворах таких солей кислотная (рН Гидролиз по аниону (в реакцию с водой вступает только анион, т.е. это гидролиз соли, образованной сильным основанием и слабой кислотой)
рН таких растворов > 7 (раствор приобретает щелочную реакцию).
Подведем итог тому, что вы узнали о гидролизе по аниону:
1) по аниону соли, как правило, гидролизуются обратимо;
2) химическое равновесие в таких реакциях сильно смещено влево;
3) реакция среды в растворах подобных солей щелочная (рН > 7);
4) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
4. Совместный гидролиз: и по катиону, и по аниону (в реакцию с водой вступает и катион и анион, т.е. это гидролиз соли, образованной слабым основанием и слабой кислотой)
Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3,Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота
IV. Алгоритм составления уравнений гидролиза солей
Ход рассуждений
Пример
1. Определяем силу электролита – основания и кислоты, которыми образована рассматриваемая соль.
Помните!
Гидролиз всегда протекает по слабому электролиту, сильный электролит находится в растворе в виде ионов, которые не связываются водой.
Кислота
Основания
Слабые – все нерастворимые в воде основания и NH4OH
Na2CO3 – карбонат натрия, соль образованная сильным основанием (NaOH) и слабой кислотой (H2CO3)
2. Записываем диссоциацию соли в водном растворе, определяем ион слабого электролита, входящий в состав соли
Это гидролиз по аниону
3. Записываем полное ионное уравнение гидролиза – ион слабого электролита связывается молекулами воды
4. Записываем молекулярное гидролиза
V. Практическое применение гидролиза
На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной.
В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
VI. Задания для закрепления
Задание №2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III)
Контрольная работа по химии. 11 класс.
1) Сумма коэф-тов в уравнении электролитичекской диссо-ции сульфата натрия равна
а) 1
б) 2
в) 3
г) 4
2) Ионы с одинаковым числом электронов это
а) K+ и Na+
б) О2- и S2-
в) CL- и K+
г) Na+ и Ca2+
3) Вещества растворы которых проводят электрический ток
а) H2SO3, NaOH, KCL
б) CuCl2, CH3OH, AgNO3
в) Al(OH)3, BaSO4, Cl2
г) NaNO3, AlCl3, C6H12O6
4) Вещ-ва которые можно взять для приготовления расствора, содержащего ионы хлора Cl-
а) NaCl
б) CH2ClCOOH
в) CCl
г) AgCl
5) Вещества взаимод-вие которых друг с другом отображается кратким ионным уравнением Ba2+ + SO4- =BaSO4
а) BaCl2 и Na2SO4
б) BaO и H2SO4
в) Ba(OH)2 и H2SO4
г) Ba и H2SO4
6) Вещества вступающие друг с другом в реакцию ионного обмена
а) CuO и Ca(OH)2
б) FeCl3 и NaOH
в) CaCO3 и MgCl2
г) KOH и Ba(NO3)2
7) Кислотную среду имеет раствор соли формула которой
а) Na2CO3
б) Ba(NO3)2
в) AlCl3
г) K2SO4
8) Для подавления гидролиза хлорида железа (III) в водном расстворе можно
а) добавить кислоту
б) добавить воду
в) добавить щелочь
г) нагреть расствор
9) Карбоновые кислоты можно получать при гидролизе
а) белков
б) крахмала
в) сахарозы
г) жиров
10) Вещество подвергающееся гидролизу
а) глюкоза
б) крахмал
в) пропантриол-1,2,3
г) фруктоза
11) Имеются водные расстворы солей, формулы которых ZnSO4, Na2SO4, KCl. С расствором какой соли будет реагировать цинк? Составить уравнение реакции с комментариями (если можно ) ).
12) Имеются расстворы солей формулы которых FeCl3, K2CO3, NaCl и лакмусовая бумажка. Какую среду покажет лакмусовая бумажка в расстворе каждой соли и почему?
13) Какие химические реакции лежат в основе производства глицерина?
15) Расчитать массу осадка полученного при сливании расстворов содержащих 0.5 моль CuSO4 и 1.5 моль NaOH.
Презентация «Гидролиз солей»
Описание презентации по отдельным слайдам:
Процесс распада электролитов на ионы в водном растворе или расплаве называется электролитической диссоциацией. Положительные ионы называют катионами, отрицательные ионы – анионами. К катионам относятся: ион водорода и ионы металлов, катионы основных солей. К анионам относятся: гидроксид-ион, ионы кислотных остатков, анионы кислых солей.
ДИССОЦИАЦИЯ КИСЛОТ: H2SO4 → 2H+ + SO42- HCl → H+ + Cl- HNO3 → H+ + NO32-
ДИССОЦИАЦИЯ ОСНОВАНИЙ: NaOH → Na+ + OH-; Ca(OH)2 → Ca2+ + 2OH-;
Диссоциация растворимых солей: NaCI Na+ + CI- AI2(SO4)3 2AI3+ + 3SO42-
ДИССОЦИАЦИЯ ВОДЫ: Н2О → Н+ + ОН –
ГИДРОЛИЗ СОЛЕЙ Гидролиз солей Учитель химии: А.А. Намы
ГИДРОЛИЗ СОЛЕЙ – реакция обмена между солью и водой, приводящая к образованию слабого электролита.
4 ТИПА СОЛЕЙ: соль, образованная сильной кислотой и слабым основанием (ALCl3); сильным основанием и слабой кислотой (Na2 S); сильным основанием и сильной кислотой (NaCl); слабым основанием и слабой кислотой (СН3СООNH4).
: Соль, образованная сильной кислотой и слабым основанием. AlCl3 → Al3+ + 3Cl-; Н2О → Н+ + ОН –; Al3+ + Н+ + ОН – → AlОН2+ + Н+; в растворе в свободном виде остался ион водорода (Н+), значит среда раствора кислая; полное уравнение гидролиза: AlCl3 + Н2О → AlОНCl2 + НCl;
Соль, образованная, сильным основанием и слабой кислотой. Na2S 2Na++S2- Н2О → Н+ + ОН –; S2- + H2O HS- + OH- в растворе в свободном виде остался гидроксид ион ( OH-), значит среда раствора щелочная. Полное уравнение гидролиза Na2S + H2O NaHS + NaOH
Соль, образованная слабым основанием и сильной кислотой. CH3COONH4 CH3COO- +NH4+ Н2О → Н+ + ОН –; CH3COO- + NH4+ +H2O CH3COOH + NH3*H2O CH3COONH4 + H2O CH3COOH + NH3*H2O В этом случае гидролизу подвергаются как катион, так анион, образуются слабые электролиты, и среда раствора оказывается близкой к нейтральной или слабокислая, или слабощелочная, что зависит от констант диссоциации кислоты и основания.
Индикаторы –вещества, которые меняют окраску в зависимости от среды.
ИЗМЕНЕНИЕ ЦВЕТА РАЗЛИЧНЫХ ИНДИКАТОРОВ ПРИ ДЕЙСТВИИ РАСТВОРОВ КИСЛОТ И ЩЕЛОЧЕЙ Индикатор Кислая среда рН 7 Нейтральная среда рН = 7 Щелочная среда рН 7 Лакмус Красный Фиолетовый Синий Фенолфталеин Бесцветный Бесцветный Малиновый Метиловый оранжевый Розовый Оранжевый Желтый
Демонстрационный опыт: к раствору соды Na2CO3 приливаем поочерёдно индикаторы лакмус и метилоранж, фенолфталеин. Na2CO3 Вещество Катионы Анионы Лакмус метилоранж Фенолфталеин Среда Na+ CO32- Синий Желтый Малиновый Щелочная
Каждой группе предлагаю по одному примеру провести исследование солей: Al2(SO4)3, NH4NO3, СuSO4, Na3PO4, NaCl, Na2CO3, Na2SO3 и на основании наблюдений сделать вывод о среде. Вещество Катионы Анионы Лакмус Метилоранж Среда
Задание №1. а) используя метилоранж или лакмус, определите среду раствора соли сульфата алюминия.
Вывод: раствор соли, образованной слабым основанием и сильной кислотой имеет кислую среду.
ЗАДАНИЕ №2. а) используя метилоранж или лакмус, определите среду раствора соли фосфата натрия.
КАКОЙ ВЫВОД МОЖНО СДЕЛАТЬ, ИСХОДЯ ИЗ СОСТАВА СОЛИ И СРЕДОЙ ЕЁ РАСТВОРА? Раствор соли, образованной сильным основанием и слабой кислотой имеет щелочную среду.
Задание №3. а) определить среду раствора соли, образованной сильной кислотой и сильным основанием NaCI. б) обосновать свой ответ.
Вывод: Среда нейтральная,т.к. не образуется слабый электролит; такие соли гидролизу не подвергаются.
Вещество катионы анионы Лакмус Метил-оранж Фенол-фталеин Вывод Кислота Н+ красный розовый бесцветный Кислая Основание ОН- синий жёлтый малиновый Щелочная Вода Фиолетовый оранжевый бесцветный нейтральная NaCl Na+ Cl- Фиолет-ый оранжев бесцветный нейтральная К2CO3 К+ CO32- синий жёлтый малиновый Щелочная MgCI2 Mg2+ Cl- красный розовый бесцветный Кислая
СИЛУ УМУ ПРИДАЮТ УПРАЖНЕНИЯ 1.Кислую среду имеет водный раствор: а.Na3PO4 б.KCl в.Na2CO3 г. ZnSO4 2.Щелочную среду имеет водный раствор: а.FeCl3 б.K2SO4 в.Na2CO3 г.BaCl2
3.Нейтральную среду имеет раствор: а. Нитрата меди (II) Cu(NO3)2 б.Нитрата бария BaNO3 в.Ацетата калия CH3COONH4 г.Карбоната натрия Na(CO3)2 4.Одинаковую реакцию среды имеют растворы карбоната натрия и а.нитрата бария BaNO3 б.сульфита калия K2SO3 в.сульфата натрия Na2SO4 г.хлорида алюминия AICI3
5.Кислую реакцию среды имеет каждый из двух растворов: а.BaCl2 и ZnCl2 б.AlCl3 и FeCl2 в.FeCl3 и NaCl г.KCl и CaCl2 6.Соль, образованная сильным основанием и сильной кислотой, а.Гидролизуется по катиону б.Гидролизуется по аниону в.Не подвергается гидролизу г.Полностью разлагается водой
7. Установите соответствие между составом соли и реакцией среды её водного раствора Ответ: Состав соли Реакция среды А. NaNO2 Б. AI2(SO4)3 В. NaNO3 Г. КNO3 1.Кислая 2. Щелочная 3. Нейтральная А Б В Г
8. Установите соответствие между названием соли и средой её водного раствора. Название соли Среда раствора А. нитрат свинца Pb(NO3)2 Б. карбонат калия K2CO3 B. нитрат натрия NaNO3 Г.сульфид лития (Li2S) 1.Кислая 2. Щелочная 3. Нейтральная А Б В Г
9. Установите соответствие между названием соли и отношением её к гидролизу. Название соли Отношение к гидролизу А) хлорид цинка Б) сульфид калия В) нитрат натрия Г) нитрат меди (II) Гидролизуется по катиону Гидролизуется по аниону Гидролизуется по катиону и аниону Не гидролизуется А Б В Г
10.Установите соответствие между названием соли и отношением её к гидролизу. НАЗВАНИЕ СОЛИ ОТНОШЕНИЕ К ГИДРОЛИЗУ А) сульфид цезия Б) сульфат алюминия В) карбонат натрия Г)ацетат аммония 1.Гидролизуется по катиону 2.Гидролизуется по аниону 3.Гидролизуется по катиону и аниону 4.Не гидролизуется А Б В Г
11. Установите соответствие между веществом и продуктами его гидролиза. Формула вещества Продукты гидролиза А) Al2S3 Б) KF В) ZnCl2 Г) CaC2 1.Zn(OH)Cl и HCl Al(OH)S и H2S Al(OH)3 и H2S Ca(OH)2 и C2H2 Ca(OH)2 и CH4 NaHCO3 и NaOH А Б В Г
ДОМА Заполните технологические карты и напишите уравнения гидролиза в ионном и молекулярном виде.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: 2609120358
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
В Ленобласти педагоги призеров и победителей олимпиады получат денежные поощрения
Время чтения: 1 минута
Путин поручил разработать концепцию развития допобразования детей до 2030 года
Время чтения: 2 минуты
В России отцы охотнее дают деньги детям на карманные расходы, чем матери
Время чтения: 2 минуты
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
До конца 2024 года в РФ построят около 1 300 школ
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.