дутастерид или аводарт что лучше
Длительное лечение больных с аденомой предстательной железы дутастеридом (препаратом Аводарт)
Высокая распространенность аденомы предстательной железы (АПЖ) у мужчин определяет актуальность проблем лечения этого заболевания. В связи с увеличением продолжительности жизни число мужчин, страдающих АПЖ, с каждым годом растет [1]. По данным отечественных и зарубежных исследователей [2, 3], клинические проявления АПЖ имеют место у 25–35% мужчин в возрасте 40–50 лет, их частота увеличивается с возрастом и достигает 75–80% у мужчин старше 70 лет.
Многочисленные клинические симптомы АПЖ крайне разнообразны, но многие из них существенно снижают качество жизни больных. При прогрессировании заболевания могут возникнуть серьезные осложнения (острая задержка мочи, хроническая почечная недостаточность, камни мочевого пузыря и др.), которые потребуют выполнения оперативного вмешательства. В настоящее время около 30% мужчин, страдающих АПЖ, подвергаются хирургическому лечению, однако, по данным ряда авторов, у 25–35% прооперированных больных выявляют различные интраоперационные и послеоперационные осложнения [2, 3].
В последние годы предложены десятки препаратов для лечения больных аденомой предстательной железы. Однако установлено, что из многих препаратов, применяемых для лечения пациентов с АПЖ, только ингибиторы 5-альфа-редуктазы способны оказывать патогенетически направленное действие и предупреждать прогрессирование заболевания [1–3]. С учетом ведущей роли фермента 5-альфа-редуктазы в патогенезе АПЖ, с 1992 г. для лечения этой болезни стали применять ингибитор 5-альфа-редуктазы II типа финастерид. В 2005 г. в России был зарегистрирован и разрешен для лечения пациентов с АПЖ новый препарат этого класса – дутастерид под коммерческим названием Аводарт (производство компании GlaxoSmithKline, Великобритания), который обладает способностью ингибировать 5-альфа-редуктазу не только II, но и I типа.
За последнее десятилетие были опубликованы работы, доказывающие высокую эффективность дутастерида у больных АПЖ [4–6]. Так, по данным метаанализа 2004 г., проведенного F. Debuyne и соавт., через 24 месяца приема этого препарата объем предстательной железы в среднем снизился на 26%, симптоматика болезни по Международной шкале оценки простатических симптомов (International Prostate Symptom Score, IPSS) уменьшилась на 4,4 балла, уровень дигидротестостерона в сыворотке крови снизился на 93,7%, уровень простатспецифического антигена (ПСА) – на 57,2%, а максимальная скорость потока мочи выросла на 2,2 мл/с [5]. В последние годы появились работы, в которых изучалась целесообразность применения дутастерида у больных с АПЖ перед трансуретральной резекцией простаты для уменьшения размера железы и профилактики геморрагических осложнений [7, 8].
Однако одним из спорных вопросов терапии больных АПЖ дутастеридом является определение оптимальной длительности лечения. Некоторые авторы [9] отмечают положительный эффект (уменьшение объема простаты и снижение симптоматики) от приема дутастерида уже через 3 месяца лечения, тогда как другие для достижения эффекта рекомендуют принимать этот препарат в течение как минимум 6 месяцев, далее продолжая терапию в течение 12 месяцев [10] или даже 48 месяцев [5]. В связи с этим целью проведенного нами исследования была оценка эффективности длительного лечения больных с АПЖ дутастеридом.
Материалы и методы
Под нашим наблюдением находились 188 больных с АПЖ, которые получали дутастерид по 0,5 мг 1 раз в сутки. В зависимости от длительности приема дутастерида больные были разделены на 3 группы. У 28 (14,9%) больных (первая группа) курс лечения продолжался в течение 6 месяцев, у 63 (33,5%) больных (вторая группа) – в течение 12 месяцев, а у 97 (51,6%) больных (третья группа) – в течение 24 месяцев непрерывно. Других препаратов для лечения АПЖ пациенты всех трех групп в процессе терапии дутастеридом не получали.
Все больные были обследованы перед назначением дутастерида, в процессе приема препарата и сразу же после завершения курса лечения. Кроме того, 28 пациентов первой группы, 53 из 63 пациентов второй группы и 89 из 97 пациентов третьей группы были обследованы спустя 12–36 месяцев после окончания приема дутастерида для изучения отдаленных результатов проведенной терапии.
Средний возраст пациентов перед назначением дутастерида составил 63,5 ± 4,4 года (от 52 до 80 лет). В исследование не включались больные с увеличением средней доли предстательной железы, склерозом шейки мочевого пузыря, камнями и дивертикулами мочевого пузыря, стриктурами уретры, после оперативных вмешательств на органах малого таза, с выраженными кардиологическими и цереброваскулярными нарушениями, почечной и печеночной недостаточностью.
Исходные показатели симптоматики болезни у наблюдаемых нами пациентов были следующими:
Результаты и обсуждение
К концу лечения показатели клинического течения заболевания улучшились у всех больных АПЖ первой, второй и третьей групп (табл. 1), однако более существенно – у больных третьей группы, получавших дутастерид в течение 24 месяцев непрерывно. Так, у больных первой группы, которые получали дутастерид в течение 6 месяцев, суммарный балл симптоматики по шкале IPSS к концу лечения снизился на 3,3 балла (с 14,1 ± 2,9 до 10,8 ± 3,0), качество жизни (QoL) улучшилось на 1,7 балла (с 4,2 ± 0,6 до 2,5 ± 0,8 баллов), объем предстательной железы уменьшился на 6,2 см3, или на 11% (с 56,5 ± 10,3 до 50,3 ± 8,8 см3), максимальная скорость потока мочи (Qmax) возросла на 2,1 мл/с (с 8,9 ± 0,8 до 11,0 ± 0,9 мл/с).
У больных второй группы, которые получали дутастерид в течение 12 месяцев, суммарный балл симптоматики по шкале IPSS к концу лечения снизился на 6,9 баллов (с 14,1 ± 2,9 до 7,2 ± 2,5), качество жизни (QoL) улучшилось на 2,2 балла (с 4,2 ± 0,6 до 2,0 ± 0,7 баллов), объем предстательной железы уменьшился на 10,3 см3, или на 18,2% (с 56,5 ± 10,3 до 46,2 ± 9,1 см3), максимальная скорость потока мочи (Qmax) возросла на 4,3 мл/с (с 8,9 ± 0,8 до 13,2 ± 0,5 мл/с).
У больных третьей группы, которые получали дутастерид в течение 24 месяцев, суммарный балл симптоматики по шкале IPSS к концу лечения снизился на 9,2 балла (с 14,1 ± 2,9 до 4,9 ± 1,2), качество жизни (QoL) улучшилось на 2,6 балла (с 4,2 ± 0,6 до 1,6 ± 0,8 баллов), объем предстательной железы уменьшился на 14,6 см3, или на 25,9% (с 56,5 ± 10,3 до 41,9 ± 7,1 см3).
Одним из важных объективных показателей эффективности проводимого медикаментозного лечения больных АПЖ является уменьшение объема предстательной железы к концу терапии. Согласно нашим наблюдениям, оказалось, что через 6 месяцев лечения дутастеридом объем предстательной железы уменьшился в среднем на 11%, тогда как через 12 месяцев – уже на 18,2% (p
Аводарт (Dutasteride)
Инструкция
Торговое название
Международное непатентованное название
Лекарственная форма
Состав
Одна капсула содержит
вспомогательные вещества: моно- и диглицериды каприновой/каприловой кислоты, бутилгидрокситолуол,
состав оболочки: желатин, глицерин, титана диоксид Е171 (СI77891), оксид железа желтый Е172 (СI77492).
Описание
Продолговатые, непрозрачные, темно-желтые мягкие желатиновые капсулы с маркировкой «GX CE2» на одной стороне
Препараты для лечения урологических заболеваний. Препараты для лечения доброкачественной гипертрофии простаты. Тестостерона 5α-редуктазы ингибиторы. Дутастерид
Фармакологические свойства
Фармакокинетика
После приема одной дозы 0,5 мг максимальная концентрация дутастерида в сыворотке достигается в течение 1–3 ч. Абсолютная биодоступность составляет около 60% и не зависит от приема пищи.
Дутастерид имеет значительный объем распределения (от 300 до 500 л) и обладает высокой степенью связывания с белками плазмы крови (>99,5%).
Через 6 месяцев ежедневного приема 0,5 мг препарата в сыворотке (Css) устанавливаются устойчивые концентрации дутастерида, равные примерно 40 нг/мл, причем 65% этого уровня достигаются уже через 1 месяц после начала приема и примерно 90% — через 3 месяца. Через 52 недели лечения концентрация дутастерида в сперме составляет в среднем 3,4 нг/мл (от 0,4 до 14 нг/мл). Из сыворотки в сперму попадает около 11,5% дутастерида.
Дутастерид метаболизируется ферментом CYP3A4 системы цитохрома Р450 до двух моногидроксилированных метаболитов. На него не действуют ферменты CYP1А2, CYР2А6, CYP2Е1, CYP2С8, CYP2С9, CYP2С19, CYP2В6 или CYP2D6. После достижения устойчивой концентрации дутастерида, в сыворотке обнаруживают неизмененный дутастерид, три его крупных метаболита (4’-гидроксидутастерид, 1,2-дигидродутастерид и 6-гидроксидутастерид) и 2 малых метаболита (6,4’-дигидроксидутастерид и 15-гидроксидутастерид).
Дутастерид обнаруживается в сыворотке (в концентрациях выше 0,1 нг/мл) до 4–6 месяцев после прекращения его приема.
Дутастерид подвергается интенсивному метаболизму. После приема 0,5 мг препарата в сутки от 1,0 до 15,4% (в среднем 5,4%) принятой дозы экскретируется с фекалиями в неизмененном виде, остальная часть дозы выводится в виде 4 крупных и 6 малых метаболитов.
С мочой у человека выделяются следовые количества неизмененного дутастерида (менее 0,1% от принятой дозы).
При приеме терапевтических доз дутастерида его конечный период полувыведения составляет 3–5 недель.
Нет необходимости снижать дозу дутастерида у пожилых пациентов.
Пациенты с нарушениями функции почек
Влияние почечной недостаточности на фармакокинетику дутастерида не изучено. Тем не менее, менее 0,1% от стационарной дозы 0,5 мг дутастерида выделяется с мочой, что не оказывает клинически значимого увеличения концентрации дутастерида в плазме.
Пациенты с нарушениями функции печени
Влияние на фармакокинетику дутастерида при печеночной недостаточности не изучено, но, как ожидается, уровни дутастерида в плазме крови будут увеличены за счет удлинения периода полураспада дутастерида.
Фармакодинамика
Аводарт — двойной ингибитор 5-редуктазы. Он подавляет активность изоферментов 5-редуктазы 1 и 2 типа, которые ответственны за превращение тестостерона в 5-дигидротестостерон (ДГТ). Дигидротестостерон является основным андрогеном, ответственным за гиперплазию железистой ткани предстательной железы.
Влияние на концентрацию дигидротестостерона и тестостерона
Влияние на объем предстательной железы
Значительное сокращение объема предстательной железы обнаруживается уже через месяц после начала лечения и продолжается вплоть до 24-го месяца. Аводарт приводит в среднем к сокращению объема предстательной железы на 23,6% на 12-й месяц лечения.
Влияние на мужскую фертильность
При приеме Аводарта в дозе 0,5 мг/сутки в течение 52 недель лечения наблюдалось среднее процентное уменьшение количества спермы, объем спермы и подвижность сперматозоидов по сравнению с исходными показателями, и составляли 23%, 26% и 18% соответственно. На концентрацию и морфологию сперматозоидов влияния оказано не было. Через 24 недели наблюдения, среднее изменение в процентах общего количества сперматозоидов в группе, принимавшей дутастерид, оставалось на 23% ниже, чем исходные данные. Таким образом, возможность снижения мужской фертильности не может быть исключена.
Неоплазия грудных желез
В настоящее время неясно, есть ли причинно-следственная связь между возникновением рака груди у мужчин и долгосрочным использованием дутастерида.
Во время 4-летнего исследования лечения ДГПЖ препаратом Аводарт в сочетании с тамсулозином, частота возникновения случаев сердечной недостаточности в группе комбинированной терапии (14/1610, 0,9%) была выше, чем в группах монотерапии Аводартом (4/1623, 0,2%) и тамсулозином (10/1611, 0,6%). Оценка относительного риска на момент первого сердечного приступа составила 3.57 [95% CI 1.17, 10.8] для пациентов, получающих комбинированную терапию по сравнению с монотерапией дутастеридом и 1.36 [95% CI 0.61, 3.07] по сравнению с монотерапией тамзулозином. Нет причинно-следственной связи между приемом дутастерида (отдельно или в сочетании с альфа-адреноблокатором) и развитием сердечной недостаточности.
В отдельном 4-летнем исследовании наблюдалась более высокая частота возникновения случаев сердечной недостаточности у пациентов, принимающих Аводарт 0,5 мг один раз в сутки (30/4105, 0,7%), по сравнению с пациентами, принимавшими плацебо (16/4126, 0,4%). Вторичный анализ этого исследования показал более высокую частоту возникновения случаев сердечной недостаточности у пациентов, принимавших одновременно Аводарт и альфа-аденоблокатор (12/1152, 1,0%), по сравнению с пациентами, принимавших Аводарт без альфа-аденоблокатора (18/2953, 0,6%), плацебо и альфа-аденоблокатор (1/1399,
О безопасности применения Аводарта (дутастерида) у больных доброкачественной гиперплазией предстательной железы (ДГПЖ)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Ингибиторы 5a–редуктазы – группа препаратов, используемых в клинической практике с начала 90–х годов XX века. Самый первый препарат этой группы – финастерид.
После ряда доклинических и клинических испытаний [1] препарат был разрешен в США для широкого клинического применения у больных гиперплазией предстательной железы в 1992 году, а затем, в 1995 году, прошел регистрацию и в России. Несколько позже финастерида был разработан потенциально более мощный ингибитор 5a–редуктазы I и II типа – дутастерид: результаты первых клинических испытаний этого препарата появились в литературе в 1998 году [2]. В отличие от финастерида, дутастерид обладает способностью ингибировать 5a–редуктазу не только II, но и I типа [3] – таким образом препарат обеспечивает максимальное подавление выработки дигидротестостерона. В западных странах дутастерид под коммерческим названием «Аводарт» был зарегистрирован и разрешен для клинического использования в 2002 году, в России – в 2005 году.
Общеизвестно, что как до, так и после официальной регистрации медицинские препараты проходят испытания не только на предмет их эффективности, но и безопасности. Эффективности применения ингибиторов 5a–редуктазы у больных ДГПЖ всегда уделялось много внимания, и эта проблема хорошо освещена в медицинской литературе. В данной статье мы хотели бы остановиться на результатах недавно завершившихся больших клинических исследований, в которых были изучены вопросы безопасности и переносимости терапии Аводартом (дутастеридом).
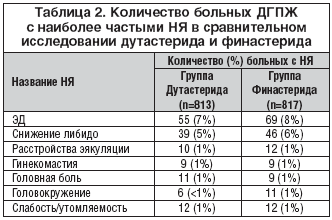
Исчерпывающие данные по безопасности и переносимости Аводарта (дутастерида) у больных ДГПЖ были получены в ходе трех крупных рандомизированных двойных слепых плацебо–контролированных исследований (ARIA 3001, ARIA 3002 и ARIB 3003, [4]) и одного рандомизированного двойного слепого исследования (ARI 40001, [5]), в котором пациенты контрольной группы получали финастерид. В исследованиях ARIA 3001, ARIA 3002 и ARIB 3003 приняли участие 4325 больных ДГПЖ (2167 – в группе дутастерида, 2158 – в группе плацебо), продолжительность терапии составила 2 года. В финастерид–контролированное исследование с продолжительностью лечения 1 год было рандомизировано 1630 пациентов: 813 – в группу дутастерида и 817 – в группу финастерида. Отметим, что численность пациентов в группах и длительность терапии более чем достаточны для того, чтобы оценить эффективность и безопасность изучаемого препарата.
Анализ данных, полученных в ходе упомянутых выше плацебо–контролированных исследований, показал, что имевшие место нежелательные явления (НЯ), как правило, были слабой или умеренной степени выраженности и чаще всего относились к расстройствам сексуальной функции (табл. 1). При этом как в группе приема Аводарта, так и в плацебо–группе у подавляющего большинства пациентов (соответственно у 89% и 94%) расстройств сексуальной функции не было.
Интересно, что по частоте регистрируемых нежелательных явлений, связанных с приемом препаратов, статистически достоверные отличия между группами дутастерида и плацебо, как правило, наблюдались только в течение первых 6 месяцев терапии. В ходе дальнейшего лечения отличия между группами по наиболее частым нежелательным явлениям исчезали. Так, к примеру, в первые 6 месяцев лечения эректильная дисфункция (ЭД) отмечалась у 4,7% больных в группе дутастерида и у 1,7% пациентов в группе плацебо – различия между группами были статистически значимыми. Впоследствии частота ЭД в группах не имела достоверных отличий, составляя на 7–12–м месяце 1,4% и 1,5%; на 13–18–м месяце – 1% и 0,5%, а на 19–24–м месяце – 0,8 и 0,9%, соответственно. Аналогичная закономерность была выявлена в отношении несколько реже встречавшихся расстройств эякуляции и снижения либидо. Единственным нежелательным явлением, связанным с приемом препарата и достоверно чаще возникавшим у пациентов в группе дутастерида, начиная с 7–го месяца приема и до конца исследования, была гинекомастия. Частота гинекомастии в группе дутастерида, однако, в целом была небольшой и на протяжении всего исследования не превышала 1,1%. Немаловажно также, что из нежелательных явлений самой частой причиной прекращения приема препарата была эректильная дисфункция: в группе дутастерида таких пациентов было 24 (1,1%), а в группе плацебо – 15 (0,69%). Исходя из представленных данных, можно утверждать, что переносимость длительной (на протяжении 2 лет) терапии дутастеридом хорошая, и лишь у небольшого процента больных на фоне этого лечения могут возникать клинически значимые нежелательные явления.
Сходный профиль нежелательных явлений был зарегистрирован в ходе финастерид–контролированного исследования ARI 40001. Данные этого исследования свидетельствуют о том, что дутастерид и финастерид могут вызывать сходные нежелательные явления (табл. 2), частота и степень выраженности наиболее значимых из них невелики, а переносимость обоих препаратов в целом хорошая.
Следует отметить, что во всех вышеупомянутых исследованиях также проводился динамический контроль ряда гематологических (лейкоциты, тромбоциты, эритроциты, гемоглобин и др.) и биохимических (глюкоза, натрий, калий, альбумин, общий белок, креатинин) лабораторных показателей, включая показатели функции печени – щелочную фосфотазу, АЛТ и общий билирубин. Анализ полученных результатов показал, что прием дутастерида не оказывает негативного влияния ни на один из исследованнных лабораторных показателей. Изменения показателей в группе дутастерида не имели отличий от таковых в группе плацебо и в группе финастерида.
Безопасность применения Аводарта (дутастерида) у людей также была исследована на здоровых добровольцах. Так, в связи с теоретической возможностью препаратов, модулирующих метаболизм тестостерона, влиять на плотность костной ткани было проведено рандомизированное двойное слепое плацебо– и финастерид–контролированное исследование (ARIA 1009), в котором оценивалось воздействие дутастерида на плотность костей (методом рентгеновской денситометрии), показатели костного метаболизма (остеокальцин, костная щелочная фосфотаза сыворотки крови и n–телопептид мочи), а также на липидный профиль (холестерин, триглицериды, липопротеиды высокой и низкой плотности сыворотки крови) [5]. Продолжительность терапии составила почти 1 год (52 недели) c последующими контрольными обследованиями в течение 24 недель. Результаты проведенного исследования показали отсутствие признаков негативного влияния дутастерида на метаболизм костной ткани и на липидный профиль человека. Данные, полученные в группе дутастерида, не отличались от таковых в группах плацебо и финастерида.
Также в настоящее время хорошо изучены лекарственные взаимодействия дутастерида с препаратами, чаще всего используемыми у пожилых пациентов. Так, не было выявлено фармакодинамических и фармакокинетических взаимодействий между дутастеридом и тамсулозином (данные исследования ARIA1011), варфарином (данные исследования ARI10016), дигоксином (данные исследования ARI10017) и холестирамином (данные исследования ARIA1010). В проведенных затем исследованиях 3–й фазы было доказано отсутствие клинически значимых взаимодействий дутастерида с ингибиторами АПФ, b–блокаторами, антагонистами кальциевых каналов, диуретиками, кортикостероидами, антигиперлипидемическими средствами, нестероидными противовоспалительными препаратами, фторхинолонами и ингибиторами фосфодиэстеразы 5–го типа.
Таким образом, результаты исследований, проведенных с участием нескольких сотен здоровых добровольцев и более 6000 больных гиперплазией простаты, позволяют с уверенностью утверждать, что даже при длительном применении ингибитора 5a–редуктазы обоих типов Аводарта (дутастерида) переносимость препарата хорошая, и прием его сопряжен с минимальным риском нежелательных явлений.
Литература
1. Gormley GJ, Stoner E, Bruskewitz RC, et al. The effect of finasteride in men with benign prostatic hyperplasia. The Finasteride Study Group. N Engl J Med. 1992;327:1185–1191.
2. Gisleskog PO, Herman D, Hammarlund–Udenaes M, et al. A model of the turnover of dihydrotestosterone in the presence of the irreversible 5(–reductase inhibitors GI198745 and finasteride. Clin Pharmacol Ther. 1998; 64:636–647.
3. Bramson HN, Hermann D, Batchelor KW, et al. Unique preclinical characteristics of GG745, a potent dual inhibitor of 5AR. J Pharmacol Exp Ther. 1997;282:1496–1502.
4. Debruyne F, Barkin J, van Erps P, et al. ARIA3001, ARIA3002, ARIB3001 study investigators. Efficacy and safety of along term treatment with the dual 5–(–reductase inhibitor dutasteride in men with symptomatic benign prostatic hyperplasia. Eur Urol. 2004, 46:488–494.
5. GlaxoSmithKline Document BP2001/00017/00. Data on File. Clinical trial report study ARI 40001.
Терапия α-адреноблокаторами у больных ДГПЖ
Нарушение акта мочеиспускания — одна из наиболее частых жалоб, являющихся основанием для обращения к урологу. Следует отметить, что распространенность расстройств мочеиспускания прямо пропорциональна возрасту больного, и наиболее подвержены подобным расс
Нарушение акта мочеиспускания — одна из наиболее частых жалоб, являющихся основанием для обращения к урологу. Следует отметить, что распространенность расстройств мочеиспускания прямо пропорциональна возрасту больного, и наиболее подвержены подобным расстройствам пациенты старше 50 лет. Изменение демографической ситуации во всем мире и в нашей стране, характеризующееся увеличением числа лиц старшего возраста, выводит расстройство мочеиспускания в ряд первоочередных медицинских и социальных проблем.
Начало 90-х годов прошлого века ознаменовалось резким повышением интереса урологов всего мира к проблеме медикаментозной терапии расстройств мочеиспускания, обусловленных заболеваниями нижних мочевых путей. На фоне всего многообразия лекарственных препаратов для коррекции расстройств мочеиспускания группа селективных α1-адреноблокаторов уверенно заняла лидирующие позиции.
Исследование популярности различных лекарственных препаратов для медикаментозной терапии доброкачественной гиперплазии предстательной железы (ДГПЖ) в условиях реальной клинической практики было выполнено в 2003 г. в шести странах Европы. Проект продолжался в течение года, включал более 5 000 пациентов и получил название TRIUMPH. [5] При анализе данных выявлено, что у 30% пациентов в качестве оптимального варианта ведения было выбрано динамическое наблюдение. Среди больных, получавших консервативную терапию, распределение препаратов оказалось следующим: 16% — блокаторы 5-α-редуктазы, 79% — α-адреноблокаторы, 5% — растительные экстракты. Эти данные полностью отражают тенденцию к снижению популярности растительных препаратов, не рекомендованных к назначению Европейской асcоциацией урологов у больных ДГПЖ [10].
В настоящее время существуют объективные доказательства эффективности лечения различных расстройств мочеиспускания с помощью α1-адреноблокаторов. Причины широкого распространения препаратов этой фармакологической группы становятся очевидны при рассмотрении механизмов их действия. В основе патогенеза нарушения акта мочеиспускания у большинства урологических больных лежат недостаточность энергетического метаболизма и гипоксия детрузора в условиях повышенного уретрального сопротивления. Работами сотрудников нашей кафедры доказано, что в мышечной ткани мочевого пузыря при нарушенном акте мочеиспускания наблюдаются уменьшение артериовенозной разности парциального напряжения кислорода и метаболический ацидоз, а также снижение активности ферментов в ткани детрузора, участвующих в ключевых реакциях анаэробного окисления. Параллельно с вышеописанным в отмечается процесс повышения активности гликолитических ферментов и ферментов пентозофосфатного шунта, свидетельствующих о преобладании в детрузоре гликолиза [1].
Причины нарушений энергетического метаболизма и функции детрузора крайне многообразны. В частности, они могут возникать при повышении активности симпатической нервной системы, расстройствах органного кровообращения, авитаминозе (группа В), хронических заболеваниях дыхательной и сердечно-сосудистой систем, а также усугубляться под влиянием приема ряда фармакологических препаратов, угнетающих дыхательную цепь и вызывающих обструктивные нарушения уродинамики [1].
Гистологические признаки ДГПЖ определяются у большинства мужчин старше 40 лет [6]. В начале отмечается появление стромальных узелков в периуретральной области переходной зоны простаты. После узлообразования возникает железистая гиперплазия простаты. Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям (необходимость просыпаться ночью, чтобы опорожнить мочевой пузырь, уменьшение напряжения струи мочи, ощущение неполного опорожнения мочевого пузыря после мочеиспускания и наличие трудно сдерживаемых позывов к мочеиспусканию). Зачастую к вышеперечисленным симптомам присоединяется затруднение в начале акта мочеиспускания, более выраженное утром и заставляющее пациентов натуживаться. Все вышеперечисленные симптомы зачастую объединяются общим названием — «симптомы нижних мочевых путей» (СНМП). При отсутствии адекватного лечения на конечных стадиях заболевания резко возрастает риск возникновения острой задержки мочи и почечной недостаточности.
Механизм воздействия α1-адреноблокаторов у больного ДГПЖ основан на блокаде передачи нервных импульсов в симпатической нервной системе и расслаблении гладкой мускулатуры «заинтересованной» зоны, что, в свою очередь, вызывает снижение внутриуретрального сопротивления и улучшение кровоснабжения органов малого таза [2].
В последние годы медикаментозная терапия ДГПЖ α1-адреноблокаторами стала международным стандартом [1, 3]. Популярность этих лекарственных препаратов заметно выше по сравнению с блокаторами 5-α-редуктазы и препаратами растительного происхождения [4, 5].
Исследования последних лет свидетельствуют, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность). Причиной обструкции является увеличение простаты в размерах с постепенным сужением просвета мочеиспускательного канала (механический компонент) и повышением тонуса гладкомышечных волокон простаты и задней уретры (динамический компонент) [1, 6].
Альфа-адреноблокаторы устраняют гипертонус гладкой мускулатуры стромы предстательной железы, занимающей до 60% объема гиперплазированной простаты, что позволяет уменьшать динамический компонент инфравезикальной обструкции [7]. Кроме того, доказанное в экспериментах улучшение кровоснабжения мочевого пузыря, имеющее место на фоне лечения α-адреноблокаторами, приводит к улучшению биоэнергетики детрузора и восстановлению его сократительной способности [1].
Многими международными сравнительными мультицентровыми исследованиями было доказано, что на фоне лечения α1-адреноблокаторами у пациентов с ДГПЖ уменьшается симптоматика (в среднем на 50%), возрастает максимальная объемная скорость мочеиспускания (на 30–47%), а количества остаточной мочи сокращается вдвое [8, 9].
В настоящее время в России доступны несколько α1-адреноблокаторов: альфузозин, теразозин, доксазозин и тамсулозин. Сравнительные исследования этих препаратов, проводившиеся во многих урологических клиниках мира, доказали их практически равную эффективность [9, 10]. Вопрос подбора оптимальной терапии внутри этой фармакологической группы в последние годы перестал определяться степенью воздействия лекарственного средства на симптоматику ДГПЖ, а зависит в основном от вероятности возникновения побочных эффектов, удобства применения, доступности препаратов и индивидуальных предпочтений врача.
Многочисленные клинические исследования доказали, что наибольшая частота побочных эффектов регистрируется на фоне терапии доксазозином и теразозином — препаратами, требующими титрования и доставшимися урологам «в наследство от терапевтов». Действительно, первые опыты применения α1-адреноблокаторов в урологии в начале 80-х годов прошлого века основывались на эмпирических данных, свидетельствующих об улучшении качества мочеиспускания у больных, получавших эти препараты в связи с гипертонической болезнью. Безусловно, в урологии они применяются в меньших дозировках, но их гипотензивный эффект по-прежнему проявляет себя большим количеством побочных эффектов. Возникновение различных по интенсивности нежелательных явлений на фоне лечения регистрируется у 10–16% пациентов [10, 14]. В основе механизма возникновения вышеуказанных побочных явлений лежит воздействие препаратов на гладкую мускулатуру сосудистой стенки, приводящее к вазодилатации и опасности депонирования крови на периферии, особенно при резкой перемене положения тела после длительного пребывания в горизонтальном положении.
В исследовании R. E. Eckert в 1999 г. было доказано, что отношение концентрации препарата, блокирующего 50% адренорецепторов почечной артерии и простаты, оказалось наиболее выгодным у альфузозина. Таким образом, клиническая селективность альфузозина (Дальфаз) значительно превосходит таковую у прочих представителей группы α1-адреноблокаторов [11] (рис. 1). Соотношение для различных препаратов оказалось следующим: альфузозин (543,59) > тамсулозин (89,81) > доксазозин (50,75) > теразозин (18,65).
Полученные данные противоречили распространенному мнению, согласно которому наибольшей уроселективностью обладает тамсулозин, избирательно блокирующий α1-адренорецепторы в ткани простаты. Стало очевидным, что фармакологическая уроселективность далеко не всегда совпадает с клинической. Неоднозначное понимание селективности в отношении различных α1-адреноблокаторов явилось основанием для формулировки нескольких понятий.
В 2001 г. C. G. Roehrborn было предпринято еще одно исследование, задачей которого было сравнение уроселективности различных α1-адреноблокаторов. Результаты его оказались очень похожи на предыдущие: наибольшую клиническую селективность продемонстрировал альфузозин, несколько меньшую — тамсулозин. У прочих препаратов уровень простатоселективности оказался значительно ниже [12] (рис. 2).
Проведенное в 2006 г. сравнительное исследование эффективности и безопасности тамсулозина (OCAS“) и альфузозина (Дальфаз CР) — двух препаратов с замедленной формой высвобождения — продемонстрировало абсолютно равную частоту возникновения побочных эффектов, связанных с сердечно-сосудистой системой. В абсолютном выражении риск возникновения подобных эффектов был очень низким у обоих препаратов [13]. Проведенные на животных исследования показали, что альфузозин обладает весьма высокой избирательностью и специфичностью действия на α1А-адренорецепторы, которое в 40 раз превосходит его влияние на α1В-адренорецепторы [17].
Говоря о расстройстве мочеиспускания у пожилых мужчин, ДГПЖ и СНМП, нельзя не сказать и о расстройстве сексуальной функции. Это зачастую не самостоятельное заболевание, а проявление различных нарушений в организме мужчины. Распространенность и выраженность эректильной дисфункции четко коррелирует с возрастом (как и ДГПЖ) и составляет в 50 лет около 50%, в 60 лет — 60%, в 70 лет — 70%. При этом больные с симптомами нарушения акта мочеиспускания составляют 72,2% пациентов с эректильной дисфункцией [15]. Внутри одной возрастной группы частота встречаемости сексуальных расстройств прямо пропорциональна выраженности СНМП [16].
Данные нескольких международных исследований эффективности применения α1-адреноблокаторов свидетельствуют, что наряду с уменьшением выраженности СНМП, многие пациенты отмечают улучшение половой функции [16]. Предполагается, что причиной подобного эффекта является поливалентный механизм действия α-адреноблокаторов, вызывающий улучшение кровообращения органов малого таза и общее повышение качества жизни больного. На кафедре урологии МГМСУ с 1990 г. ведется работа по изучению эффективности и безопасности лечения СНМП у мужчин. Общее число пациентов, получавших с этой целью α1-адреноблокаторы, — около 2200 человек. Среднее улучшение качества жизни, измерявшееся нами при помощи вопросника QОL, составило 32%. Положительные изменения общего статуса пациента, уменьшение выраженности СНМП и улучшение показателя качества жизни и кровообращения в области малого таза выражаются улучшением показателей сексуальной активности пациентов. Исследования в этом направлении продолжаются.
На основании данных международных исследований, показателей клинической эффективности и накопленного опыта нашей кафедры наиболее часто назначается препарат альфузозин (Дальфаз).
Выпуск лекарственной формы с замедленным высвобождением (Дальфаз СР) позволил устранить пики сывороточной концентрации, связанные с приемом препарата, обеспечить постоянный уровень препарата в крови и тем самым дополнительно снизить риск развития побочных эффектов. В настоящее время на кафедре урологии МГМСУ имеется опыт его применения более чем у 1 600 пациентов с ДГПЖ.
Дальфаз-ретард в дозировке по 5 мг 2 раза в день или 10 мг 1 раз в день был применен нами у 1200 пациентов (средний возраст 64,5 года), страдающих ДГПЖ. Первую дозу препарата пациенты принимали вечером. Все пациенты отвечали стандартным рекомендациям ВОЗ по критериям включения и исключения для назначения лекарственной терапии ДГПЖ.
После первого года непрерывной терапии улучшение качества мочеиспускания было отмечено у 87% пациентов. К окончанию первого года лечения суммарный балл IPSS уменьшился на 39%, а балл QOL — на 29%. Максимальная скорость потока мочи увеличилась на 45% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. На фоне улучшения симптоматики отмечено постепенное увеличение объема простаты (в среднем на 2–4% в год) и возрастание уровня простатспецифического антигена сыворотки крови (на 4,5% в год). За время лечения возникновение тех или иных побочных эффектов отмечено у 5,7% пациентов. Наиболее частыми побочными эффектами были: жалобы на головную боль (1,6%), головокружение (0,5%) и снижение систолического артериального давления не более чем на 5 мм рт. ст. (0,5%). Причина возникновения подобных жалоб, вероятно, кроется в воздействии α1-адреноблокаторов на тонус сосудистой стенки, что закономерно, если учесть механизм их действия [1, 10, 14].
Согласно статистическому анализу, показатель эффективности равномерно распределен во всех возрастных группах больных, т. е. эффективность препарата Дальфаз не зависит от возраста пациента.
Одним из перспективных направлений применения α-адреноблокаторов у больных ДГПЖ является назначение их в комбинации с ингибиторами 5-α-редуктазы, ряды которых пополнились за последний год новым препаратом дутастерид (Аводарт). Данное сочетание воздействует на все компоненты патогенеза ухудшения качества мочеиспускания у больных ДГПЖ и позволяет существенно улучшить результаты медикаментозного лечения данного заболевания.
Опубликованное в 2003 г. исследование MTOPS (Medical Therapy of Prostate Symptom) в настоящее время является наиболее длительным и репрезентативным исследованием эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ, доказавшим перспективность такого сочетания. Влияние комбинированной терапии на риск прогрессии ДГПЖ было оценено на протяжении 4 лет наблюдения на основании анализа результатов лечения 3 047 больных ДГПЖ. По данным MTOPS, наилучшие результаты были достигнуты именно в группе комбинированной терапии — риск прогрессирования заболевания снизился на 67%. У 69% больных отпала необходимость в оперативном лечении. Риск развития острой задержки мочеиспускания был снижен на 79%. После комбинированной терапии, наименьший риск прогрессии отмечен в группе монотерапии α1-адреноблокатором. Чуть хуже этот показатель в группе монотерапии финастеридом (Финаст) [18, 19].
Вместе с тем важно отметить, что комбинированная терапия является довольно затратным вариантом лечения, и количество побочных эффектов, регистрируемых на ее фоне, превышает таковые в группах монотерапии. Несмотря на доказанную эффективность, популярность комбинированной терапии в мире пока невелика.
Учитывая высокую эффективность и малое количество побочных эффектов, селективные α1-адреноблокаторы в последние годы стали препаратами выбора в медикаментозной терапии ДГПЖ. Они применяются в лечении пациентов со слабой или умеренно выраженной симптоматикой, а также у пациентов, ожидающих операцию или желающих избежать хирургического вмешательства.
Литература
Д. Ю. Пушкарь, доктор медицинских наук, профессор
П. И. Раснер, кандидат медицинских наук
МГМСУ, Москва