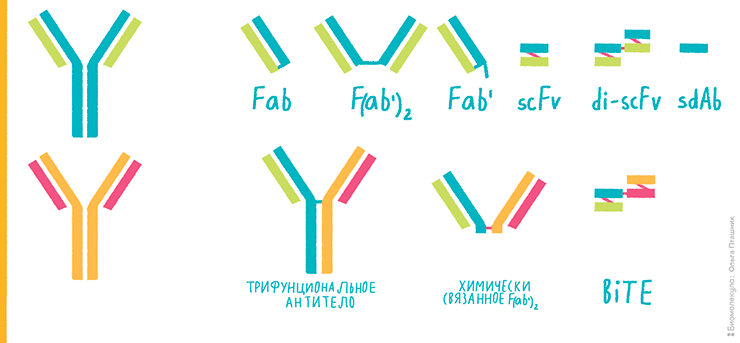Экспрессия белка что это
Экспрессия белков
Экспрессией белков называется их синтез на клеточном уровне, контролируемый определенными генами. Об их активности можно судить по интенсивности процесса, конечному результату. Экспрессия белка – это длинный процесс с транскрипцией ДНК, получением РНК и преобразованием его в активный белок.
Он жизненно важен для организма, так как участвует во всех биологических и физиологических процессах. Протеины входят в основу мышечной ткани, сердца, мозга и т. д. При снижении синтеза белков выполнение многих функций в организме нарушается.
Изменение экспрессии
С появлением пептидных комплексов было доказано, что экспрессия изменяется. В результате регистрируются положительные тенденции в активизации резервных возможностей организма. Пептидные биорегуляторы также подавляют экспрессию определенных генов, что позволяет добиться даже уменьшения опухолевых процессов.
Было доказано, что при применении пептидных комплексов в лучшую сторону меняются и данные биохимических исследований. Для примера можно рассмотреть исследование, для которого были отобраны две группы спортсменок. Физические нагрузки были одинаковы для всех. Но пептидные комплексы использовались только в основной группе, а вторая обходилась без них.
Этот эксперимент позволил определить, насколько увеличивается экспрессия при применении пептидных биорегуляторов. Когда в основной группе оценивались показатели по физнагрузкам, уровню мышечного энергообеспечения и тренированности, эти значения выросли в среднем на 10–15 процентов. У контрольной группы (не употреблявшей добавки) улучшения выявлено не было.
Спортсменки, принимавшие пептиды, показали повышение резервных возможностей организма и более высокие спортивные результаты. Это было подтверждено и результатами экспрессии генов PRAGS и PPARA. Средние значения обеих групп представлены в таблице 1.
| Гены | Основная | Контрольная | ||
| До приема пептидов | После употребления препаратов | Первое измерение | Повторное | |
| PRAGS | 0,17 ± 0,08 | 3,86 ± 0,36 | 2,36 ± 0,4 | 1,56 ± 35 |
| PPARA | 1,81 ± 0,12 | 4,53 ± 0,14 | 3,16 м ± 0,45 | 2,91 ± 0,26 |
| HSPAlA | 111,67 ± 9,4 | 328,9 ± 15,8 | 220,25 ± 13,7 | 180 ± 17,8 |
Полученные данные указывают на увеличение экспрессии под влиянием пептидных биорегуляторов. HSPAlA программирует синтез тепловых белков (70 кДа-БТШ-70), а два других гена увеличивают окислительные способности мышц скелета. Белки теплового шока относятся к основным маркерам запуска в клетке адаптивных процессов и становятся ответом на стрессовое воздействие.
Увеличение значения БТШ-70 указывает, что в лейкоцитах активизировались защитные процессы, которые помогают сохранить и усилить белковый неосинтез, прекратить фолдинг и нарушения, вызванные действием стресса, усиленными физическими нагрузками. Первые два гена из таблицы кодируют белки, способные связываться с PPAR-элементами промоторов генов, которые оказывают сильное влияние на углеводные и жировые обменные процессы, а также корректировать их транскрипцию.
Увеличение экспрессии PRAGS и PPARA и генов, которые оказываются в их подчинении, улучшает окислительные способности мышц и повышает их работоспособность. Утомляемость мышц при этом значительно снижается. В контрольной группе сильного повышения значений не было и отмечена тенденция к замедлению экспрессии HSPAlA. Таким образом, применение пептидных биорегуляторов вызвало повышение уровня здоровья у спортсменок основной группы.
Влияние пептидных комплексов на результаты биохимического исследования крови
Дополнительно было проведено биохимическое исследование. Оно зафиксировало уменьшение уровня билирубина в основной группе. Также было зафиксировано снижение количества молочной кислоты в крови, которое наблюдалось в основной группе. Это произошло вследствие улучшения энергетического обмена после воздействия биодобавок. О влиянии пептидов можно судить по результатам биохимического исследования (данные в таблице 2).
| Нормальные значения | Показатели в группах | ||
| Контрольная | Основная | ||
| Билирубин | не более 22,2 | 12,6 ± 1,3 | 16,2 ± 1,4 |
| Общий белок | 66–87 | 77,3 ± 2,62 | 78,9 ± 2,12 |
| Глюкоза | 3,6–6,11 | 4,3 ± 0,2 | 4,6 ± 0,3 |
| Холестерин | не более 5,7 | 4,3 ± 0,71 | 4,2 ± 0,21 |
| Кальций | 2,20–2,55 | 2,31 ± 0,35 | 2,29 ± 0,2 |
| Альбумины | 38–51 | 44,3 ± 2,23 | 47,2 ± 1,91 |
| АСТ | не более 32 | 16,6 ± 2,8 | 19,4 ± 3,2 |
| АЛТ | не выше 31 | 17,3 ± 1,4 | 16,2 ± 2,1 |
По результатам исследования видно, что пептидные биорегуляторы положительно влияют на процессы, которые сопровождаются нормализацией и уменьшением начальных и конечных продуктов перекисного окисления липидов. Такие биодобавки могут быть рекомендованы спортсменам для повышения квалификации. В группе контроля позитивных изменений в системе антиоксидантной защиты крови не было обнаружено.
Применение пептидных комплексов может быть рекомендовано не только в сфере спорта. Например, пептидные комплексы IPH компании Ideal Pharma Peptide позволяют добиваться улучшения ряда показателей, что положительно отражается на здоровье и качестве жизни в целом.
Однако использование препаратов возможно лишь после консультации врача. Тогда эффективность средств будет максимальной. С помощью изменения экспрессии генов можно направлять в нужное русло и белковый синтез.
Экспрессия белка что это
Белку Bcl-2 принадлежит важная роль в регуляции апоптоза. Показано, что высокая степень экспрессии опухолевой клетки Bid (белка из семейства Bcl, играющего важную роль в регуляции апоптоза и интегрирующего сигналы для митохондрий), коррелирует с неблагоприятным прогнозом РШМ [15].
В соответствии с вышеизложенным, целью исследования была оценка уровня экспрессии молекулярно-биологических маркеров p53, Ki-67, Bcl-2 и ЭФР в ткани шейки матки на различных стадиях РШМ.
Материал и методы исследования
Образцы опухолевой ткани фиксировали в нейтральном забуференном формалине с обычной стандартной проводкой и заливкой в парафин. Гистологические препараты окрашивали обычными способами и проводили иммуногистохимические исследования. В иммуногистохимической оценке экспрессии mt p53 использовали мышиные моноклональные антитела p53, клон DO-7, Ig G2b (M7001 DakoCytomation) в разведении 1:100 при времени экспозиции 60 минут. Критерием положительной реакции считалась окраска 10% и более ядер опухолевых клеток. Bcl-2 обнаруживался с помощью моноклональных антител к bcl-2, клон bcl-2/100/D5, IgGi (NCL-bcl-2 Novocastra) в разведении 1:80 при инкубации 60 минут Положительной считалась реакция при цитоплазматической и мембранной окраске более 10% опухолевых клеток. Для выявления ЭФР использовали поликлональные антитела (фирма «Dako»). Полученные в ходе исследования результаты подвергнуты обработке с использованием непараметрических статистических методов (Stata 6.0).
Результаты исследования и их обсуждение
В результате проведенных исследований установлено увеличение количества атипичных эпителиальных клеток опухоли, экспрессирующих р53 в динамике опухолевой прогрессии. При этом уровень экспрессии р53 в клетках стромы статистически значимо снижается (рис. 1).
Рис. 1. Экспрессия р53 в эпителии и строме шейки матки в динамике опухолевой прогрессии
Рис. 2. Экспрессия р53+ в клетках рака шейки матки (микрофото, увел. 600)
Результаты проведенного нами исследования по оценке экспрессии bcl-2 атипическими эпителиальными клетками представлены на рис. 3, 4.
Рис. 3. Экспрессия Bcl-2 в эпителии и строме шейки матки в динамике опухолевой прогрессии
Рис. 4. Содержание Bcl-2+ в клетках рака шейки матки (микрофото, увел.х600)
Показано резкое и значимое усиление экспрессии при местноограниченном процессе по сравнению с начальным процессом (66,67 против 33,33%) и последующее снижение экспрессии при распространенном процессе до 33,33%. Динамика экспрессии Bcl-2 в строме аналогичная (см. рис. 3).
Анализ ИГХ исследований показал, что положительная реакция с антителами к ЭФР была выявлена в группе пациентов на начальной стадии процесса в эпителиальных клетках только у одной больной (6,6%) (рис. 5).
Рис. 5. Экспрессия ЭФР в эпителии и строме шейки матки в динамике опухолевой прогрессии
В строме положительная реакция на ЭФР была выявлена в 5 случаях (3,3%). У пациентов с местно-распространенным процессом положительная реакция на ЭФР не была выявлена и в строме была выявлена в двух (33,3%) случаях (рис. 6). Также не была выявлена положительная реакция с антителами к ЭФР в эпителиальных клетках у пациенток с распространенным процессом. В строме у пациенток этой группы положительная реакция была выявлена в трех (13,3%) случаях. Согласно данным литературы экспрессия ЭФР наблюдается примерно в 40% злокачественных опухолей ЖКТ, легкого, яичников, матки [10]. При этом можно считать достоверным, что гиперэкспрессия ЭФР играет важную роль в канцерогенезе, является маркером, характеризующим биологическое поведение опухоли и позволяющим индивидуализировать подходы при назначении терапии.
Рис. 6. Экспрессия ЭФР в раковых клетках шейки матки (микрофото, увел.600)
Таким образом, определение уровня экспрессии таких биомолекулярных маркеров,. как р53, Bcl-2 и ЭФР, имеет несомненное практическое значение для оценки биологического портрета опухоли при РШМ в динамике опухолевой прогрессии. В то же время сверхэкспрессия ЭФР у больных РШМ встречается редко, что, возможно, свидетельствует о его незначительной роли в патогенезе РШМ.
Работа поддержана гос. заданием Минобрнауки России и грантом Президента РФ.
Экспрессия белка P63 в аденокарциномах легких как фактор неблагоприятного прогноза
Полный текст
Аннотация
Цель. Исследовать спектр клеточных молекулярно-биологических маркеров и выявить среди них те, которые могут быть использованы в качестве факторов прогноза клинического течения аденокарциномы легкого.
Материалы и методы. В настоящей работе был использован архивный материал 129 пациентов с подтвержденным диагнозом аденокарциномы легкого. В работе применены гистологический, иммуногистохимический, молекулярно-генетический и статистический методы.
Заключение. Была выявлена слабо выраженная тенденция к снижению безрецидивной выживаемости пациентов с р63-позитивными АК легких. Выявление экспрессии р63 в аденокарциномах легкого может рассматриваться в качестве фактора неблагоприятного прогноза и риска более быстрого прогрессирования опухолевого процесса и требует дальнейшего изучения с увеличением статистической мощности исследования.
Ключевые слова
Полный текст
Рак легких (РЛ) – гетерогенная группа злокачественных новообразований легких, которую можно разделить на 2 основные группы – мелкоклеточный рак легких (МКРЛ, менее 15%) и немелкоклеточный рак легкого (НМКРЛ). Самую обширную группу НМКРЛ составляют аденокарциномы (АК), на долю которых приходится 30-40% всех случаев РЛ. В соответствии с классификацией ВОЗ (2015) группа АК включает опухоли различного строения и степени дифференцировки [1]. Данный подтип в большинстве случаев возникает у женщин, некурящих людей и чаще располагается в периферических отделах легких [2, 3].
В норме экспрессия гена ТР63 выявляется в базальных и супрабазальных клетках плоского эпителия кожи, пищевода, матки, шейки матки, миндалин, мочевого пузыря, бронхов, молочной и предстательной желёз [11]. Этот ген играет важную роль в поддержании популяции полипотентных («стволовых») клеток в этих органах. Следует отметить, что точечные мутации в гене р63 идентифицируются редко, но достаточно часто в различных злокачественных опухолях, в том числе и в опухолях легкого, выявляют амплификацию гена и гиперэкспрессию протеина, который кодируется этим геном [12].
Цель – исследовать спектр клеточных молекулярно-биологических маркеров и выявить среди них те, которые могут быть использованы в качестве факторов прогноза клинического течения аденокарциномы легких.
Материалы и методы
В настоящей работе был использован архивный материал 129 пациентов с подтвержденным диагнозом АК легкого, которые были обследованы и лечились на базе ГБУЗ МО Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского Минздрава России с января 2014 г. по июль 2018 г. Использование биологического материала в научных целях было одобрено Локальным этическим комитетом.
Операции и диагностические биопсии произведены в торакальном отделении института. Диагноз ставился после гистологического исследования препаратов, окрашенных гематоксилином и эозином, а при необходимости – ИГХ исследования в соответствии с рекомендациями действующей классификации ВОЗ по РЛ [1].
ИГХ исследование проводили в соответствии со стандартным протоколом. Материал фиксировали в 10% забуференном формалине, срезы толщиной 4-5 мкм наносили на стекла с адгезивным покрытием, затем высушивали при 37ºС в течение ночи и еще 1 час при 60ºС. Дальше срезы подвергались депарафинации и восстановлению антигенности в зависимости от протокола, рекомендованного для каждого конкретного антитела. ИГХ реакция проводилась на операционном материале в автоматическом режиме с использованием автостейнера Ven-tana (Италия), а в диагностических биопсиях при малом объеме материала – на серийных срезах ручным методом. Была использована панель антител: цитокератины (ЦК) широкого спектра (клон АЕ1/АЕ3), ЦК высоких молекулярных весов (клон бета Е12) ЦК7, ЦК5/6, р63, TTF-1, напсин A (Dako, Cell Marque, Ventana).
Для выявления мутаций в гене EGFR в ткани РЛ использовался метод полимеразной цепной реакции в режиме реального времени с использованием набора реагентов Therascreen®EGFR RGQ PCR Kit (Qiagen, Голландия) на оборудовании Rotor-Gene Q (Qiagen, Голландия) по протоколу производителя. ДНК выделялось из парафиновых блоков с использованием набора Сobas DNA Sample Preparation Kit.
Категориальные переменные анализировали, используя процентные доли, непрерывные переменные выражали в виде средних значений и стандартных отклонений. Безрецидивную выживаемость анализировали по методу Каплана-Мейера; статистическую значимость различий выживаемости проверяли лог-ранговым критерием. Анализ факторов риска проводили с использованием одномерной регрессии Кокса. Различия считали статистически значимыми при p
Рис. 2. Схема гена ТР63 и его белков: А. Схема экзонов и соответствующие домены гена TP63; Б. Изоформы белка р63 [14, 11]
В ряде недавних исследований было показано, что ген р63 способствует трансформации стволовых клеток в направлении плоскоклеточной дифференцировки [14]. На экспериментальных моделях было продемонстрировано, что в эмбриогенезе экспрессия этого гена необходима для нормального морфогенеза эпидермиса, в т.ч. для образования зубов, волос, молочных желез, предстательной железы, потовых и слезных желез и других органов и систем [15]. При трансформации недифференцированных стволовых клеток в тканевые стволовые базальные клетки происходит формирование нормального эпителия. Во взрослом организме p63 играет важную роль в обеспечении поддержания популяции стволовых клеток в плоском и многослойном эпителии. В норме базальные, реснитчатые, бокаловидные, альвеолярные клетки также интенсивно экспрессируют р63. При этом клетки, экспрессирующие р63, рассеянны и в терминальных бронхиолах. Экспрессия р63 наблюдается также в миоэпителиальных клетках, локализованных в подслизистом слое бронхиальных желез [12, 16, 17].
В нашем исследовании экспрессия р63 была выявлена в 47,5% случаях АК легкого, а данные различных авторов в отношении частоты экспрессии этого маркера различаются. Так, по данным P.P. Mas-sion, et al. (2003) экспрессия р63 наблюдалась в 18% случаев (17 из 93) [18], по данным G. Pelosi, et al. (2002) – в 16% (15 из 95 случаев) [17], по данным F. Bir, et al. (2014) – в 25% [12], а по данным B.Y. Wang, et al. (2002) – уже в 60% случаев [19]. Очевидно, что такие различия объясняются, скорее всего, разными подходами в системе оценки.
В нашем исследовании была выявлена слабо выраженная тенденция к снижению безрецидивной выживаемости пациентов с р63-позитивными АК легких. Аналогичные данные получены и в ряде зарубежных исследований. Так, по данным M.L. Iacono, et al. (2011), экспрессия в опухолевых клетках изоформы N-терминального конца р63 достоверно ассоциировалась с выживаемостью пациентов с НПКРЛ, а при мультивариантном анализе было показано увеличение относительно риска неблагоприятного прогноза в 8,09 раз (при р=0,001). Авторы также отмечают, что выявление подобного типа белка в нормальной ткани легкого способствует ее злокачественной трансформации [20]. В исследовании T. Narahashi, et al. (2006) показана корреляция между экспрессией р63 в цитоплазме опухолевых клеток и плохим прогнозом у пациентов с АК легкого, а разница в выживаемости между группой с цитоплазматической экспрессий этого белка в опухоли и группой, где такая экспрессия отсутствовала, составила 2,16 против 4,64 [21]. В работе E. Ko, et al. (2013) показано, что р63 и ген RASSF1A являются независимыми факторами возникновения рецидивов опухолевого роста после хирургического удаления рака легкого на 1-2 стадии и без поражения лимфатических узлов [22].
В исследовании M-Ch. Aubry, et al. (2015) экспрессия р63 в АК легкого коррелировала с амплификацией гена ТР63, они выявили также сложную перестройку в гене B3GALNT1, расположенный на 3 хромосоме (3q26.1a) [23]. Однако, клиническое значение этой перестановки гена пока неясно – необходимы дальнейшие исследования в этом направлении. Амплификацию гена р63 и его экспрессию наблюдали также при дисплазии и в карциноме in-situ легкого. Это позволило авторам высказать предположение, что ген р63 и его экспрессия в клетках эпителия легких играет существенную роль в механизмах канцерогенеза.
Аномалии в гене EGFR были выявлены у 25 пациентов (31%): у 15 пациентов – del19ex, у 10 пациентов – L858R. Следует отметить, что основную группу пациентов с выявленными мутациями составили женщины (19 случаев).
Не было обнаружено зависимости между экспрессией р63 в клетках АК легкого и выявленными нарушениями в гене EGFR. Нарушения в гене р63 были выявлены как в группе позитивной по исследуемого белку, в которой имелось 5 пациентов с различными мутациями в гене (3 del19ex и 2L858R), так и в группе пациентов без экспрессии р63 (табл. 3).
Выявление мутаций EGFR у пациентов с экспрессий и отсутствием экспрессии р63
Положительная экспрессия р63
Наработка антител для доклинических и клинических испытаний
Наработка антител для доклинических и клинических испытаний
Производство антител в больших масштабах
иллюстрация Дарьи Боголюбовой-Кузнецовой
Автор
Редакторы
В прошлых статьях спецпроекта о биспецифических антителах мы говорили о том, что такое биспецифические антитела и как их разрабатывают. В этой публикации мы рассмотрим очень важный вопрос производства антител, в том числе биспецифических. Какие технологии применяются при производстве антител? Какие здесь существуют сложности и как они решаются? Насколько дорого производить такие антитела и во что обходится обеспечение качества производства?
Биспецифические антитела
Спецпроект о биспецифических антителах, особенностях их строения, свойств, получения и применения в современной медицине.
Партнер спецпроекта — компания Cytiva, занимающаяся оснащением научно-исследовательских лабораторий, фармацевтических и биотехнологических производств приборами, расходными материалами и реактивами.
Биспецифики (короткое название для биспецифических антител) способны связывать не одну мишень, как обычные моноклональные антитела, а две или более. В первой статье цикла, «Биспецифические антитела, их мишени и перспективы применения в современной медицине» [1], рассказывалось о том, какие у биспецификов преимущества по сравнению с моноспецифическими антителами, какие из них уже применяются в клинической практике и как выбирают мишени для них. Во второй статье, «Разработка биспецифических антител для применения в клинике» [2], рассказано о том, какие бывают форматы антител, какие у них преимущества и недостатки и с какими проблемами сталкиваются исследователи при их разработке. В третьей статье цикла мы расскажем, как производятся антитела и биспецифики, что такое фармацевтическая разработка и какие требования применяются к процессу производства.
Цель производства антител, как и любых других лекарств — создание эффективного, безопасного и качественного лекарственного препарата. Поскольку речь идет о здоровье людей, область разработки и производства лекарств (включая антитела) строго зарегулирована. Выпуск некачественного, а значит, неэффективного и небезопасного препарата может поставить под угрозу жизни людей. Более подробно качество рассмотрим в следующей статье цикла — «Контроль качества биотехнологических продуктов». Здесь упомянем только об основных моментах.
Обеспечение качества производства биотехнологических продуктов в целом базируется на системе менеджмента качества ISO 9001, но в приложении именно к лекарствам говорят о фармацевтическом качестве, под которым понимается пригодность действующего вещества и лекарственного препарата для своего целевого назначения. Проще говоря, у любого лекарства есть цель: улучшить состояние человека. С другой стороны, у него есть объективные характеристики, самые главные из них — подлинность, дозировка и чистота [3]. Если характеристики препарата позволяют достичь указанной цели, он называется качественным.
Вкратце рассмотрим, как регулируется качество при разработке антител и биспецификов, а затем — как оно обеспечивается в процессе производства и контроля.
Регуляторные требования к разработке антител
The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, Международный совет по гармонизации технических требований к регистрации лекарственных средств для медицинского применения.
Лекарственная субстанция (активный фармацевтический ингредиент) — вещество, которое войдет в состав готового лекарственного продукта и которое производит фармакологический эффект.
Спецификацией, в соответствии с ICH Q6A, называется перечень тестов, ссылок на аналитические процедуры и критерии допустимости, включающие численные границы и диапазоны допустимых величин [3].
Валидация — это документальное доказательство того, что процесс надежно приводит к желаемому результату. В ходе валидации сначала проводят проверку помещений и оборудования на соответствие спецификациям, проверку правильности работы оборудования и, наконец, квалификацию самого процесса производства продукта в условиях, близких к реальным [4].
Именно поэтому любое изменение процесса производства биопрепаратов требует специальных исследований, чтобы доказать, что оно не сказалось негативно на профиле безопасности и эффективности препарата. По этой же причине в случае биопрепаратов не говорят о дженериках, когда идет речь о копии препарата, выпущенной другой фирмой, а используют термин «биоаналог» (biosimilar).
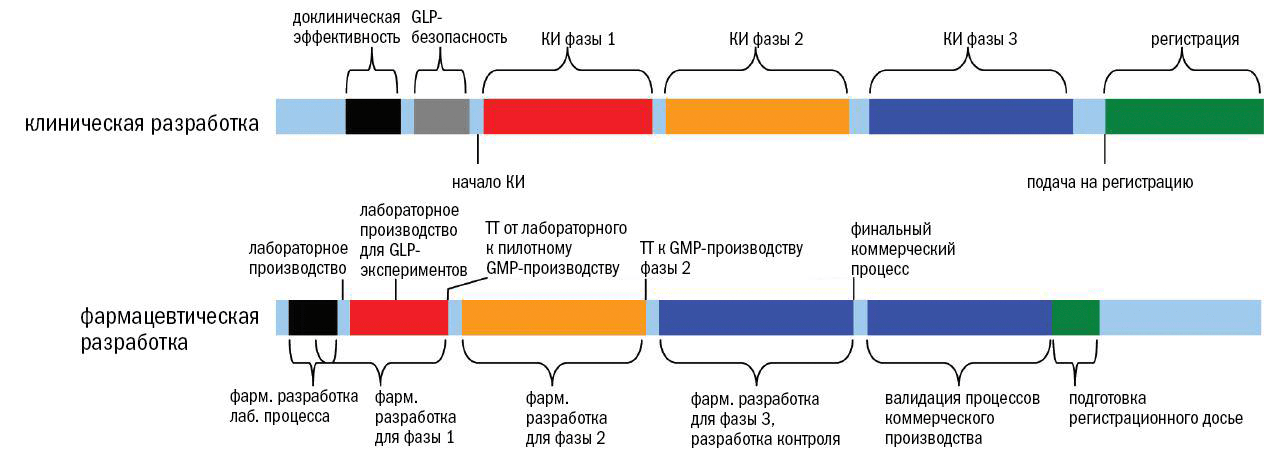
В соответствии с руководством ICH Q10, подход к обеспечению качества фармацевтических препаратов зависит от стадии разработки (рис. 1).
По мере перехода продукта от доклинических к клиническим исследованиям (о которых подробно рассказано в спецпроекте «Клинические исследования») правила ужесточаются, и регулирование достигает максимума для продукта, выходящего на рынок, когда риску подвергаются тысячи, а иногда и миллионы людей.
Правила GMP начинают действовать на позднем этапе доклинических исследований, когда проводятся исследования безопасности препарата на животных по правилам «Надлежащей лабораторной практики» (GLP, Good laboratory practice).
Как устроено производство антител?
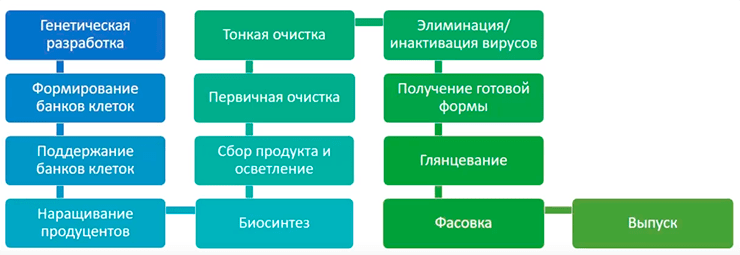
Общая схема производства биотехнологических препаратов, в частности, антител, приведена на рисунке 2.
Рисунок 2. Общая схема производства антител подпись
Выбор системы экспрессии
Систему экспрессии необходимо выбрать в самом начале разработки, так как от нее будет зависеть, какую нужно создать генетическую конструкцию. Если антительный продукт не требует гликозилирования и относительно небольшой — например, Fab-фрагмент, scFv или диабоди (рис. 3; более подробно о различных форматах биспецификов рассказано в предыдущей статье цикла — «Разработка биспецифических антител для применения в клинике» [2]), — то можно экспрессировать его в бактериальных клетках. Чаще всего используют кишечную палочку Escherichia coli, как наиболее изученный организм, оптимизированный для продукции белков.
Рисунок 3. Конструкции на основе комбинаций фрагментов антител. Исходные антитела нарисованы слева сине-зеленым и оранжево-розовым.
Особенности экспрессии в E.coli
Если попытаться экспрессировать антительный фрагмент в штамме E. coli без специальных ухищрений, белок не сможет правильно свернуться и образует внутри клеток агрегаты, которые называются тельцами включения. Из них можно извлечь концентрированный активный белок, но этот процесс плохо масштабируется. Поэтому разработаны подходы, позволяющие получать белок сразу в растворимой форме. Во многих случаях к нему генноинженерным методом присоединяют сигнальный пептид, который вызывает транслокацию продукта через цитоплазматическую мембрану в периплазму. Более окислительное окружение периплазмы по сравнению с цитоплазмой позволяет белкам правильно свернуться и находиться в растворимом состоянии, что существенно облегчает последующую очистку.
Для увеличения выходов белка применяют одновременную экспрессию шаперонов E. coli, которые позволяют белку правильно свернуться [6].
Для экспрессии полноразмерных антител и IgG-биспецификов лучше использовать эукариотические системы, которые обеспечивают правильное гликозилирование белков, необходимое для их функционирования.
Были попытки производить антитела и их фрагменты в клетках дрожжей, грибов, простейших и насекомых, но на нынешний момент 95% антител на рынке производится в клетках млекопитающих. Аппарат свертывания белков, посттрансляционных модификаций и секреции позволяет производить антитела, практически неотличимые от природных. Это важно для снижения риска иммуногенности, который возрастает при любых чужеродных модификациях [6].
Наиболее часто используют клетки яичников китайского хомячка (Chinese hamster ovary, CHO). Также на рынке есть антитела, получаемые в клетках мышиной миеломы NS0 и Sp2/0.
Разработка генетической конструкции
Более подробно про разработку генетической конструкции (плазмиды, или вектора) для экспрессии антител мы рассказывали в статье «Биотехнология антител» [7]. Если коротко, то сначала с помощью одного из дисплейных методов получают генетическую последовательность, кодирующую нужное антитело. Затем ее встраивают в вектор (конструкцию, которая обеспечит экспрессию гена в клетке-хозяине). В итоге получают плазмиду, то есть кольцевую ДНК, содержащую всё необходимое для экспрессии нужного гена.
В случае антител плазмида содержит гены, кодирующие легкую и тяжелую цепи антитела, высокоэффективный промотор (последовательность ДНК, служащая сигналом начала транскрипции гена), гены устойчивости к антибиотикам и другим селективным агентам (чтобы клетки не избавлялись от плазмиды) и последовательности, способствующие повышению уровня транскрипции и трансляции.
Транзиентная экспрессия без встраивания плазмиды в геном тоже используется, но не в промышленных процессах производства, так как клетки быстро теряют целевой участок ДНК, и больших выходов белка добиться не удается.
Секвенирование — определение нуклеотидной последовательности ДНК или РНК. Подробнее — в статье «12 методов в картинках: секвенирование нуклеиновых кислот» [9].
Затем происходит проверка, насколько экспрессионная конструкция генетически стабильна, и не элиминируется ли она в процессе клеточных делений. Если все в порядке, то получившаяся клеточная линия с привнесенной целевой генетической конструкцией далее используется для наработки антител.
Разработка клеточной линии
Клон — генетически однородное потомство одной клетки. О работе с клетками более подробно рассказано в статье «12 методов в картинках: клеточные технологии» [10].
Делеция — удаление гена или его фрагмента.
Влияние дефукозилирования на ADCC было подробнее описано в статье «Биотехнология антител» [7].
Сейчас уже существуют клеточные линии, которые оптимизированы для экспрессии IgG-антител. Однако в случае биспецифических продуктов, как правило, требуется индивидуальный подход.
В конце концов выбирают финальный клон, который, уже в GMP-условиях, дает начало главному банку клеток (master cell bank, MCB). Его разделяют на сотни аликвот (идентичных частей) и хранят в жидком азоте при температуре −150 °С [13]. Также в ходе выбора клона проверяют профиль гликозилирования и его постоянство, склонность белка к агрегации и другие ключевые параметры [11].
Очень важно выбрать правильный клон как можно раньше, в идеале — до начала клинических исследований. Смена клона перед фазой 3 клинических исследований или позже потребует проведения дополнительного исследования сопоставимости продуктов, полученных на основе разных клонов [12].
По мере необходимости из главного банка отбирают очередную пробирку, размораживают, культивируют находящиеся там клетки и получают рабочий банк (working cell bank, WCB) — также сотни пробирок, которые хранятся в другом месте и являются основой для производства.
MCB и WCB тестируются на генетическую стабильность в течение как минимум 60 поколений клеток, чтобы обеспечить нужные параметры клеточной линии при производстве. Для этого клетки выращивают в культуральной среде, периодически пересевая и секвенируя кДНК целевого гена.
кДНК — комплементарная ДНК, которая синтезируется на мРНК с помощью обратной транскриптазы.
С создания банка клеток начинается собственно процесс производства белка. Он делится на две крупные стадии: процесс синтеза (upstream processing, USP) и процесс выделения и очистки (downstream processing, DSP). В USP входят все стадии от создания банка клеток до сбора продукта, то есть до начала очистки белка. В DSP входят все стадии от начала очистки до разлива по флаконам, то есть до получения готового продукта.
Процесс синтеза
Основной задачей разработки upstream processing при производстве антитела является максимизация выхода белка без ущерба для его качества.
Имеется в виду масса антитела в объеме культуральной жидкости.
Оптимизация состава среды
Состав среды для культивирования претерпел значительные изменения за последние десятилетия. Так, в 1980-е годы отказались от использования сред на основе сыворотки животных из-за нестабильности их состава, а затем отказались и от использования любых компонентов животного происхождения в пользу химически определенных сред. Например, в среде HyClone ADCF-mAb компании Cytiva, специально разработанной для производства антител, такие компоненты отсутствуют. В состав таких сред входят аминокислоты, витамины, неорганические соли и инсулин или инсулиноподобные факторы роста [14].
Материал предоставлен партнёром — компанией Cytiva
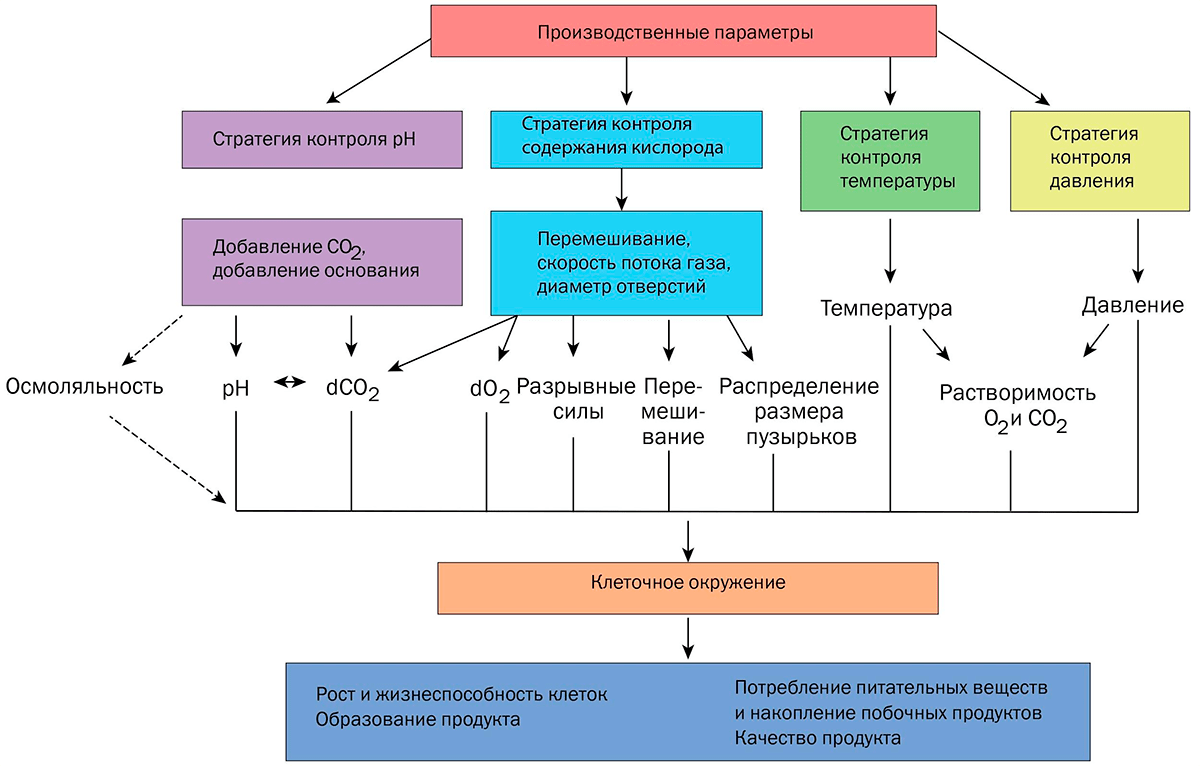
Помимо состава среды, оптимизации подлежат параметры культивирования, как физические: температура, потоки газов, скорость перемешивания; так и химические: количество растворенных кислорода и углекислого газа, рН, осмотическое давление, окислительно-восстановительный потенциал (рис. 4) [14].
Рисунок 4. Операционные параметры процесса культивирования влияют на производительность и качество продукта
Два основных способа производства белков — в биореакторах с периодической загрузкой (fed-batch) и с непрерывной перфузией (continuous perfusion). Второй способ с использованием одноразовых (single-use) контейнеров вместо традиционных ферментёров из нержавеющей стали наиболее перспективен [14]. Использование одноразовых контейнеров более выгодно несмотря на то, что стоимость расходных материалов выше: зато снижаются затраты на стерилизацию, а особенно на валидацию и контроль стерильности.
Одноразовое оборудование
Помимо экономии на процессах стерилизации, затраты на развертывание single-use-системы меньше, чем традиционной. Компания Cytiva и ее подразделение HyClone — одни из лидеров в производстве single-use-систем. Линейка продуктов Cytiva покрывает весь спектр масштабов разработки и производства. В нее входят биореакторы WAVE волнового типа для ранних стадий отработки условий культивирования и вертикальные ротационные биореакторы с лопастной мешалкой на магнитном приводе Xcellerex всех размеров: от лабораторной установки Xcellerex XDR 10 объемом 4,5–10 л до пилотных и промышленных установок Xcellerex XDR 50-2000 (рис. 5) объемом 50, 200, 500, 1000 и 2000 л.
Рисунок 5. Линейка single-use-биореакторов Xcellerex XDR
Важным преимуществом является то, что все установки, от лабораторной до промышленной, не отличаются по материалу, контактирующему с культуральной жидкостью, по гидродинамическим параметрам и по способам контроля за ростом клеток, что делает масштабирование более простым. Также очень удобно, что крупные биореакторы Xcellerex XDR могут использоваться как в периодическом, так и в непрерывном режиме.
На базе этих реакторов компания разработала платформу FlexFactory, которая позволяет быстро развернуть и настроить производство антител мощностью до 100 кг белка в год и с себестоимостью на 30% ниже, чем у систем из нержавеющей стали.
Материал предоставлен партнёром — компанией Cytiva
Непрерывная перфузия свежих исходных веществ, причем с обратной связью о текущем состоянии реактора, и удаление продуктов и токсичных отходов позволяют добиться очень высокой плотности клеток. Как показало математическое моделирование, применение непрерывного процесса с одноразовыми реакторами позволяет сэкономить до 30% средств на производство [15].
Процесс выделения и очистки
Процесс выделения и очистки (DSP) в производстве антител довольно хорошо отработан, и прогресс в этой области не такой стремительный, как в USP. Однако здесь также существует тенденция к максимальному переходу от периодических процессов к непрерывным, что позволяет автоматизировать и удешевить процесс.
Поскольку сейчас для наработки белков используют клеточные линии, секретирующие белки во внешнюю среду, необходимо после культивирования удалить клетки, отделив жидкость, содержащую целевое антитело. Это делают, как правило, с помощью фильтрации или центрифугирования. Для обоих методов существуют подходы, которые позволяют интегрировать эти процессы в непрерывный производственный цикл [16].
Затем проводят аффинную хроматографию с белком А. Это белок клеточной стенки золотистого стафилококка, который сильно и селективно связывается с антителами при нормальном рН и слабо — при пониженном. На колонку с иммобилизованным белком А наносят раствор, содержащий антитело, а затем смывают раствором с рН 3,5 [14]. При такой же кислотности среды производят вирусную инактивацию: раствор выдерживают при ней 0,5–2 часа [17].
После еще одной стадии вирусной инактивации (часто используется ультрафиолет или фильтрация) промежуточный продукт концентрируют с помощью ультрафильтрации до концентрации, соответствующей конечному продукту [14].
Ультрафильтрация — фильтрация через мембрану под давлением.
Непрерывная очистка
Так как стадии хроматографической очистки и фильтрации составляют 50–80% себестоимости производства антител [19], идет постоянный поиск подходов, которые бы позволили снизить эти расходы. Так, в 2012 году с использованием колонок Cytiva ÄKTA впервые удалось интегрировать перфузионный биореактор и непрерывную очистку антитела [16]. Таким образом, все стадии процесса производства — и USP, и DSP — были объединены в один непрерывный процесс.
В другом исследовании возможности интеграции DSP продемонстрировали с использованием хроматографической системы ÄKTA Avant 25 (рис. 6): для выделения антител из культуральной жидкости после культивирования в 25-литровом биореакторе использовали восемь колонок с белком А в приборе ÄKTA Avant. Затем после вирусной инактивации продолжили очистку на анионообменной мембране и катионообменном носителе. Процесс выполняли в непрерывном интегрированном режиме на протяжении 30 циклов. Концентрация белков клетки-хозяина снизилась на 4,5 порядка, высокомолекулярных агрегатов — вдвое (до
Рисунок 6. Хроматографическая система ÄKTA Avant с автоматическим сэмплером (прибором для подачи образцов — слева). Система поставляется с программным обеспечением для проектирования экспериментов.
Для масштабирования процесса очистки антитела компания Cytiva разработала хроматографическую систему ÄKTA pilot 600. Это настольная система с модульным дизайном, которая поставляется в двух вариантах: для GMP и для не-GMP производств. Благодаря большой гибкости она может использоваться с колонками любых типов, разных размеров и на разных скоростях. Так, в одной работе было выполнено масштабирование в 20 раз: сперва процесс очистки на носителе MabSelect™ PrismA с белком А проводили в колонке объемом 70 мл (HiScale 26), затем — 1400 мл (AxiChrom 100), и получили при этом схожие хроматограммы. Более того, хроматограмма совпала и с результатом, полученным на системе меньшего масштаба ÄKTA Avant. Такая сопоставимость значительно облегчает процесс масштабирования очистки белка и делает его более предсказуемым [21].
Материал предоставлен партнёром — компанией Cytiva
Разработчики биспецификов наткнулись на множество проблем при производстве, так как в ходе USP разнообразие генерируемых форм может быть сложнее, чем для антител, поэтому требуется более тщательная очистка от примесей и тонкий контроль их наличия на этапе DSP [14]. В случае IgG-биспецификов процесс очистки облегчается благодаря наличию Fc-фрагмента, который связывается с белком А. Если же биспецифик не содержит Fc-фрагмента, то условия очистки приходится подбирать индивидуально, как для любого терапевтического белка — в этом случае на первом этапе используют ионообменную или гидрофобную хроматографию [22].
Масштабирование производства
Как мы уже говорили, фармацевтическая разработка начинается еще на этапе доклинических исследований. По мере приближения к клиническим исследованиям возрастают как регуляторные требования к качеству продукта, так и потребности в продукте. Происходит переход от небольших колб, реакторов волнового типа, лабораторных пятилитровых ферментеров к пилотным биореакторам объемом 25–100 л. Оказывается, что те хроматографические смолы и прочие расходные материалы, которые были пригодны на лабораторном этапе, не годятся для очистки продукта в больших объемах. Кроме того, многие из этих вспомогательных материалов не отвечают критериям GMP-производства. Поэтому требуются специальные усилия по масштабированию и подбору новых условий для USP и DSP.
Потребности в продукте на этапе ранних клинических исследований невелики — суммарно в них принимает участие, как правило, несколько сотен человек, поэтому нескольких десятков граммов антитела может оказаться достаточно. Другое дело — фаза 3 клинических исследований и особенно коммерческое производство. Здесь требуется производство в масштабах нескольких килограммов белка в год, а значит, объем реакторов увеличивается до 2000–20 000 литров. Требования к контролю качества здесь достигают максимума (см. видео).
В зависимости от полноты доклинических данных и степени внесенных при масштабировании изменений могут потребоваться дополнительные клинические исследования для доказательства сопоставимости версий продукта, произведенных до и после масштабирования.
Важным элементом разработки процесса производства является разработка формуляции, то есть состава готового продукта. Помимо действующего вещества (субстанции), туда входят растворитель, буферные и вспомогательные вещества, обеспечивающие длительную стабильность при хранении. Все они также должны быть произведены с выполнением требований GMP. После получения готового продукта проводят исследования стабильности для доказательства того, что продукт сохраняет надлежащее качество в течение всего срока хранения.
Разработка и производство бевацизумаба
Для примера рассмотрим, как выглядел процесс фармацевтической разработки бевацизумаба и как он сейчас производится [23].
Бевацизумаб («Авастин») — антитело компании Genentech/Roche против фактора роста сосудов VEGF. Применяется для лечения ряда злокачественных заболеваний — колоректального рака, рака легких, молочной железы, яичников, почек, глиобластомы.
Вначале мышей иммунизировали рекомбинантным человеческим VEGF с пришитым к нему адъювантом и получили гибридомы, продуцирующие мышиное моноклональное антитело. Затем провели гуманизацию вариабельных доменов антитела: вставили последовательности человеческих участков, определяющих комплементарность (complementarity-determining regions, CDR) и ввели ряд мутаций, после чего вариабельные домены были объединены с человеческими константными доменами.
Плазмиду, кодирующую тяжелые и легкие цепи бевацизумаба, ввели в клетки CHO-DP12 с помощью липофекции. При этом ДНК в некоторых клетках перешла в линейную форму и встроилась в геном. Данный штамм СНО дефектен по важнейшему ферменту дигидрофолатредуктазе (DHFR), которая, в частности, способна расщеплять токсичное соединение метотрексат [24]. Плазмида с генами цепей бевацизумаба несет также ген DHFR, поэтому при культивировании в присутствии метотрексата выживают только те клетки, у которых плазмида встроилась в геном.
В присутствии возрастающих концентраций метотрексата отобрали клоны, секретирующие активный бевацизумаб. Один из клонов использовали для доклиники, фазы 1 и фазы 2 клинических исследований, одновременно с этим проводили его оптимизацию для повышения продуктивности. Оптимизированный клон использовали уже для фазы 3 и коммерческого производства.
О пептидном картировании можно более подробно прочесть в статье «12 методов в картинках: протеомика» [25].
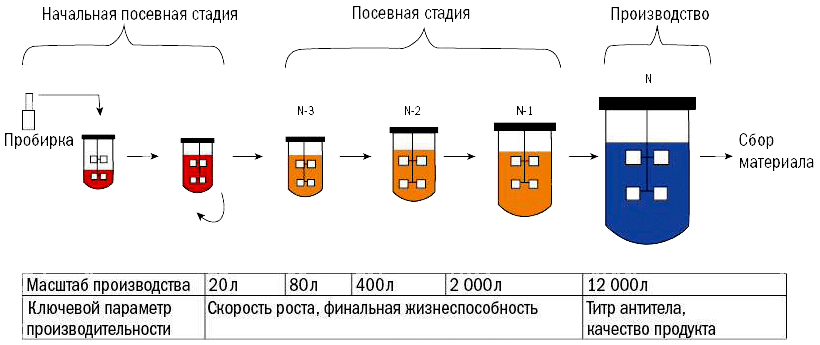
Культивирование бевацизумаба состоит из трех стадий: начальной посевной (seed), посевной (inoculum) и производственной (production). На начальной стадии культивирование ведется в объеме 20 л в присутствии метотрексата (показано, что такое селективное давление приводит к амплификации вставки [26]), каждые 3–4 дня клетки пересевают в новую среду с разбавлением. После нескольких таких циклов готовят посевной материал уже без метотрексата, чтобы уменьшить его перенос в производственную культуру. Посевная культура последовательно пересевается в ферментёры объемом 80, 400 и 2000 л. Затем переходят к производственной культуре в объеме 12 000 л (рис. 7). Через установленное количество дней производственную культуру собирают и центрифугируют для отделения клеток от бесклеточного экстракта, содержащего бевацизумаб. Здесь заканчивается USP и начинается DSP.
Рисунок 7. Процесс производства бевацизумаба и ключевые параметры производительности
Очистка лекарственной субстанции бевацизумаба производится в четыре этапа: хроматография на белке А (с последующей вирусной инактивацией), анионообменная хроматография на Q-сефарозе FF (углеводный полимер), катионообменная хроматография на СМ-сефарозе FF и ультрафильтрация.
Для изучения сопоставимости субстанций, произведенных на разных заводах, использовали следующие аналитические методы:
Анализ на биологическую активность бевацизумаба основан на его способности ингибировать пролиферацию эндотелиальных клеток пуповинной вены человека (HUVEC) под действием VEGF.
Разработку готового лекарственного продукта проводили с целью получения стабильной жидкой формуляции для внутривенного введения. Перед началом клинических исследований выбрали формуляцию на основе гистидинового буфера с добавлением полисорбата 20 (поверхностно-активного вещества, препятствующего агрегации и дентаурации белков [27]) и дигидрата трегалозы (дисахарида, добавляемого для достижения нужной осмоляльности [28]). Однако в ходе первых клинических исследований оказалось, что состав надо менять, так как продукт недостаточно стабилен. Гистидиновый буфер заменили на натрий-фосфатный, снизили концентрацию трегалозы, повысили содержание полисорбата. Исследования стабильности показали, что препарат хранится три месяца при 30 °C и два года — при 5 °C.
Осмоляльность — характеристика раствора, отражающая суммарную концентрацию всех растворенных веществ. Осмотическое давление раствора, который вводится внутривенно, должно быть близко к осмотическому давлению крови.
Последней стадией подготовки финального продукта является асептический разлив и закупорка. Проводят фильтрацию продукта в атмосфере азота и разливают по флаконам с предварительной обработкой всех линий и емкостей горячим паром. За один цикл производства получается до 83 000 флаконов по 400 мг бевацизумаба в каждом, то есть до 33,2 кг белка [23].
Стоимость производства
R&D (research and development) — исследования и разработка.
Из нашей статьи видно, что производство воспроизведенных антительных лекарств (они называются биоаналогами, или biosimilars, в отличие от дженериков для малых молекул) — непростое дело, ведь нужно выстроить и валидировать процесс, который обеспечит получение качественного препарата, не очень отличающегося по характеристикам от оригинального. Именно поэтому выходящие на рынок биоаналоги стоят не в десять раз дешевле, как дженерики, а всего на 30–40% меньше. Хотя, как мы видим, потенциал для снижения стоимости еще есть.
Проблемы и перспективы
Несмотря на стремительный прогресс в области производства белков, пространство для улучшений остается. Разработка производства — все еще длительный, дорогостоящий процесс, который зачастую ведется методом проб и ошибок. Даже обычные IgG-антитела против разных мишеней, несмотря на одинаковое строение, ведут себя по-разному в отношении экспрессии, очистки, стабильности и свойств. Что уж говорить о биспецифических антительных продуктах, для которых пока не накоплен обширный опыт масштабирования и производства. Как говорилось в статье «Разработка биспецифических антител для применения в клинике» [2], существует более 60 форматов биспецификов, и многие из них сильно отличаются друг от друга по структуре. Поэтому невозможно создать одну платформу, которая бы позволила производить биспецифики разных форматов [22]. Почти в каждом случае здесь пока требуется индивидуальный подход [30]. Однако большинство методов, изложенных в нашей статье, применимо и к биспецифическим продуктам независимо от их природы.
Понятно, что чем хуже отработан процесс, тем выше его себестоимость. Снижение себестоимости производства и ускорение его разработки — основные потребности в этой области. Помимо описанной в статье тенденции перехода к одноразовым реакторам и непрерывным процессам, одна из заметных тенденций в области разработки процесса производства — максимальная автоматизация операций. Так, выбор наиболее продуктивного клона может вестись в полуавтоматическом режиме с использованием роботов для работы с планшетами и последующим пересевом клеток в микрореакторы объемом от долей миллилитра до нескольких десятков миллилитров, имитирующие условия культивирования в ферментерах (см. видео). Расширяется использование датчиков с обратной связью, сопряженных с автоматическими устройствами дозирования, для тонкой подстройки условий культивирования по мере роста клеток.
Безусловно, дальнейшие исследования в области метаболизма клеток, состава сред, контроля процессов производства и очистки позволят сделать разработку процессов производства антител более простой, а само производство — еще более надежным и дешевым.