Эпо препарат что это
ИНСТРУКЦИЯ
по медицинскому применению лекарственного препарата
Торговое наименование препарата
Международное непатентованное наименование
Лекарственная форма
раствор для внутривенного и подкожного введения
Состав
1 мл раствора содержит:
Рекомбинантный эритропоэтин человека 500 ME или 2000 ME.
Описание
Прозрачная бесцветная жидкость
Фармакотерапевтическая группа
Код АТХ
Фармакодинамика:
Фармакокинетика:
При внутривенном введении Эритропоэтина у здоровых лиц и больных с уремией период полувыведения составляет 5-6 ч. При подкожном введении Эритропоэтина его концентрация в крови нарастает медленно и достигает максимума в период от 12 до 28 ч после введения период полувыведения составляет 13-28 ч. При внутривенном введении период полувыведения составляет 4-12 ч. Биодоступность Эритропоэтина при подкожном введении составляет 25-40 %.
Показания:
Лечение анемии почечного генеза у больных хронической почечной недостаточностью в т.ч. находящихся на диализе.
Профилактика и лечение анемии у взрослых больных с солидными опухолями получающих химиотерапию препаратами платины которые могут вызвать анемию (карбоплатин 75 мг/м2 на цикл карбоплатин 350 мг/м2 на цикл).
Лечение анемии у взрослых больных миеломной болезнью неходжкинскими лимфомами низкой степени злокачественности и хроническим лимфоцитарным лейкозом получающих противоопухолевую терапию при относительной недостаточности эндогенного эритропоэтина (она определяется как концентрация эритропоэтина в сыворотке непропорционально низкая относительно степени анемии).
Увеличение объема донорской крови предназначенной для последующей аутотрансфузии. При этом преимущества применения эпоэтина бета нужно соотнести с повышением риска тромбоэмболий при его применении. Больным с умеренной анемией (уровень гемоглобина 100-130 г/л или гематокрита 30-39 % без дефицита железа) препарат назначают только в том случае если получить достаточное количество консервированной крови не представляется возможным а плановое крупное оперативное вмешательство может потребовать большого объема крови (>4 единиц для женщин или >5 единиц для мужчин).
Профилактика анемии у недоношенных новорожденных родившихся с массой тела 750- 1500 г до 34 недели беременности.
Противопоказания:
Повышенная чувствительность к препарату или его компонентам парциальная красноклеточная аплазия после ранее проведенной терапии каким-либо эпоэтином бета неконтролируемая артериальная гипертензия невозможность проведения адекватной антикоагулянтной терапии инфаркт миокарда в течение месяца после события нестабильная стенокардия или повышенный риск тромбоза глубоких вен и тромбоэмболий в рамках преддепозитной программы сбора крови перед хирургическими операциями порфирия.
С осторожностью:
Беременность и лактация:
Так как достаточного опыта применения эритропоэтина при беременности и в период грудного вскармливания у человека нет Эритропоэтин следует назначать только в том случае если ожидаемые преимущества от его применения превышают возможный риск для плода и матери.
Способ применения и дозы:
Лечение анемии у больных с хронической почечной недостаточностью
Лечение Эритропоэтином проводится в 2 этапа:
Начальная терапия (стадия коррекции). При п/к введении начальная доза составляет 20 МЕ/кг массы тела 3 раза в неделю. При недостаточном повышении гематокрита (менее 05 % в неделю) дозу можно увеличивать ежемесячно на 20 МЕ/кг массы тела 3 раза в неделю. Суммарную недельную дозу можно делить также на ежедневные введения в меньших дозах или вводить за один прием.
Для поддержания гематокрита на уровне 30-35 % сначала дозу следует уменьшить наполовину от дозы в предыдущей инъекции. Впоследствии поддерживающую дозу подбирают индивидуально с интервалом в 1-2 нед. При п/к введении недельную дозу можно вводить однократно или за 3-7 введений в неделю.
У детей доза зависит от возраста (как правило чем меньше возраст ребенка тем более высокие дозы эпоэтина бета ему требуются). Однако поскольку предсказать индивидуальный ответ не представляется возможным начинать целесообразно с рекомендованного режима.
Лечение Эритропоэтином проводится как правило пожизненно. При необходимости его можно прервать в любое время.
Профилактика анемии у недоношенных новорожденных.
П/к в дозе 250 МЕ/кг массы тела 3 раза в неделю. Лечение эпоэтином бета должно начинаться как можно раньше предпочтительно с 3 дня жизни и продолжаться 6 нед.
Профилактика и лечение анемии у больных с солидными опухолями.
П/к разделяя недельную дозу на 3-7 введений.
Если во время первого цикла химиотерапии уровень гемоглобина несмотря на лечение эпоэтином бета снижается более чем на 10 г/л дальнейшее применение препарата может быть неэффективно.
Следует избегать повышения гемоглобина более чем на 20 г/л в месяц или до уровня выше 140 г/л. При возрастании гемоглобина более чем на 20 г/л в месяц дозу эпоэтина бета необходимо снизить на 50 %. Если уровень гемоглобина превышает 140 г/л препарат отменяют до тех пор пока он не снизится до уровня 90 80 33%) позволяет осуществить забор крови эпоэтин бета вводят в конце процедуры. На протяжении всего курса лечения гематокрит не должен превышать 48%.
Дозу препарата определяет врач-трансфузиолог и хирург индивидуально в зависимости от того какой объем крови будет взят у больного и от его эритроцитарного резерва. Объем крови который будет взят у больного зависит от предполагаемой кровопотери имеющихся в наличии методик консервации крови и общего состояния больного; он должен быть достаточным для того чтобы избежать переливания крови от другого донора. Объем крови который будет взят у больного выражается в единицах (одна единица эквивалентна 180 мл эритроцитов).
Возможность донорства зависит главным образом от объема крови у данного пациента и исходного гематокрита. Оба показателя определяют эндогенный эритроцитарный резерв который можно рассчитать по следующей формуле:
женщины: объем крови (мл) = 41 (мл/кг) х масса тела (кг) + 1200 (мл)
мужчины: объем крови (мл) = 44 (мл/кг) х масса тела (кг) + 1600 (мл) (при массе тела >45 кг).
Показание к применению Эритропоэтина и его разовая доза определяются по номограммам исходя из требуемого объема донорской крови и эндогенного эритроцитарного резерва.
Побочные эффекты:
Нежелательные реакции перечислены в соответствии со следующей градацией: часто (>1 % 01 % 001 %
Эритропоэтин (Erythropoietin)
Владелец регистрационного удостоверения:
Произведено:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Эритропоэтин
Фармакологическое действие
Рекомбинантный эритропоэтин человека (очищенный гликопротеин), состоящий из 165 аминокислот, который, являясь митогенным фактором и гормоном дифференцировки, способствует образованию эритроцитов из частично детерминированных клеток-предшественников эритропоэза. Рекомбинантный эпоэтин бета, полученный методом генной инженерии, по своему аминокислотному и углеводному составу идентичен эритропоэтину человека.
Эпоэтин бета после в/в и п/к введения увеличивает число эритроцитов, ретикулоцитов и уровень гемоглобина, а также скорость включения железа ( 59 Fe) в клетки, специфически стимулирует эритропоэз, не влияя на лейкопоэз. Цитотоксического действия эпоэтина бета на костный мозг или на клетки кожи человека не выявлено.
Фармакокинетика
Показания активных веществ препарата Эритропоэтин
Симптоматическая анемия при хроническом заболевании почек у пациентов, находящихся на диализе; симптоматическая анемия почечного генеза у пациентов, еще не получающих диализ; лечение симптоматической анемии у взрослых пациентов с солидными и гематологическими немиелоидными опухолями, получающих химиотерапию; профилактика анемии у недоношенных новорожденных, родившихся с массой тела 750-1500 г до 34-й недели беременности. Увеличение объема донорской крови, предназначенной для последующей аутотрансфузии. Следует принимать во внимание зарегистрированный риск возникновения тромбоэмболических явлений. Использование по этому показанию показано только у пациентов с умеренной анемией (Нb 100-130 г/л (6.21-8.07 ммоль/л), без дефицита железа), если получить достаточное количество консервированной крови невозможно, а плановое крупное элективное оперативное вмешательство может потребовать большого объема крови (>4 единиц для женщин или >5 единиц для мужчин).
Режим дозирования
Побочное действие
Со стороны сердечно-сосудистой системы: артериальная гипертензия, гипертонический криз, тромбозы шунтов.
Со стороны нервной системы: энцефалопатия (чаще при гипертонических кризах), головная боль, спутанность сознания.
Со стороны системы кроветворения: парциальная красноклеточная аплазия (ПККА).
Со стороны кожи и подкожных тканей: синдром Стивенса-Джонсона.
Со стороны лабораторных показателей: снижение содержания ферритина в плазме с одновременным повышением показателя гемоглобина, увеличение уровня калия и фосфатов в плазме.
Прочие: гриппоподобный синдром, местные реакции.
Противопоказания к применению
Рефрактерная анемия при наличии бласттрансформированных клеток, тромбоцитоз, эпилепсия и хроническая печеночная недостаточность. Масса тела менее 50 кг для увеличения объема донорской крови для последующей аутотрансфузии.
Применение при беременности и кормлении грудью
При беременности и в период грудного вскармливания эпоэтин бета применяют только в том случае, когда предполагаемая польза для матери превышает потенциальный риск для плода или ребенка.
В экспериментальных исследованиях тератогенного действия не выявлено.
Применение при нарушениях функции печени
С осторожностью применяют при хронической печеночной недостаточности.
Применение при нарушениях функции почек
Применение у детей
Возможно применение у детей по показаниям, в рекомендуемых соответственно возрасту дозах и схемах.
При лечении анемии, ассоциированной с хроническим заболеванием почек, эпоэтин бета не следует назначать детям в возрасте до 2 лет.
Особые указания
На фоне терапии эпоэтином бета следует регулярно контролировать показатели тромбоцитов, гематокрита и гемоглобина.
Следует с осторожностью применять эпоэтин бета при рефрактерной анемии при наличии бласттрансформированных клеток, эпилепсии, тромбоцитозе и хронической печеночной недостаточности.
Следует исключить дефицит железа до начала лечения эпоэтином бета, а также в течение всего периода терапии. При необходимости может быть назначена дополнительная терапия препаратами железа в соответствии с клиническими рекомендациями.
Эффективность лечения уменьшается при дефиците железа в организме, при инфекционных и воспалительных заболеваниях, гемолизе.
Нельзя полностью исключить возможность влияния эпоэтина бета на рост некоторых типов опухолей, особенно на злокачественные новообразования костного мозга.
На фоне применения эпоэтина бета необходимо контролировать уровень АД, обращая внимание на возникновение или усиление необычных головных болей. При этом может потребоваться коррекция проводимой терапии или назначение антигипертензивных средств.
С осторожностью применяют при эпилепсии, тромбоцитозе, печеночной недостаточности, сосудистой недостаточности, при злокачественных новообразованиях; у пациентов с нефросклерозом, не получающим гемодиализ, поскольку возможно более быстрое ухудшение функции почек.
Решение о применении эпоэтина бета у пациентов с нефросклерозом, не получающих диализ, необходимо принимать индивидуально, так как нельзя полностью исключить возможность более быстрого ухудшения функции почек. В большинстве случаев одновременно с повышением гемоглобина снижается концентрация ферритина в сыворотке. Уровень ферритина необходимо определять в течение всего курса лечения. Если он составляет менее 100 нг/мл, рекомендуется заместительная терапия препаратами железа.
Пациенты, сдающие аутологичную кровь и находящиеся в пред- или послеоперационном периоде, также должны получать дополнительно адекватное количество железа до нормализации показателей ферритина.
Лекарственное взаимодействие
При одновременном применении препаратов, влияющих на кроветворение (например, препаратов железа), может усиливаться стимулирующее действие эпоэтина бета.
Эпоэтин бета нельзя смешивать с растворами других лекарственных средств.
Препарат, за который ненавидят Логинова. Правда об ЭПО
Статья опубликована в газете под заголовком: «Проклятие ЭПО. За что ненавидят Логинова»


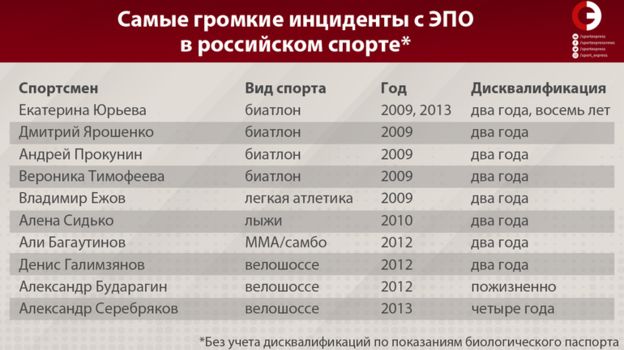



Биатлониста Александра Логинова за ЭПО ненавидит половина биатлонного мира. Именно ЭПО или его модификации – тот самый препарат, дисквалификацию за который отбыли десятки звезд российского спорта: от лыжниц Лазутиной и Даниловой до биатлонистов Ахатовой, Юрьевой и Ярошенко. Правда ли, что ЭПО проникает в геном человека и дает пожизненную прибавку в результате? Реально ли от ЭПО можно умереть? Представляем исследование «СЭ» о самом популярном допинге в мире.
Велосипедисты крутили педали, чтобы не умереть
Как и почти все допинги, ЭПО – это в первую очередь лекарство и спасает жизни. Вообще-то эритропоэтин – гормон почек, который вырабатывается в человеческом организме естественным образом. Этот гормон улучшает доставку кислорода к мышцам и повышает уровень гемоглобина. В спорте это приводит к повышению выносливости, в медицине – позволяет лечить массу заболеваний, от анемии до некоторых видов онкологии и СПИДа.
В середине 1980-х появился так называемый рекомбинантный ЭПО. Гормон научились синтезировать в организмах мышей и других млекопитающих и затем применять для лечения людей. Уже в начале 1990-х рекомбинантный ЭПО стал доступен практически в любой аптеке. Всемирное антидопинговое агентство (ВАДА), напомним, появилось только в 1999-м. До начала 2000-х надежного теста, способного определить наличие ЭПО в организме атлета, не существовало.
1990-е в спорте – это полная жесть в плане применения ЭПО. Хорошо, что пробы того времени сейчас уже невозможно перепроверить. Иначе медали можно было бы отобрать вообще у всех. В некоторых видах, вроде велоспорта, без этого вида допинга можно было даже не выходить на старт. Профессиональные команды возили за собой холодильники, набитые льдом и ампулами – ЭПО хранится только при низкой температуре. Бесконтрольность привела к смертельной опасности. Ведь как и любое серьезное лекарство, ЭПО имеет целый ряд побочных эффектов.
Главный из них – большие дозы гормона повышают вязкость крови и, соответственно, многократно увеличивают риск образования тромбов. Имея в организме лошадиную дозу ЭПО, легко можно заснуть и не проснуться. Есть знаменитые документальные кадры, когда по ходу легендарной многодневки «Тур де Франс», ночью в отеле, гонщики толпами бродят по темным коридорам. Они видят друг друга и, конечно же, все понимают. Но лечь спать не могут – слишком страшно. «During the day we live to ride. And during the night we ride – to live» (Днем мы живем, чтобы крутить педали. А ночью мы крутим педали, чтобы жить – англ.) – известная присказка велосипедистов именно про это. Но даже ночные променады помогали не всем. Гонщики умирали на дистанции, на тренировках, во сне – десятками.
Что такое микродозы и как обмануть «паспорт крови»
В начале 2000-х самая продвинутая лаборатория во французском Шатено-Малабри научилась-таки выявлять рекомбинантный ЭПО и его модификации. Первыми жертвами новой методики тестирования стали российские лыжницы Лариса Лазутина и Ольга Данилова, пойманные во время Олимпийских игр-2002 в Солт-Лэйк-Сити на дарбепоэтине. После этого лыжники и велосипедисты из самых разных стран полегли под дисквалификации косяками. Все они, конечно, уверяли, что не делали ничего запрещенного. И многим даже верили: Лазутина, например, до сих пор Герой России и успешный политик.
На самом деле, принять ЭПО случайно невозможно. Это всегда курс из нескольких инъекций, рассчитанный в зависимости от конкретной модификации препарата. Антидопинговые методики тут, как обычно, отстают от тех, кто придумывает допинг. Научились ловить дарбепоэтин – появился SERA. Сейчас различных видов ЭПО десятки, если не сотни. Они производятся по всему миру, но черный рынок особенно процветает в Китае. Некоторые выводятся из организма буквально за несколько часов. Но сделать курс инъекций случайно, по неосторожности. Сложно представить себе такое в реальности.
Думаете, ЭПО больше не применяется? Как бы не так. Во-первых, паспорта крови имеют далеко не все спортсмены. Это – привилегия элиты, а все остальные по-прежнему сдают пробы только на соревнованиях, от случая к случаю. Поэтому, например, в киргизском городе Чолпан-Ата, где проводит сборы подавляющее большинство российских легкоатлетов, ЭПО легко можно купить в обычной аптеке. Ассортимент этого заведения вообще впечатляет, спрос рождает предложение – тут и эпоэтин, и синтезированный гормон роста джинтропин. Фото витрины этой аптеки опубликовал известный спортивный врач Эдуард Безуглов.
– Допустим, по паспорту ваши показатели крови не должны превышать 20 условных единиц, – объяснил один из российских спортивных врачей. – Значит, вы можете вколоть микродозу с расчетом, чтобы не выйти за пределы этого значения. Причем можно комбинировать различные модификации ЭПО – эффект от них складывается, а сроки выведения значительно меньше, чем если использовать какой-то один препарат.
ЭПО – это гормон, а не синтетический препарат, поэтому определить его в организме по-прежнему крайне сложно. Утром он еще может быть, а вечером – уже нет. Вспомните теперь миллиард историй, когда допинг-офицеры приезжали к спортсмену на внесоревновательное тестирование и не находили его на месте. Человек перепутал, забыл, не услышал звонка в дверь, остался ночевать у друга или подруги. Все это легко может быть правдой. А может – и не быть, и когда офицеры снова придут за пробой завтра, они уже не найдут в организме того, что могли бы обнаружить сегодня.
Почему можно прекратить принимать ЭПО и все равно выигрывать
По поводу опасности для здоровья бесконтрольного употребления ЭПО, двух мнений быть не может. Это реальная угроза жизни. Но вот с микродозами все не так очевидно. Медицинских исследований тут не проводилось, да и вряд ли ВАДА разрешит такой эксперимент. А что, если окажется, что микродозы не вредны? И более того, например, даже защищают организм от экстремальных перегрузок?
Вполне вероятно, что так и есть. Но все равно, разрешить ЭПО в микродозах = это открыть ящик Пандоры. Мошенники тут же научатся превышать разрешенные показатели и постепенно все вернется к кошмарной ситуации 1990-х. К тому же, как оказывается, к допингу тоже нужен свой «талант». И один и тот же препарат в одинаковой дозировке может по-разному действовать на разных людей.
Тут, кстати, скрыт и ответ на вопрос: почему одни спортсмены после применения ЭПО спокойно возвращаются «чистыми» и выступают на прежнем уровне, а другие хоронят свою карьеру навсегда?
– ЭПО как препарат не имеет долгосрочного действия, – объясняет известный спортивный врач Сергей Илюков. – Работоспособность организма повышается только временно и падает по мере прекращения приема. Но штука в том, что если применять ЭПО в период интенсивных тренировок, это позволяет выполнять более значительный объем работы. И проделанный объем потом имеет долгосрочный эффект на выступления спортсмена. Поэтому нарушители склонны употреблять ЭПО как в соревновательный период, так и в период межсезонья, когда закладывается база для дальнейших выступлений.
Что будет, если человек однажды попался на ЭПО, отбыл дисквалификацию и продолжает соревноваться «чистым»? Может ли допинговое прошлое давать превосходство в настоящем? На самом деле, вряд ли. ЭПО точно не проникает в гены и нигде не откладывается.
Все люди очень разные, и на допинг тоже реагируют по-своему. Кто-то от природы силен и способен выполнять нужные нагрузки даже без микродоз. Такой спортсмен вернется после дисквалификации на свой уровень или даже поднимется выше. Другие, наоборот, конкурентоспособны в большом спорте только при условии повышенного уровня гемоглобина, который дает ЭПО. Если этот уровень падает, а человек продолжает тренироваться с прежней интенсивностью, придут перетренированность, проблемы со здоровьем и неизбежный конец карьеры.
Нужно ли перечислять спортсменов, кто в достаточно молодом возрасте вдруг резко заболел (при этом конкретная болезнь не называлась), пошел на спад и закончил? Таких примеров даже в российском спорте полно. Наверняка далеко не все эти случаи связаны именно с микродозами ЭПО. Но многие – связаны. И это секрет Полишинеля.
Почему Логинов не должен молчать
ЭПО – тот редкий вид допинга, где все однозначно. Его нельзя принять под видом витаминки или лекарства, случайно проглотить вместе с пищей или загрязненной биодобавкой. Это серьезный препарат, на применение которого можно пойти только сознательно. Когда пойманные впоследствии говорят «нас обманули» и начинают винить тренеров или кого-то еще, речь, скорее всего, идет о том, что им обещали: вас не поймают. А получилось все совсем иначе.
Именно поэтому так недовольны успехами Логинова Мартен Фуркад и многие другие. В их западном мире мало просто отбыть наказание. Чтобы быть мировой звездой и просто рукопожатным человеком, нужно еще и покаяться. Для нашей, российской ментальности это чуждо. Нам достаточно намеков от Логинова на то, что ему пришлось и виноват, на самом деле, кто-то еще. Что за этими намеками стоит – каждый додумывает для себя.
В этом конфликте нет хороших и плохих. Это столкновение двух разных ментальностей. Объяснит ли что-то Логинов миру – на самом деле, не только его личное дело. Александр, если продолжит выступать так же хорошо, вскоре станет одной из главных звезд нашего спорта. Кумиром тысяч мальчишек, начинающих биатлонистов. Что они будут думать: подумаешь, укололся, попался, а потом вернулся – и ничего страшного? И вообще, пусть эти фуркады помолчат, сами вон на терапевтических исключениях сидят? Пока, судя по всему, следующее поколение рассуждает именно так. Если Логинов и остальные промолчат – так и будет. И тогда новый грандиозный допинговый скандал вокруг нашего спорта – только дело времени.
Новая эра в лечении ЭПО-дефицитной анемии
Анемия почечного генеза, или нефрогенная анемия, наблюдается у подавляющего большинства пациентов на диализе и имеет многофакторный генез, характеризующийся главным образом сочетанием дефицита продукции эндогенного эритропоэтина (ЭПО),
Анемия почечного генеза, или нефрогенная анемия, наблюдается у подавляющего большинства пациентов на диализе и имеет многофакторный генез, характеризующийся главным образом сочетанием дефицита продукции эндогенного эритропоэтина (ЭПО), истощения доступного для эритропоэза пула железа и резистентности костного мозга к действию ЭПО. Еще пару десятилетий назад единственным методом лечения анемии у больных на гемодиализе были повторные многократные гемотрансфузии. Переливая ежемесячно от одной до нескольких доз эритроцитарной массы гемодиализному больному, уровень гемоглобина временно удавалось поднять до 7–9 г/дл, однако при частых задержках с переливанием очередной порции крови его значение быстро снижалось до исходного (6–7 г/дл и даже меньше). Наряду с риском аллергических, анафилактических и посттрансфузионных реакций, переливание крови приводило к перегрузке больных железом, распространению переносимой с кровью парентеральной вирусной инфекции (гепатиты B и С, ВИЧ и др.) и HLA-иммунизации больных, ухудшая результаты последующей трансплантации почки.
Внедрение в клиническую практику препаратов рекомбинантного человеческого эритропоэтина (рчЭПО) революционным образом изменило стратегию лечения нефрогенной анемии и позволило практически отказаться от гемотрансфузий в лечении стабильных пациентов на хроническом диализе. Препараты рчЭПО оказались высокоэффективными средствами коррекции почечной анемии у большинства пациентов, а наиболее частой причиной резистентности к ним оказался функциональный (реже абсолютный) дефицит железа, преодолеваемый совместным назначением рчЭПО и внутривенных препаратов железа. Первые результаты применения рчЭПО продемонстрировали, что их назначение позволяет не только устранить анемический синдром и уменьшить потребность в гемотрансфузиях, но и снизить заболеваемость и смертность больных за счет профилактики сердечно-сосудистых и инфекционных осложнений. Наряду с этим коррекция анемии препаратами рчЭПО повышает качество жизни, улучшает когнитивные функции, сексуальную активность и способствует сохранению трудоспособности, как у пациентов на диализе, так и в преддиализных стадиях хронической болезни почек (ХБП), что несомненно имеет важное медико-социальное значение.
Фармакология средств, стимулирующих эритропоэз (ССЭ). Эндогенный стимулятор эритропоэза ЭПО был впервые выделен из мочи больных с апластической анемией Miyake в 1977 г. За этим последовало клонирование гена ЭПО Якобсом (Jacobs) в 1985 г. и первое применение эпоэтина альфа в клинике Эшбахом (Eschbach) в 1987 г. Препараты первого поколения, эпоэтины альфа и бета, биологически идентичны нативному ЭПО и представляют собой сиалогликопротеидный гормон с молекулярной массой 30,4 кДа. Оба продукта синтезированы в культуре овариальных клеток китайского хомячка (CHO), в которые включена кДНК гена человеческого ЭПО. Не удивительно, что аминокислотная последовательность полипептидной цепочки обоих эпоэтинов идентичная и состоит из 165 аминокислот, а разница заключается в процессе и уровне ее гликозилирования (путем присоединения до 3 N-связанных разветвленных боковых углеродных цепей). Оказалось, что в организме вырабатывается не единая гомогенная молекула, а смесь различных ее изоформ, определяемых по числу свободных сиаловых остатков в боковых цепях (до 14). Как оказалось, наибольшей эритропоэтической активностью обладает изоформа 14. С другой стороны, изоформы с меньшим числом остатков сиаловой кислоты имеют большее сродство к рецептору ЭПО (Р-ЭПО), но более короткий период циркуляции. Очищенные коммерческие препараты ЭПО альфа и бета состоят из смеси изоформ от 9 до 14. В отличие от эпоэтинов альфа и бета, эпоэтин омега вырабатывается в другой линии клеток из почки детеныша китайского хомячка. Еще одним эпоэтином, получившим недавно одобрение Европейского медицинского агентства (EMA) для лечения нефрогенной анемии, стал эпоэтин дельта. Он синтезируется в культуре опухолевых клеток фибросаркомы человека (линия HT-1080). Его также называют ген-активированным эпоэтином, так как экспрессия нативного гена ЭПО активируется трансформацией клеток при помощи цитомегаловирусного промоутера.
При создании дарбэпоэтина альфа, ССЭ II поколения, принималось во внимание, что чем больше в изоформе цепей гликозилирования и свободных сиаловых остатков, тем сильнее ее эритропоэтические свойства вследствие удлинения периода полувыведения. Так как наибольшее число сиаловых остатков в молекуле рчЭПО несли 3 N-концевые углеводородные цепи, методом сайт-направленного мутагенеза к базовой молекуле рчЭПО были присоединены еще 2 дополнительные углеводородные цепи, тем самым их общее число возросло до 5, а число сиаловых остатков с 14 доведено до 22. В результате была создана новая молекула дарбэпоэтина альфа с возросшей массой с 30,4 до 37,1 кДа и увеличенным содержанием углеводов с 40% до примерно 52%. Дарбэпоэтин альфа имеет меньшее сродство к рецептору, чем ЭПО альфа или бета, что перевешивается его возросшей активностью и более длительной циркуляцией. Так, период полувыведения дарбэпоэтина альфа при внутривенном введении по сравнению с эпоэтином альфа (8,5 часов) увеличен в 3 раза и составляет 25,3 часа; при подкожном введении время полувыведения дарбэпоэтина вдвое превышает показатель эпоэтина альфа (48 против 24 часов). Такие фармакологические свойства позволяют вводить дарбэпоэтин существенно реже, чем эпоэтины короткого действия. Его эффективность доказана при введении 1 раз в неделю в фазе коррекции и 1 раз в 2 недели в поддерживающей фазе у большинства пациентов как на диализе, так и в преддиализных стадиях ХБП. (Более редкое введение дарбэпоэтина (1 раз в мес) возможно только у части специально отобранных пациентов, клинически стабильных и хорошо отвечающих на введение 2 раза в месяц, как правило, еще не получающих диализ, однако пока не ясно, не придется ли при этом увеличивать кумулятивную дозу препарата).
Нерешенные вопросы коррекции анемии препаратами рчЭПО: цикличные флуктуации уровня гемоглобина. Под цикличностью уровня гемоглобина подразумевают его нефизиологические спонтанные колебания, составляющие примерно 1,5 г/дл по амплитуде вверх или вниз от некой точки эквилибрации, с длительностью цикла не менее 8 недель. Как показали специально проведенные исследования, изучавшие вариабельность гемоглобина по времени, в течение 1 года 90% стабильных пациентов на диализе демонстрируют хотя бы 1 цикл флуктуаций гемоглобина, а в среднем число таких циклов составляет 3,3 на 1 пациента в год, со средней амплитудой в 2,5 г/дл. В другом исследовании по результатам I квартала 2000 г. больные были разделены на категории по уровню гемоглобина ( 12 г/дл). Только 8% из нижней группы и только 18% верхней группы демонстрировали стабильность уровня гемоглобина в последующем квартале. Разнонаправленные флуктуации уровня гемоглобина с длительностью каждого цикла в среднем около 5 недель установлены в большом когортном исследовании по материалам из базы данных крупной цепочки диализных центров FMC North America, причем наибольшие осцилляции уровня гемоглобина демонстрировали пациенты с гемоглобином за пределами целевого диапазона. Цикличные колебания гемоглобина ассоциированы со множеством факторов, среди которых наиболее важными считают изменения дозы рчЭПО. Так, в одном из исследований на одного пациента в год приходилось в среднем 6,1 случая коррекции дозы, тем не менее, авторы оспаривают, что подобные изменения дозы рчЭПО являются определяющими в индукции цикличности гемоглобина. Другими факторами, возможно связанными с вариабельностью гемоглобина, считают госпитализации, терапию железом, нутриционный статус, наличие воспаления и особенности клинической практики в конкретном лечебном учреждении. Клиническое значение цикличной вариабельности уровня гемоглобина может оказаться высоким. Гилбертсон (Gilbertson et al., 2008) изучил данные 115 118 (!) пациентов на гемодиализе, которым лечение препаратами рчЭПО оплачивалось по программе Medicare. В этом исследовании 90% пациентов демонстрировали циклические колебания гемоглобина, и эти флуктуации были достоверным предиктором риска смерти. Результаты данного исследования убедительно свидетельствуют, что чем длительнее больной находится в целевом диапазоне (11–12,5 г/дл), тем ниже у него риск смертности. Некоторые авторы полагают, что плохой прогноз при циклических колебаниях гемоглобина объясняется флуктуациями в доставке кислорода тканям и эпизодами ишемии миокарда, как только уровень гемоглобина значимо снижается.
Мирцера: теоретические предпосылки. Очевидно, что хотя в лечении нефрогенной анемии достигнут несомненный прогресс, тем не менее, еще остается немало проблем, требующих своего решения. Лечения препаратами рчЭПО короткого действия, которые необходимо вводить 3 раза в неделю, является обременительным для пациентов и медицинского персонала, нагрузка на который постоянно растет. С учетом эпидемиоподобного роста заболеваемости хронической почечной недостаточностью во всем мире и постоянно растущем числе больных, требующих диализа, возникает клиническая потребность в препаратах с более удобным режимом введения. Другим аргументом в пользу создания препаратов ССЭ более длительного действия является циклическая вариабельность гемоглобина, когда его уровень нередко выходит за пределы целевого диапазона. Это требует постоянно пересматривать дозу ССЭ, что также увеличивает нагрузку на персонал. По крайней мере, частично эти флуктуации гемоглобина объясняют использованием препаратов с коротким периодом действия. Таким образом, появление препарата «Мирцера» было предопределено реальными клиническими нуждами в подобном лекарственном средстве.
Мирцера: фармакология и механизм действия. Препарат «Мирцера» стал первым представителем нового класса ССЭ III поколения — так называемый активатор рецепторов эритропоэтина длительного действия. Создатели препарата справедливо посчитали, что возможности гипергликозилирования молекулы ЭПО для существенного удлинения времени ее циркуляции уже исчерпаны, и использовали иной, новаторский подход. В его основу легла идея, что период полувыведения можно удлинить, если к активному веществу (в данном случае эпоэтину бета) присоединить большую молекулу, которая будет замедлять его клиренс. В результате удалось синтезировать новый препарат, в котором большая полимерная цепочка метоксиполиэтиленгликоля интегрирована с эпоэтин бета через амидные связи между N-терминальными аминогруппами аланина и сигма-терминальными концами аминогрупп лизина (Lys45 or Lys52) с помощью кислотного линкера (сукцимидил-бутановую кислоту), используя нанотехнологии. Так как масса полимера составляет примерно 30 кДа, молекулярная масса нового препарата оказалась вдвое выше (60 кД), чем у эпоэтина бета (30,4 кДа). Мирцера имеет принципиальные различия от ССЭ I и II поколения в плане взаимодействия с рецептором и фармакокинетическими характеристикам. В сравнении с эпоэтином бета, Мирцера демонстрирует низкое сродство к рецептору, легко диссоциирует после взаимодействия с растворимым Р-ЭПО и обладает низкой активностью в отношении пролиферации клеток in vitro. Полагают, что связь Мирцеры с рецептором настолько непрочная, что не позволяет ему осуществить захват и интернализацию препарата, поэтому повторяющиеся стимуляция, активация и диссоциация с Р-ЭПО обуславливают длительную активность и больший период выведения. Другими словами, как и в случае с дарбэпоэтином альфа, более слабое взаимодействие с рецептором значительно перевешивается большей стабильностью in vivo и более длительной стимуляцией Р-ЭПО. Как и ранее при пегилировании других лекарственных биопротеинов, время полувыведения Мирцеры многократно увеличилось и составило 130 часов, что примерно в 6 раз больше, чем у дарбэпоэтина альфа при в/в введении, что подтверждает осуществимость гипотезы более редкого введения препарата и удлинения интервалов между инъекциями. Путь введения Мирцеры практически не оказывает влияния на скорость ее элиминации (табл.), и периоды полувыведения при п/к и в/в введении примерно равны, что безусловно является еще одним достоинством Мирцеры и дает врачу возможность выбора более удобного способа назначения (на гемодиализе — в/в, преддиализный период, перитонеальный диализ и трансплантации — п/к).
Исследования эффективности и безопасности
Доклинические исследования in vitro. Эритропоэтическая активность Мирцеры in vitro была изучена в культуре клеток острой миелоидной лейкемии (UT-7) путем оценки влияния на пролиферацию клеток, которые экспрессируют на своей поверхности Р-ЭПО. По сравнению с эпоэтином, Мирцера стимулирует меньшую пролиферацию клеток UT-7 в диапазоне концентрации 0,003–3 Ед/мл. Тем не менее, в экспериментах на мышах с нормоцитемией Мирцера вызывает больший ретикулоцитарный ответ, чем эпоэтин бета. Это, вероятно, объясняется теми характеристиками связи с рецептором и фармакокинетикой, которые описаны выше.
Доклинические исследования in vivo. Доклинические исследования на моделях животных при введении разовых и повторных доз Мирцеры в/в и п/к в диапазоне 0,75–20 мкг/кг демонстрируют, что Мирцера является более мощным стимулятором эритропоэза, чем эпоэтин, как по амплитуде, так и продолжительности ретикулоцитарного ответа.
Клинические исследования I фазы. Исследования I фазы продемонстрировали дозозависимое увеличение числа ретикулоцитов как при п/к, так и в/в введении Мирцеры здоровым лицам. В рандомизированном исследовании с разовым введением возрастающих доз Мирцеры здоровые добровольцы получали либо Мирцеру в дозах от 0,4–3,2 мкг/кг в/в, от 0,1–3,2 мкг/кг либо плацебо. В другом рандомизированном исследовании здоровым лицам назначались повторные возрастающие дозы Мирцеры 3-кратно в/в в диапазоне от 0,4–3,2 мкг/кг, либо 4-кратно подкожно в той же дозе с двухнедельным интервалом с плацебо-контролем. Пик эффекта по числу ретикулоцитов наблюдался на 7 день после в/в и 10 день п/к введения. Повторные дозы значимо не влияли на фармакокинетику, аккумуляции препарата не наблюдалось при в/в введении 1 раз в неделю, а при подкожном введении 1 раз в 2 недели она была не значительной. Переносимость Мирцеры в целом была хорошей, серьезных побочных эффектов не документировано.
Исследования II фазы в популяции пациентов с ренальной анемией. Эффективность Мирцеры была изучена в исследованиях II фазы у пациентов с анемией, не получавших ранее ЭСС (ЭПО-наивных), как на преддиализных стадиях ХБП, так и на диализе. Действие препарата исследовалось в фазе коррекции и последующего поддерживающего лечения. Так, Де Франциско (De Francisco, 2003) изучал эффективность Мирцеры в группе из 61 диализного пациента (≥18 лет; Hb 8–11 г/дл; время нахождения на гемодиализе ≥1 мес и на перитонеальном диализе ≥2 мес). Последовательно протестированы 3 дозы, с 3 различными интервалами введения. Пациенты I группы рандомизированы в подгруппы и получали Мирцеру в дозе 0,15 мкг/кг в нед, 0,30 мкг/кг 1 раз в 2 нед или 0,45 мкг/кг 1 раз в 3 нед. Пациенты II группы получали 0,3 мкг/кг, а III группы 0,45 мкг/кг 1 раз в нед. В первые 6 нед дозы были фиксированы, далее разрешалась коррекция дозы согласно уровню гемоглобина и наблюдение продолжалось еще 12 недель. Ответ получен при всех дозировках и интервалах. Средний прирост Hb составил 0,84, 1,15 и 1,11 г/дл в ходе первых 6 недель фиксированных доз и 1,15, 2,50, и 2,35 г/дл в течение последующих 12 недель в группах с малой, промежуточной и высокой дозой соответственно. Быстрота ответа зависела от дозы: медиана времени достижения целевого гемоглобина в группе с низкой дозой составила 52 дня, в промежуточной 38 дней и в группе с высокой дозой 30 дней. Серьезных побочных эффектов не отмечалось. Таким образом, исследование продемонстрировало мощную эритропоэтическую эффективность препарата «Мирцера» и благоприятный профиль безопасности. Provenzano в исследовании BA16528 изучал эффективность п/к введения Мирцеры у 65 преддиализных пациентов с ХБП, не получавших ранее рчЭПО. Пациенты получали препарат п/к в дозах 0,15, 0,30 или 0,60 мкг/кг в нед, 1 раз в нед, 1 раз в 2 нед либо 1 раз в 3 нед. Длительность наблюдения составила 18 мес. Влияние Мирцеры на прирост гемоглобина было дозозависимым, но при этом не зависело от частоты введения препарата. Достигнутый эффект сохранялся до конца исследования. Далее больные наблюдались в продленной фазе поддерживающей терапии длительностью 54 нед, в ходе которой больные сохраняли режим введения Мирцеры 1 раз в нед, 1 раз в 2 нед либо 1 раз в 3 нед, с целью поддержания уровня Hb в диапазоне 11–12 г/дл. В этот период исследования средние уровни Hb, который измеряли ежемесячно, составили 11,3 г/дл при еженедельном введении, 11,4 г/дл при введении 1 раз в 2 нед и 11,7 при назначении 1 раз в 3 нед. Препарат в целом хорошо переносился больными, а результаты исследования убедительно показали, что Мирцера обеспечивает стабильный контроль анемии у пациентов с ХБП, еще не находящихся на диализе.
Продолжение статьи читайте в следующем номере.
В. Ю. Шило, кандидат медицинских наук Центр диализа при ГКБ № 20, МГМСУ, Москва




