Эскалация дозы препарата что это
Эскалация дозы препарата что это
Особенности проведения клинических исследований 1 фазы, направленных на изучение ингибиторов иммунных контрольных точек
В 2013 г. журнал Science назвал иммунотерапию злокачественных новообразований «прорывом года». Подобное лестное определение было основано на многообещающих результатах исследования 3 фазы с ипилимумабом (Ервой, Bristol-Myers Squibb), рекомбинантным человеческим моноклональным антителом (МоА), действующим против цитотоксического антигена CTLA-4, и исследований 1 фазы с МоА к рецептору запрограммированной гибели клеток (PD-1) и его лиганду (PD-L1) 1. Спустя всего лишь два года достижения в иммунотерапии опухолей не вызывали ни у кого сомнений. Прогресс был достигнут не только в лечении метастатической меланомы (мМ), где впервые были использованы анти-CTLA-4 антитела, но и в лечении более 15 видов солидных опухолей, где с успехом изучались анти-PD-1/PD-L1 антитела [7]. Более того, если по предварительным результатам по изучению анти-PD1 антител в исследованиях 1 фазы было выявлено лишь достижение значимого противоопухолевого ответа, то в исследованиях 3 фазы, проведенных у больных мМ и немелкоклеточным раком легкого (НМРЛ), было показано, что новые препараты влияют на увеличение показателя общей выживаемости 10. Признанием полученных результатов является одобрение Управлением по контролю над качеством пищевых продуктов и лекарственных средств США (FDA) ниволумаба (Опдиво, Bristol-Myers Squibb) в лечении мМ, метастатического плоскоклеточного и неплоскоклеточного НМРЛ (декабрь 2014 г., март 2015 г., октябрь 2015 г. соответственно). За ниволумабом последовало одобрение пембролизумаба (Кейтруда, Merck Sharp & Dohme) в лечении мМ (сентябрь 2014 г.), а также в терапии метастатического PD-L1 позитивного НМРЛ (сентябрь 2015 г.). После того как данные МоА зарекомендовали себя в монотерапии, они стали активно изучаться в комбинациях друг с другом 12.
Следствием полученных положительных результатов является увеличивающееся с каждым днем число МоА, действующих на иммунные контрольные точки [15]. Как бы то ни было, опыт применения анти-CTLA-4 и анти-PD-1/PD-L1 антител внес определенные изменения в концепцию проведения клинических исследований 1 фазы с их участием. Знание подобных особенностей необходимо для успешного изучения следующего поколения подобных антител.
Появление МоА, нацеленных на контрольные молекулы, является вторым значимым событием в онкологии за последние 15 лет. Первым по праву считается появление таргетных препаратов, действующих селективно на определенные мишени молекулярных путей, вовлеченные в процессы поддержания опухолевого роста. Их изучение коренным образом изменило принципы проведения клинических исследований 1 фазы, когда исследователям пришлось уйти от существовавшего на тот момент традиционного подхода (1 препарат подходит всем пациентам с данной патологией) и начать проводить лечение с учетом молекулярных особенностей опухоли каждого отдельно взятого больного. Подобный подход позволил успешно изучить ряд новых препаратов, включая олапариб, кризотиниб и церитиниб 16. Появление ингибиторов иммунных контрольных точек (ИИКТ) явилось в определенной степени вызовом для врачей, занимающихся проведением клинических исследований 1 фазы. Помимо того, что нужно было кардинальным образом изменить ставшие уже традиционными подходы к изучению лекарственных средств, их нужно было приспособить к принципиально новому классу препаратов. Смешно сказать, но появление ИИКТ заставило ряд онкологов открыть книги по иммунологии. По своей сути, новый класс препаратов представляет собой ту же самую таргетную терапию, но направленную против цитотоксических антигенов, находящихся на поверхности клеток иммунной системы или опухолевых клеток. Ответ на лечение, так же как и его продолжительность, свидетельствует о том, что подход к терапии больных данными препаратами должен сконцентрироваться на возможном развитии резистентности к ним. Одним из вариантов ее преодоления является комбинация ИИКТ с другими классами препаратов [13], которая в то же время может оказаться чрезвычайно токсичной. В связи с этим одной из причин разработки новых подходов к изучению данных препаратов является создание эффективных и малотоксичных режимов на их основе. Безусловно, подобный подход должен включать в себя рекомендации по выбору оптимальной дозы, режима и способа введения препарата, а также должен проводиться с учетом особенностей опухоли больных, иных критериев оценки эффективности проводимого лечения, так же как и выбора оптимального дизайна исследования.
Обобщая все выше изложенное, нужно сказать о том, что впечатляющие результаты, которые демонстрирует новый класс препаратов, с одной стороны, диктуют необходимость внести изменения в дизайн и концепцию проведения клинических исследований 1 фазы, а с другой, подобные «вынужденные приспособления» позволят оптимизировать проведение исследований с данными препаратами, что в конечном итоге будет способствовать скорейшему их изучению и внедрению в клиническую практику.
Особенность 1: профиль безопасности и определение максимально переносимой дозы препарата
Основной целью проведения клинических исследований 1 фазы традиционно являлось определение профиля безопасности препарата, его переносимости и рекомендуемой дозы для проведения исследования 2 фазы. Методом достижения данной цели обычно являлась эскалация дозы исследуемого препарата. При этом предполагали, что существует линейная или прямо пропорциональная зависимость между дозой препарата, его эффективностью и токсичностью. Появление ИИКТ изменило данный подход к изучению новых препаратов. В первую очередь, это связано с невозможностью определения максимально переносимой дозы (МПД) препарата, а во-вторых – с существованием большого разнообразия доз препаратов и режимов их введения, которые были ранее исследованы.
Дозолимитирующая токсичность и определение МПД
Из 13 основных клинических исследований 1 фазы по изучению анти-CTLA-4 и анти-PD-1/PD-L1 антител [3-6, 20-30] только в одном исследовании была идентифицирована дозолимитирующая токсичность (ДЛТ) препарата [24]. В большинстве исследований выбор рекомендуемой дозы препарата для проведения исследования 2 фазы исходил из максимальной вводимой дозы препарата (МВД; 10 исследований) или данных фармакокинетики (ФК; 2 исследования). В другом исследовании слишком поздно выявили ДЛТ, которую не приняли во внимание при выборе рекомендуемой дозы препарата [25]. Интересно, что для ИИКТ характерны определенные особенности развития острой и кумулятивной токсичности (за исключением анафилактических реакций, возникающих непосредственно при введении препарата). Нежелательные явления, связанные с действием препаратов, как правило, не развиваются во время первого курса терапии, а возникновение иммуно-опосредованных нежелательных явлений может произойти в достаточно отдаленные сроки. Например, независимо от степени выраженности иммуно-опосредованные нежелательные явления обычно развиваются на 8-10 неделе после начала терапии ипилимумабом [31]. В связи с тем, что ряд нежелательных явлений могут представлять угрозу для жизни пациентов, в большинстве протоколов клинических исследований оговаривается необходимость хранения препарата, на который возникла реакция, до ее разрешения до 2 степени токсичности. Несмотря на то, что формально подобные нежелательные явления не считаются ДЛТ, их расценивают как ДЛТ [34, 35]. Следовательно, традиционное определение ДЛТ, когда в расчет принимаются нежелательные явления 3-4 степени, возникшие во время первого курса терапии, неуместно в данном контексте.
Интересно, что в большинстве исследований 1 фазы с ИИКТ были использованы заранее определенные уровни эскалации дозы, включая максимально допустимую дозу. Помимо этого, в двух последних исследованиях период ДЛТ был продлен до 2 курсов [4, 30]. Несмотря на то, что для анти-CTLA-4 антител токсичность является относительно дозозависимой, величина дозы этих препаратов не коррелирует с выраженностью частоты объективного ответа (ЧОО) (таблица 1) [31].
Таблица 1. Корреляция дозы ингибиторов иммунных контрольных точек с частотой объективного ответа.
| Ингибитор иммунных контрольных точек | Доза | ЧОО (%) | Ссылка |
|---|---|---|---|
| Анти-CTLA-4 | |||
| Ипилимумаб | 0,3 мг/кг каждые 3 нед., 4 курса | 0 | Wolchok et al. [36] |
| 3 мг/кг каждые 3 нед., 4 курса | 11 | Robert et al. [10] | |
| 10 мг/кг каждые 3 нед., 4 курса; затем каждые 12 нед. в комбинации с дакарбазином | 15,2 | Robert et al. [2] | |
| Тремелимумаб | 15 мг/кг каждые 90 дней | 10,7 | Ribas et al. [37] |
| Анти-PD-1 | |||
| Пембролизумаб | 2 мг/кг каждые 3 нед. | 26 | Robert et al. [38] |
| 10 мг/кг каждые 3 нед. | 26 | ||
| 10 мг/кг каждые 2 нед. | 33,7 | Robert et al. [10] | |
| 10 мг/кг каждые 3 нед. | 32,9 | ||
| Ниволумаб | 0,1 мг/кг каждые 2 нед. | 35,3 | Topalian et al. [39] |
| 0,3 мг/кг каждые 2 нед. | 27,8 | ||
| 1 мг/кг каждые 2 нед. | 31,4 | ||
| 3 мг/кг каждые 2 нед. | 41,2 | ||
| 10 мг/кг каждые 2 нед. | 20 | ||
| 2 мг/кг каждые 3 нед. | 40 | Robert et al. [8] | |
С другой стороны, анти-PD-1/PD-L1 антитела не имеют корреляцию между дозой, эффективностью и токсичностью. Доказательством этого служит то, что ответ на терапию, так же как и степень выраженности нежелательных явлений, является одинаковым, будь то препарат, введенный в дозе 1-2 мг/кг или 20 мг/кг каждые 2 недели или каждые 3 недели [3, 4, 6, 26, 27]. Подобное полное отсутствие ДЛТ и относительно безопасный профиль токсичности ИИКТ предполагают создание альтернативных дизайнов клинических исследований [40].
Профиль безопасности ИИКТ должен кардинальным образом отличаться от действия агонистов иммунных контрольных точек. Ярким примером подобной токсичности является неудачный опыт применения агониста антитела анти-CD28 TGN1412 и развившийся при этом синдром высвобождения цитокинов [41]. Несмотря на это, по данным последних публикаций опыт безопасного применения первых агонистов моноклональных антител анти-OX4-40 и анти-CD137 в клинических исследованиях 1 фазы был успешным [42, 43].
Оптимальная доза и выбор режима введения препарата
Второй особенностью исследований 1 фазы, в которых изучаются ИИКТ, является сложность определения оптимальной дозы и выбор режима введения препарата. Из 13 известных исследований в 6 проводилось изучение препарата лишь в одной дозе [5, 20-24, 27]. В других исследованиях изучались различные режимы введения препарата, включая повторные введения его в 1, 3, 5 дни [43] или каждые 2, 3 или 4 недели вплоть до 3 месяцев лечения [33, 37]. Максимальное количество курсов при этом могло и не оговариваться.
Ярким примером может служить история изучения ипилимумаба: несмотря на то, что препарат изучался в нескольких исследованиях 1 фазы [20, 22, 23], впоследствии различные дозы препарата, так же как режимы его назначения, изучались в клинических исследованиях более поздних фаз. Например, в клиническом исследовании 2 фазы, в котором приняли участие больные мМ, проводилось сравнение между собой трех различных доз назначения ипилимумаба (0,3; 3 и 10 мг/кг [36] каждые 3 недели, 4 курса), и пациенты, заболевание которых контролировалось, могли получать поддерживающую терапию ипилимумабом каждые 12 недель. Казалось бы, что ЧОО должна возрастать с увеличением дозы препарата (0%; 4,2% и 11% для каждой группы соответственно; p=0,002), но это не было подтверждено на большей популяции больных [1, 10, 45]. Несмотря на то, что одобренной дозой ипилимумаба является 3 мг/кг каждые 3 недели [1], в одном из исследований 3 фазы проводилось изучение ипилимумаба в дозе 10 мг/кг с последующим проведением поддерживающей терапии в дозе 10 мг/кг каждые 12 недель [2]. Что касается, анти-PD-1 антител, то они неэффективны в дозе 10 лет, то сейчас на это требуется
Эскалация дозы препарата что это
Кафедра онкологии, Первый МГМУ им И.М. Сеченова (Сеченовский Университет), Москва, Россия
Введение
В настоящее время в арсенале онкогематологов появляется много новых лекарственных средств с уникальными механизмами действия. К новым таргетным препаратам относится венетоклакс (АВТ-199), низкомолекулярный селективный ингибитор белков семейства Bcl-2, действие которого основано на стимуляции апоптоза путем регулирования соотношения и взаимодействий анти- и проапоптотических белков семейства гена Bcl-2. Гиперэкспрессия белка BCL-2 была обнаружена при таких заболеваниях, как хронический лимфолейкоз, фолликулярная лимфома, мантийноклеточная лимфома. В доклинических исследованиях показано, что венетоклакс (VEN) может индуцировать апоптоз in vitro на клеточных линиях хронического лимфолейкоза (ХЛЛ), множественной миеломы (ММ) и острого миелобластного лейкоза (ОМЛ), а также и in vivo на животных моделях. Эти данные сделали VEN потенциальным терапевтическим средством для лечения этих болезней. В настоящее время на сайте www.clintrials.gov зарегистрировано более 120 клинических исследований по изучению безопасности и эффективности VEN при различных онкогематологических заболеваниях (в настоящем обзоре приведены наиболее значимые из них).
Хронический лимфолейкоз (ХЛЛ)
Далее проведены исследования II фазы, и эффективность VEN исследовалась у пациентов с неблагоприятным прогнозом ХЛЛ. В исследование (NCT01889186) были включены 107 пациентов с ХЛЛ и наличием делеции 17р, имевших рецидив или недостаточный ответ на предыдущее лечение. Общий ответ, по оценке независимого исследовательского комитета, зафиксирован у 85 пациентов и составил 79%, из них полные и частичные нодулярные ремиссии констатированы у 11 (10%) пациентов, в 69% случаев была достигнута частичная ремиссия. Медиана времени до достижения ПР составила 8,2 месяца. К наиболее значимым побочным эффектам (III–IV степеней) отнесены нейтропения (40%), инфекции (20%), анемия (18%) и тромбоцитопения (15%). У 5 (4,7%) пациентов развился СЛО без каких-либо клинических проявлений [3].
В последующем когорта исследования была расширена и в нее дополнительно был включен 51 пациент. При анализе расширенной когорты (158 пациентов) общая частота ответа составила 77%, из них 20% – ПР; 2-летняя беспрогрессивная выживаемость составила 54% (95% доверительный интервал [ДИ] – 45–62%). В подгруппе пациентов, ранее получавших ингибиторы Брутон тирозинкиназ (БТК), частота ответа составила 63%, 24-месячная выживаемость без прогрессирования – 50% (4). Результаты этих исследований оказались весьма впечатляющими и в 2015 г. FDA (Food and Drug Administration) присвоило препарату VEN статус прорывной терапии для лечения больных ХЛЛ (рецидивирующая/рефракторная форма) с предшествовавшей нечувствительностью к иммунохимиотерапии и наличием делеции 17р.
Хорошие результаты были получены и при использовании VEN после неудач лечения ингибиторами БТК (ибрутиниб) и PI3K (иделалисиб). В исследование вошли 64 пациента с ХЛЛ, 43 – ранее получали ибрутиниб (группа А), 21 пациент – иделалисиб (группа В). Общий ответ в группе А составил 70% (ПР 2%), в группе В общий он достиг 48% (ПР не было); 12-месячная беспрогрессивная выживаемость для всех пациентов составила 72%. У 14 (33%) из 42 пациентов между 24-й и 48-й неделями в периферической крови признаков минимальной остаточной болезни (МОБ) обнаружено не было. Из серьезных побочных эффектов III–IV cтепеней наблюдались нейтропения (31%), тромбоцитопения (16%), анемия (22%), фебрильная нейтропения зафиксирована у 6 пациентов, у 2 пациентов развился СЛО, определенный только по лабораторным показателям [5]. Опубликованы данные исследования, в которое были включены 127 пациентов с рецидивирующим или рефрактерным ХЛЛ, которым был назначен VEN после прогрессирования на фоне терапии ибрутинибом. От 65% пациентов был достигнут общий ответ, из них ПР – от 9% пациентов. Оценка наличия признаков МОБ в периферической крови проведена 57 пациентам. У 24 (42%) из этих 57 пациентов признаков МОБ в периферической крови выявлено не было, причем у 5 из 13 пациентов при последующем анализе не было обнаружено признаков МОБ в костном мозге. К наиболее распространенным побочным эффектам 3-й или 4-й степени по СТСАЕ (Common Terminology Criteria for Adverse Events) относились нейтропения (51%), тромбоцитопения (29%), анемия (29%) [6].
Эти данные послужили основанием для регистрации FDA в 2016 г. монотерапии VEN для лечения пациентов с ХЛЛ с делецией 17р или TP53-мутацией, которым лечение ингибиторами сигнального пути В-клеточного рецепторного комплекса не подходило или не показало ожидаемого результата [7]. В 2017 г. VEN был рекомендован в Европейском Союзе по тем же показаниям [8]. В Российской Федерации VEN был одобрен в феврале 2018 г. для пациентов с ХЛЛ и наличием делеции 17р или мутации ТР53 при неудачах или невозможности терапии ибрутинибом.
Управляемый профиль токсичности послужил основанием для инициирования различных клинических исследований с целью изучения комбинации VEN с другими препаратами. В исследовании MURANO (NCT02005471) проведено сравнение эффективности комбинации VEN и ритуксимаба (R; n=194) и стандартной иммунохимиотерапии (бендамустин+R [RB]; n=195) пациентов с рецидивирующим рефрактерным ХЛЛ. Двухлетняя выживаемость без прогрессирования в группе VEN+R составила 84,9%, у больных, получавших RB, – 36,3%. Общий ответ при лечении VEN+R зафиксирован в 93,3% случаев (ПР – 26,8%), в группе RB – 67,7% (ПР – 8,2%; р
1. Seymour J.F., Davids M.S., Pagel J.M., et al. Bcl-2 Inhibitor ABT-199 (GDC-0199) Monotherapy Shows Anti- Tumor Activity Including Complete Remissions In High-Risk Relapsed/Refractory (R/R) Chronic Lymphocytic Leukemia (CLL) and Small Lymphocytic Lymphoma (SLL). Blood 2013;122:872.
2. Roberts A.W., Davids M.S., Pagel J.M., et al. S1146; EHA; Stockholm. 2013;13–6.
3. Stilgenbauer S., Eichhorst B., Schetelig J., et al. Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion: a multicentre, open-label, phase 2 study. Lancet. Oncol. 2016;17:768–78. Doi: 10.1016/S1470-2045(16)30019-5.
4. Stilgenbauer S., Eichhorst B., Schetelig J., et al. Venetoclax for PatientsWith Chronic Lymphocytic Leukemia With 17p Deletion: Results From the Full Population of a Phase II Pivotal Trial. J. Clin. Oncol. 2018;36:1–8. Doi: 10.1200/JCO.2017.76.6840
5 Jones J., Choi M.Y., Mato A.R., et al. Venetoclax (VEN) monotherapy for patients with chronic lymphocytic leukemia (CLL) who relapsed after or were refractory to ibrutinib or idelalisib. Blood. 2016;128:abstract 637.
6. Jones J.A., Mato A.R., Wierda W.G., et al. Venetoclax for chronic lymphocytic leukaemia progressing after ibrutinib: an interim analysis of a multicentre, open-label, phase 2 trial. Lancet Oncol. 2017;65–75. Doi: 10.1016/S1470-2045(17)30909-9.
7. AbbVie. Investigational Medicine Venetoclax Receives Breakthrough Therapy Designation in Relapsed or Refractory Chronic Lymphocytic Leukemia in Previously Treated Patients with the 17p Deletion Genetic Mutation
8. Eichhorst B., Robak T., Montserrat P., et al. Chronic Lymphocytic Leukaemia Treatment Recommendations, Published: 27 June 2017. Authors: ESMO Guidelines Committee, Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2015;26(5): 78–84.
9. Seymour J.F., et al. Venetoclax Plus Rituximab Is Superior to Bendamustine Plus Rituximab in Patients with Relapsed/ Refractory Chronic Lymphocytic Leukemia – Results from Pre-Planned Interim Analysis of the Randomized Phase 3 Murano Study. 59TH Annual meeting and exposition of the american society of hematology. Blood 2017;130:LBA-2.
10. AbbVie’s Venetoclax Receives Breakthrough Therapy Designation from FDA in Combination with Rituximab for the Treatment of Patients with Relapsed/Refractory Chronic Lymphocytic Leukemia
11. Touzeau C., Dousset C., Le Gouill S., et al. The Bcl-2 specific BH3 mimetic ABT-199: a promising targeted therapy for t(11;14) multiple myeloma. Leukemia. 2014;28(1):210–12. Doi: 10.1038/leu.2013.216.
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В основе концепции деэскалационной терапии лежит принцип, который направлен на повышение эффективности лечения наиболее сложных и тяжелых, с точки зрения антимикробной терапии, нозокомиальных инфекций – нозокомиальной пневмонии и ангиогенных инфекций. Необходимость повышения эффективности лечения именно этих инфекций заключается в том, что из всех нозокомиальных инфекций – именно пневмония и ангиогенные инфекции имеют высокую вероятность неблагоприятного исхода непосредственно связанного с течением инфекции. Понятие деэскалационной терапии тесно связано с понятиями адекватной и неадекватной антимикробной терапии. Адекватной антимикробной терапией считается такая, при которой хотя бы один из используемых антибиотиков оказывается активным в отношении, выделенного при бактериологическом исследовании, возбудителя данной инфекции. Следовательно, неадекватной терапией считается та, ни один компонент которой не активен в отношении выделенного возбудителя инфекции. Несмотря на то, что пациенты с тяжелыми нозокомиальными инфекциями требуют комплексного лечения, именно неадекватная антимикробная терапия инфекции является неблагоприятным прогностическим фактором и достоверно увеличивает вероятность неблагоприятного исхода инфекции. Концепция деэскалационной терапии содержит доказательства необходимости применения у пациентов с тяжелыми нозокомиальными инфекциями наиболее эффективных антимикробных препаратов в режиме стартовой терапии и объясняет причины недостаточной эффективности эксалационного принципа лечения, который предполагает применение в режиме стартовой терапии препаратов, которые обычно обладают высокой эффективностью в отношении внебольничных инфекций. Основным различием возбудителей вне– и внутрибольничных инфекций является их резистентность к антимикробным препаратам и, следовательно, выбор антимикробных препаратов является ключевым моментом, способным оказывать влияния на исход лечение больных тяжелыми нозокомиальными инфекциями.
В основе концепции деэскалационной терапии лежит принцип, который направлен на повышение эффективности лечения наиболее сложных и тяжелых, с точки зрения антимикробной терапии, нозокомиальных инфекций – нозокомиальной пневмонии и ангиогенных инфекций. Необходимость повышения эффективности лечения именно этих инфекций заключается в том, что из всех нозокомиальных инфекций – именно непосредственно связанного с течением инфекции. Понятие деэскалационной терапии тесно связано с понятиями адекватной и неадекватной антимикробной терапии. Адекватной антимикробной терапией считается такая, при которой хотя бы один из используемых антибиотиков оказывается активным в отношении, выделенного при бактериологическом исследовании, возбудителя данной инфекции. Следовательно, неадекватной терапией считается та, ни один компонент которой не активен в отношении выделенного возбудителя инфекции. Несмотря на то, что пациенты с тяжелыми нозокомиальными инфекциями требуют комплексного лечения, именно неадекватная антимикробная терапия инфекции является неблагоприятным прогностическим фактором и достоверно увеличивает вероятность неблагоприятного исхода инфекции. Концепция деэскалационной терапии содержит доказательства необходимости применения у пациентов с тяжелыми нозокомиальными инфекциями наиболее эффективных антимикробных препаратов в режиме стартовой терапии и объясняет причины недостаточной эффективности эксалационного принципа лечения, который предполагает применение в режиме стартовой терапии препаратов, которые обычно обладают высокой эффективностью в отношении внебольничных инфекций. Основным различием возбудителей вне– и внутрибольничных инфекций является их резистентность к антимикробным препаратам и, следовательно, выбор антимикробных препаратов является ключевым моментом, способным оказывать влияния на исход лечение больных тяжелыми нозокомиальными инфекциями.
Проблемы диагностики нозокомиальных инфекций и выбора режима антибактериальной терапии
Обычно развитие нозокомиальных инфекций сопровождается ухудшением состояния пациентов, связанным с появлением местных признаков инфекции, признаков генерализованного воспаления и интоксикации, органной дисфункции. Однако у тяжелых больных с наличием признаков генерализованнного воспаления и полиорганной недостаточности, развитие нозокомиальной инфекции может не иметь яркой клинической симптоматики. Имеются литературные данные, указывающие, что только у одной трети пациентов в тяжелом состоянии имеется яркая клиническая симптоматика, указывающая на появление нозокомиальной инфекции. Поэтому обычно для подтверждения нозокомиальной инфекции применяются микробиологические методы, возволяющие установить источник инфекции и возбудителя. Необходимо отметить, что микробиологическое исследование, как минимум, продолжается 24–72 часа. Задержка с назначением антимикробной терапии – основного компонента лечения инфекций не может быть объяснена ожиданием данных микробиологического исследования. Поэтому после диагностики инфекции на основании клинических, функциональных и лабораторных исследований, необходимо выбрать режим стартовой антибактериальной терапии.
Проблема выбора антибактериальной терапии нозокомиальной инфекции всегда несет в себе высокую вероятность выбора неадекватного стартового режима. Для того чтобы максимально снизить вероятность выбора неадекватной антимикробной терапии, существуют определенные подходы или правила. Эти правила заключаются в следующем.
1. Эмпирическая терапия должна проводиться в режиме монотерапии препаратом, обладающим широким спектром антибактериального действия или комбинацией препаратов, позволяющей максимально расширить антимикробный спектр.
2. Для выбора адекватной терапии необходимо использовать данные локального микробиологического мониторинга и чувствительности флоры.
3. Выбор антибактериальных препаратов должен быть основан на определенных данных о пациенте:
a. локализации инфекции (указание на определенный спектр возбудителей);
b. тяжести инфекции (количество возбудителей);
c. возможности хирургической санации очага инфекции;
d. прогнозе развития и исхода инфекции;
e. характере предшествующей антибактериальной терапии (резистентность флоры).
Опасность неадекватного выбора стартовой антибактериальной терапии
Неадекватный выбор антимикробной терапии может быть связан со следующими причинами: возбудитель инфекции имеет природную или приобретенную резистентность к выбранному режиму антимикробной терапии, препарат применяется в неправильной дозе или не выдерживается правильно промежутки между введением антибактериального препарата, не применяется комбинированная терапия, если она показана [1,2]. Две последние причины неадекватной антимикробной терапии имеют субъективный характер и могут быть легко исправлены с помощью информации, которая, как правило, содержится в инструкции к применению препарата, прикладываемой изготовителем. Сведения о природной резистентности предполагаемого возбудителя имеется в большинстве общедоступных справочников по антимикробной терапии и должны учитываться при эмпирическом назначении препарата. Существенно сложнее дело обстоит с характеристикой приобретенной резистентности возбудителя, которая может быть получена только в результате микробиологического исследования или обобщения данных мониторинга флоры, циркулирующей в данном отделении.
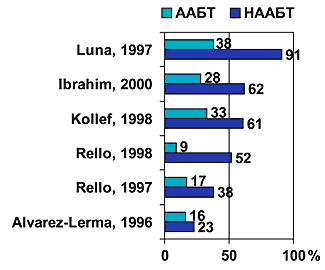
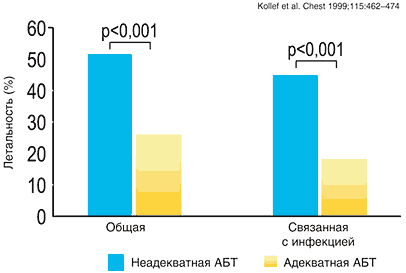
Сложность выбора адекватной эмпирической терапии подтверждена данными различных исследователей [3–6]. Так неадекватный выбор стартовой антибактериальной терапии нозокомиальных инфекций согласно этим исследованиям широко варьировал от 24% до 73%. В условиях отсутствия адекватной антибактериальной терапии, т.е. невозможности контроля очага инфекции, существенно ухудшаются результаты лечения. Согласно представленным сводным клиническим данным (рис. 1), эффективность эмпирической антимикробной терапии оказывает существенное влияние на исход заболевания. Так, пациенты отделения реанимации и интенсивной терапии, получавшие адекватную антимикробную терапию имели примерно в два раза меньшую летальность по сравнению с пациентами, получившими неадекватную антимикробную терапию. У пациентов с летальным исходом в результате инфекции (рис. 2) эффект влияния адекватности антибактериальной терапии выражен еще более существенно. Таким образом, неадекватная стартовая антимикробная терапия является независимым фактором риска неблагоприятного исхода тяжелых нозокомиальных инфекций.
Рис. 1. Сравнение летальности больных тяжелыми нозокомиальными инфекциями при адекватной (ААБТ) и неадекватной (НААБТ) стартовой антимикробной терапии [2,4-7]
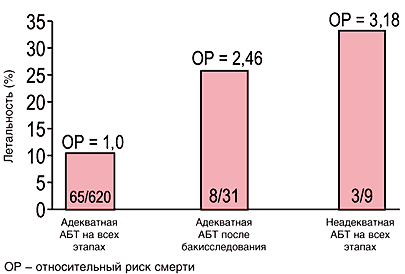
Еще одним важным фактором, влияющим на исход больных тяжелыми нозокомиальными инфекциями, является своевременность назначения адекватной стартовой терапии. На рисунке 3 представлены результаты сравнения влияния на результаты лечения больных нозокомиальным ангиогенным сепсисом [8]. В группе больных, получивших адекватную стартовую антимикробную терапию, летальность составила 11%, в группе получивших адекватную антибактериальную терапию после получения микробиологических данных, т.е. позже на несколько суток, летальность увеличилась до 26%. При этом относительный риск летального исхода увеличился в 2,5 раза. В группе, которая по разным причинам вовсе не получала адекватной антибактериальной терапии, летальность составила 34%, а относительный риск летального исхода по сравнению с первой группой вырос в 3,2 раза. Таким образом, у больных, которым антибактериальная терапия назначалась с задержкой или не назначалась вовсе, вероятность летального исхода оказалась близкой. То есть, не само по себе назначение антибактериальной терапии, а только назначение адекватной (эффективной) антибактериальной терапии оказывает существенное влияние на исходы тяжелых нозокомиальных инфекций.
Рис. 3. Снижение летальности больных ангиогенными инфекциями при применении адекватной АБТ
Оптимизация антимикробной терапии нозокомиальных инфекций
Учитывая тот факт, что неадекватный и несвоевременный выбор адекватной терапии являются факторами риска неблагоприятного исхода лечения инфекции, необходимо предпринимать меры, направленные на коррекцию этих недостатков. Оптимизация антибактериальной терапии может быть проведена за счет:
Расширение спектра антимикробных препаратов
Необходимо отметить, что понятие «широкого спектра антимикробной активности» препарата претерпевает определенные изменения в процессе его использования в клинической практике. Например, препараты тетрациклинового ряда, первоначально считавшиеся препаратами широкого спектра действия, к настоящему времени в значительной мере утратили это значение. Это происходит из–за изменения актуальности возбудителей инфекций, роста резистентности связанного с широким применением препарата в клинической практике и других причин. В зависимости от особенностей препарата, все эти факторы могут вообще привести к существенному ограничению его применения. Не все препараты широкого спектра одинаково активны в отношении различной флоры. Например, цефалоспорины 3 генерации, которые по сравнению с цефалоспоринами 1 и 2 генераций обладают более широким спектром активности в отношении грамотрицательной флоры, однако уступают им в активности в отношении стафилококков. По–видимому, в настоящее время наиболее широким спектром антимикробной активности обладают карбапенемы, цефалоспорины 4 генерации и фторхинолоны. Однако в отношении фторхинолонов происходит быстрый рост резистентности нозокомиальной флоры, что приводит к существенному ограничению их применения у пациентов с нозокомиальными инфекциями.
Исторически ограничение спектра активности антимикробного препарата компенсировали одновременным применением препарата, обладающего активностью в отношении других возбудителей. Это подход называется комбинированной терапией. Так, например, для расширения спектра природных пенициллинов и цефалоспоринов 1–2 генерации, обладающих высокой активностью преимущественно в отношении грамположительной флоры, применяются комбинации с препаратами других групп – аминогликозидами или фторхинолонами, обладающих преимущественной активностью в отношении грамотрицательной флоры. Комбинированная терапия может состоять из 2, 3 и более препаратов, однако имеются клинические данные, указывающие на отсутствие дополнительной клинической выгоды от применения 3 и более препаратов, одновременно с этим увеличивается вероятность возникновения токсических эффектов, обусловленных препаратами, входящими в комбинацию. Тем не менее до настоящего времени применение комбинированной терапии считается оправданным для эмпирической терапии полимикробных инфекций (абдоминальные инфекции) или лечения инфекций, вызванных резистентной флорой (Ps. aeruginosa).
Расширение спектра антимикробной активности может быть получено за счет внедрения новых препаратов. Так, внедрение в клиническую практику в середине 80–х годов ХХ века имипенема/циластатина (Тиенам), препарата, относящегося в то время к новому классу антимикробных препаратов – карбапенемов, имело очень важные последствия. Результаты многочисленных микробиологических исследований этиологической структуры различных, в том числе нозокомиальных инфекций, указывают на высокую активность этого класса препаратов. Важным отличием этого класса препаратов является ультраширокий спектр антимикробной активности, включающий возбудителей, относящихся к грамположительной, грамотрицательной и анаэробной флоре. Примерно за 20 лет клинического использования карбапенемов клинически значимое нарастание резистентности отмечено в последние годы только в отношении Ps. aeruginosa.
Клинические исследования последних лет указывают на необходимость лечения тяжелых инфекций, особенно нозокомиальных, антимикробными препаратами, обладающими широким спектром антимикробной активности, или комбинациями антимикробных препаратов. Применение препаратов широкого спектра в режиме эмпирической терапии позволяет увеличить вероятность клинической эффективности режима антимикробной терапии. Однако рост резистентности флоры, например, грамположительной (метициллинрезистентные стафилококки, резистентные энтерококки) приводит к необходимости в режиме эмпирической терапии, даже в случае применения карбапенемов, применять их в комбинации с препаратами, активными в отношении этой резистентной флоры (ванкомицин, линезолид). Но после получения результатов микробиологического исследования может оказаться, что резистентных грамположительных возбудителей не будет выявлено и необходимость в применении комбинированной терапии отпадет. Переход с комбинированной терапии на монотерпию нужно рассматривать, как применение принципа деэскалационной терапии.
Очень важным является вопрос о возможности деэскалационной терапии при применении в режиме эмпирической терапии монотерапии карбапенемами. Этот вопрос является не таким простым, как кажется на первый взгляд. Если карбапенемы, назначенные в режиме эпирической терапии абдоминального сепсиса, были заменены стандартными для лечения перитонита препаратами после стабилизации состояния больного и получения микробиологических данных о наличии внегоспитальной флоры, то изменение тактики антибактериальной терапии рассматривается, как деэскалационная терапия.
При применении карбапенемов в режиме монотерапии для лечения тяжелых госпитальных инфекций (нозокомиальная пневмония, связанная с проведением искусственной вентиляции легких), вопрос о возможности проведения деэскалационной терапии остается до настоящего не совсем ясным. С одной стороны, если нозокомиальная инфекция является основной причиной тяжести состояния пациента, корректно произведен посев из бронхов, выявлен возбудитель пневмонии и определена его чувствительность, то возможен переход на препараты более узкого спектра, т.е. проведение деэскалационной терапии. Однако при отсутствии микробиологических данных переход на деэскалационную терапию затруднителен. Также затруднителен переход на деэскалационную терапию при наличии нескольких локусов инфекции, не связанных между собой патогенетически (например, при инфицированном панкреонекрозе и наличии нозокомиальной пневмонии). Таким образом, деэскалационный принцип применения антимикробной терапии является гибким инструментом, направленным на контроль очага инфекции, позволяющим повысить эффективность антимикробной терапии и вместе с тем избегать избыточного применения антимикробных препаратов – важного фактора развития резистентности нозокомиальной флоры. Этапы реализации принципа деэскалационной терапии представлены на рисунке 5.
Рис. 5. Принцип применения деэскалационной антимикробной терапии
Выбор пациентов для проведения деэскалационной терапии и оценка эффективности
Принцип деэскалационной терапии должен применяться при лечении больных в критическом состоянии, тяжесть которых связана с течением инфекции и высокой вероятности летального исхода в случае неэффективности антибактериальной терапии. Теоретически нуждающимися в проведении этого принципа лечения являются группами пациентов с:
К настоящему времени, к сожалению, исследований, напрямую указывающих на высокую эффективность деэскалационной антибактериальной терапии при всех вышеуказанных нозологических формах, нет. Тем не менее имеются отдельные исследования, указывающие на высокую потенциальную возможность этого подхода.
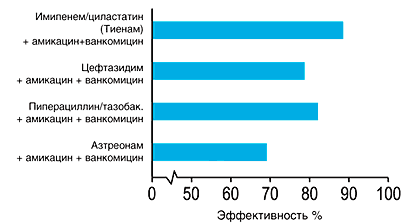
При применении метода деэскалационной терапии у тяжелых больных с нозокомиальной пневмонией, связанной с искусственной вентиляцией легких и наличием факторов риска резистентной нозокомиальной флоры (продолжительность ИВЛ более 7 суток и наличие предшествующей антибактериальной терапии) проведена оценка применения карбапенемных антибиотиков в сочетании с ванкомицином по сравнению со стандартной антибактериальной терапией [9].
На рисунке 6 показано достоверное повышение адекватности антибактериальной терапии в связи с применением комбинации препаратов, которая оказывается активной в отношении около 90% возбудителей нозокомиальной пневмонии по сравнению с 50% – при применении стандартной антимикробной терапии.
Рис. 6. Увеличение адекватности стартовой терапии после внедрения принципа деэскалационной терапии
Вторым преимуществом (рис. 7) применения указанной комбинации является достоверное укорочение продолжительности антибактериальной терапии примерно в два раза, что может существенно компенсировать затраты, связанные с применением в режиме деэскалационной терапии более дорогостоящих препаратов.
Рис. 7. Укорочение продолжительности антимикробной терапии при внедрении принципа деэскалационной терапии
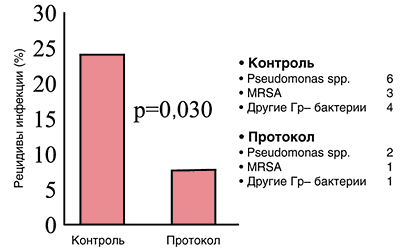
Третьим, не менее важным результатом данного исследования (рис. 8) явилось то, что у пациентов, которым применялась комбинация карбапенема и ванкомицина, достоверно снизилось количество рецидивов инфекции. Необходимо отметить существенное снижение количества резистентной флоры при развитии рецидива инфекции, что отражает способность выбранного режима терапии снижать риск появления и персистенции резистентной флоры. Так, количество выделенных штаммов резистентной флоры снизилось примерно в три раза.
Рис. 8. Снижение частоты рецидивов инфекции и повторного выделения резистентной флоры
Нозокомиальные инфекции представляют собой серьезную проблему современной клинической медицины. Рост резистентности нозокомиальной флоры опережает разработку новых препаратов для эффективного лечения инфекций, вызванных резистентной флорой. В этих условиях меры по повышению эффективности применения антибактериальных препаратов и ограничению роста резистентности нозокомиальной флоры необходимо гармонично сочетать. Многими экспертами в области антибактериальной терапии поддерживается концепция деэскалационной терапии и необходимости применения адекватной антимикробной терапии для стартовой терапии тяжелых инфекций [1,2]. Учитывая то, что концепция деэскалационной терапии выдвинута сравнительно недавно, крупных систематических исследований по оценке ее клинической эффективности недостаточно. Однако аргументы и логика применения этого подхода, имеющиеся клинические данные вписываются в объективную необходимость совершенствования глобальной стратегии антибактериальной терапии и заслуживают самого внимательного изучения и применения в клинической практике.
Нозокомиальные инфекции представляют собой серьезную проблему современной клинической медицины. Рост резистентности нозокомиальной флоры опережает разработку новых препаратов для эффективного лечения инфекций, вызванных резистентной флорой. В этих условиях меры по повышению эффективности применения антибактериальных препаратов и ограничению роста резистентности нозокомиальной флоры необходимо гармонично сочетать. Многими экспертами в области антибактериальной терапии поддерживается концепция деэскалационной терапии и необходимости применения адекватной антимикробной терапии для стартовой терапии тяжелых инфекций [1,2]. Учитывая то, что концепция деэскалационной терапии выдвинута сравнительно недавно, крупных систематических исследований по оценке ее клинической эффективности недостаточно. Однако аргументы и логика применения этого подхода, имеющиеся клинические данные вписываются в объективную необходимость совершенствования глобальной стратегии антибактериальной терапии и заслуживают самого внимательного изучения и применения в клинической практике.
1. Kollef MH et al. Chest 1999;115:462–474.
2. Ibrahim EH et al. Chest 2000;118:146–155.
3. Alvarez–Lerma F et al. Intensive Care Med 1996;22:387–394.
4. Kollef MH et al. Chest 1998;113:412–420.
5. Luna CM et al. Chest 1997;111:676–685.
6. Rello J et al. Am J Resp Crit Care Med 1997;156:196–200.
7. Trouillet et al. Am J Respir Crit Care Med 1998;157:531–539
8. Weinstein A et al. Clin Infect Dis 1997; 24: 584–602.
9. Ibrahim et al. Crit Care Med 2001;29:1109–1115