главный комплекс гистосовместимости что это
Выявление аллели 27 локуса В HLA (HLA-В 27) в Москве
Исследование для выявления аллели главного комплекса гистосовместимости HLAB27, ассоциированого с риском развития рядя аутоиммунных патологий: анкилозирующего спондилита, спондилоартропатии, аутоиммунных увеита и иритита, псориатического артрита и язвенного колита.
Приём и исследование биоматериала
Когда нужно сдавать анализ Выявление аллели 27 локуса В HLA (HLA-В 27)?
Утоняющая диагностика аутоиммунных заболеваний: болезни Бехтерева (анкилозирующего спондилоартрита), спондилоартропатии, аутоиммунных увеита и иритита, псориатического артрита и язвенного колита.
Подробное описание исследования
HLAB27 – генетический вариант главного комплекса гистосовместимости человека. Комплекс гистосовместимости – белковые молекулы на поверхности каждой клетки организма. Их существует несколько типов, и их сочетание определяет видовую и тканевую принадлежность клеток. Эти молекулы играют важную роль в функционировании иммунной системы.
Некоторые из типов молекул главного комплекса гистовместимости ассоциированы с высоким риском возникновения аутоиммунных патологий – тех заболеваний, которые возникают из-за развития иммунного ответа не на возбудителей заболеваний, а на клетки собственного организма. Это связано с тем, что маркеры возбудителей, на которые реагирует иммунная система, таких как бактерии или вирусы, схожи с некоторыми маркерами человеческих клеток. К таким и относится HLAB27. Приняв за возбудителя заболевания клетки, у которых на поверхности есть этот белок, иммунная система реагирует на них воспалением.
Так, если иммунная система начинает атаковать суставы, они воспаляются. Нарушается их функция: ограничивается подвижность, хрящевая ткань замещается костной, возникают боли и скованность. Поэтому типирование генов HLA проводят для изучения предрасположенности к риску возникновения ряда заболеваний или уточнения диагноза.
При интерпретации данных следует учитывать, что носителями этого гена могут быть и здоровые люди (около 5%). Обнаружение HLA-B27 возможно также при экземе, атопическом дерматите и бронхиальной астме.
Особенности и преимущества методики
Амплификация и детекция осуществляется на анализаторе ДТ-96 ООО «НПО ДНК-технология».
Что ещё назначают с этим исследованием?
Использованная литература
1. Лапин С.В., Мазина А.В., Булгакова Т.В. и др. Методическое руководство по лабораторной диагностике аутоиммунных заболеваний. Санкт-Петербурт, изд. СПбГМУ, 2011.
2. The general Practice guide to autoimmune disease. Ed. By Y.Shoenfeld, P.L.Meroni. PABST, 2012, 331 c.
3. Москалев А.В., Рудой А.С., Цыган В.Н., Апчел В. Я. Аутоиммунные заболевания: диагностика и лечение. Руководство ГЭОТАР-Медиа, 2020. 288 страниц.
Подготовка к исследованию
1. Кровь сдают утром натощак (после последнего приема пищи должно пройти как минимум 8 часов). Вечером накануне поужинайте легкой нежирной пищей.
2. За 2 часа до сдачи крови на анализ нельзя курить, пить кофе и чай, а также фруктовые соки. Допустимо употребление небольшого количества негазированной воды (не сладкой, не соленой, не минеральной).
3. В течение 24 часов до анализа крови нельзя употреблять алкоголь и лекарственные препараты (по согласованию с лечащим врачом).
4. За 1 час до исследования избегайте психоэмоционального напряжения, физического напряжения, такого как быстрый подъем по лестнице, бег. Желательно прийти в отделение лаборатории заблаговременно и в течение 10-15 минут до сдачи крови спокойно посидеть.
5. Не сдавайте кровь сразу после физиотерапевтических процедур, массажа, инструментальных обследований, таких как УЗИ и рентген в течение 5-7 дней. Это может повлиять на показатели крови и исказить результаты исследования.
6. Если вы контролируете лабораторные показатели в динамике, постарайтесь сдавать каждый анализ в одно и то же время при одинаковых условиях.
Противопоказания и ограничения
Абсолютных противопоказаний нет.
Интерпретация результата
Не выявлено: отсутствие генетического варианта аллели HLA-B27, низкий риск развития аутоиммунных патологий.
Выявлено: высокий риск аутоиммунных патологий.
Аналитические показатели
Специфичность метода – 95%-99%;
Чувствительность метода – 99%.
Главный комплекс гистосовместимости что это
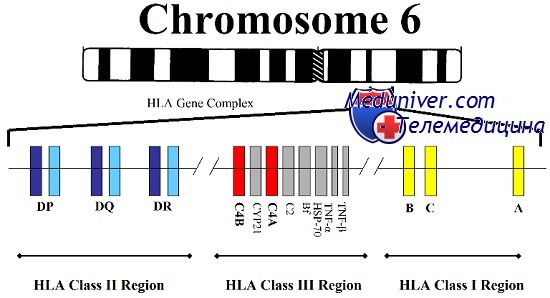
МНС формируется большой группой генов, расположенных на коротком плече хромосомы 6. На основе структурных и функциональных различий эти гены подразделяют на три класса, два из которых, класс I и класс II, относятся к генам HLA, первоначально обнаруженных благодаря их значению в пересадке тканей между неродственными индивидуумами.
Гены HLA класса I и II кодируют поверхностные белки клеток, играющие определяющую роль в инициации иммунного ответа, особенно в «распознавании» антигена лимфоцитами, которые не могут реагировать на антиген, если он не образует комплекс с молекулой HLA на поверхности содержащей антиген клетки. Известно много сотен разных аллелей HLA класса I и И, и ежедневно обнаруживают новые аллели, что делает их наиболее полиморфными локусами в геноме человека.
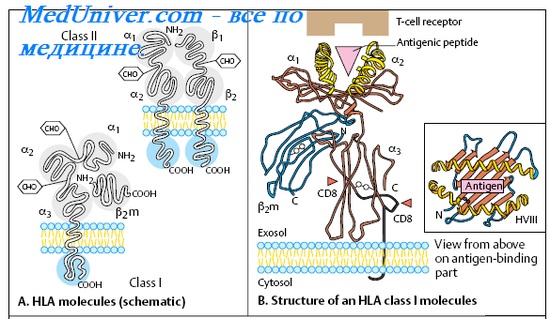
Гены класса I (HLА-А, HLA-B и HLA-C) кодируют белки, выступающие неотъемлемой частью плазматической мембраны всех ядерных клеток. Белки класса I состоят из двух полипептидных субъединиц: вариабельной тяжелой цепи, кодируемой в пределах МНС, и неполиморфного полипептида, b2-микроглобулина, кодируемого геном, расположенным за пределами МНС и картированным на хромосоме 15. Производные от внутриклеточных белков пептиды образуются путем протеолитического расщепления большими многофункциональными протеазами; затем пептиды перемещаются на поверхность клетки и прикрепляются к молекулам класса I, формируя пептидный антиген для цитотоксических Т-клеток.
Регион класса II состоит из нескольких локусов, таких как HLA-DP, HLA-DQ и HLA-DR, кодирующих поверхностные белки клеточной оболочки. Каждая молекула класса II — гетеродимер, сформированный из а- и b-субъединиц, закодированных в МНС. Молекулы класса II представляют пептиды, производные от внеклеточных белков, которые захватываются лизосомами и перерабатываются в пептиды, узнаваемые Т-клетками.
В пределах МНС присутствуют локусы и других генов, но не имеющих функционального отношения к генам HLA класса I и II и не определяющих гистосовместимость или иммунные ответные реакции. Некоторые из этих генов, тем не менее, связаны с болезнями, например врожденной гиперплазией надпочечников, вызываемую недостаточностью 21-гидроксилазы, и гемохроматозом, болезнью печени, вызванной накоплением железа.
Аллели и гаплотипы главного комплекса гистосовместимости (HLA)
Система HLA сначала может показаться запутанной, поскольку номенклатура, используемая для определения и описания разных аллелей HLA, подвергалась фундаментальным изменениям по мере распространения секвенирования ДНК МНС. Согласно более старой, традиционной системе номенклатуры HLA, разные аллели отличались друг от друга серологически. Индивидуальные типы HLA определялись тем, как панель различных антисывороток или чувствительных лимфоцитов реагирует на клетки.
Антисыворотки и клетки получали от сотен беременных, развивших иммунный ответ против отцовских антигенов I и II типа, экспремируемых плодами в ходе беременности. Если клетки от двух не связанных родственными отношения индивидуумов вызывали ту же реакцию при внесении в панель антител и клеток, считали, что они имеют те же типы и аллели HLA, обозначаемые их номером, например В27 в локусе HLA-B класса I или DR3 в локусе DR класса II.
Тем не менее после идентификации и секвенирования генов, ответственных за кодирование цепей МНС класса I и класса II, отдельные первоначально определенные серологически аллели HLA даже в пределах одного серологического аллеля оказались состоящими из многочисленных аллелей, определяемых различными вариантами последовательности ДНК. 100 серологически определяемых типов HLA-A, В, С, DR, DQ и DP теперь включают более 1300 аллелей, определяемых на уровне последовательности ДНК.
Например, в гене HLA-B, прежде определявшемся серологической реакцией как единый аллель В27, обнаружено более 24 различных вариантов последовательности нуклеиновых кислот. Большинство, хотя и не все, варианты ДНК представляют изменение кодона триплета и, следовательно, аминокислоты в пептиде, кодируемом этим аллелем. Каждый аллель, изменяющий аминокислоту в пептиде HLA-B, получает свой дополнительный последовательный номер, например аллель1, 2, и так далее в группе аллелей, соответствующих ранее единственному аллелю В27, и теперь называется HLA-B*2701, HLA-B*2702 и так далее.
Набор аллелей HLA в различных локусах класса I и II в данной хромосоме формирует гаплотип. Аллели кодоминантны; каждый из родителей имеет два гаплотипа и экспрессирует их оба. Эти локусы располагаются достаточно близко друг к другу, так что в конкретной семье гаплотип может передаваться ребенку как единый блок. В результате родитель и ребенок имеют общий гаплотип, а шанс, что два сибса унаследуют один гаплотип HLA, равен 25%.
Поскольку приживление пересаженных тканей в основном согласуется со степенью сходства между HLA гаплотипами донора и реципиента (и группы крови АВО), лучший донор костного мозга или органа — АВО-совместимый и HLA-идентичный сибс реципиента.
В любой этнической группе некоторые аллели HLA обнаруживаются часто, а другие — редко или никогда. Аналогично некоторые гаплотипы встречаются чаще, чем ожидалось, тогда как другие — исключительно редко или не встречаются вовсе. Например, большинство из Зх107 теоретически возможных комбинаций аллелей в гаплотипе в белой популяции никогда не встречаются. Это ограничение в разнообразии гаплотипов в популяции, возможно, вызвано ситуацией, получившей название неравновесного сцепления и может объясняться сложным взаимодействием множества факторов.
Эти факторы включают низкие показатели мейотической рекомбинации из-за небольшого расстояния между локусами HLA; влияние окружающей среды, обеспечивающее положительный отбор для конкретных комбинаций аллелей HLA, формирующих гаплотип; и исторические факторы, например, как давно образовалась популяция, число основателей и интенсивность происходившей иммиграции (см. далее в этой главе).
Между популяциями также существуют значительные различия в частоте аллелей и гаплотипов. То, что бывает частым аллелем или гаплотипом в одной популяции, может оказаться очень редким в другой. Различия в распределении и частоте аллелей и гаплотипов в пределах МНС — результат сложного взаимодействия генетических, средовых и исторических факторов в каждой конкретной популяции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Главный комплекс гистосовместимости (Major Histocompatibility Complex, МНС) у млекопитающих и его значение в изучении редких видов (на примере семейства Felidae)
К. К. Тарасян, П. А. Сорокин, М. В. Холодова, В. В. Рожнов
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33
e-mail: tarasyan_k@,mail.ru
Поступила в редакцию 07.11.2013 г.
Главный комплекс гистосовместимости (ГКГ) является удобным инструментом для решения разнообразных задач популяционной генетики. Информация о генетической основе иммунитета позволяет глубже понять эволюционную историю, оценить текущее состояние и перспективы выживания исследуемой популяции или вида. Вариабельность ГКГ поддерживается, с одной стороны, патоген-зависимыми механизмами: направленным отбором особей, устойчивых к присутствующим в среде их обитания заболеваниям, и балансирующим отбором, который дает преимущество особям, несущим необычные или редкие аллели генов ГКГ. С другой стороны, гены ГКГ влияют на эффективность размножения отдельных особей. Вследствие полигенности ГКГ его исследование требует использования ряда методик, вводящих дополнительные стадии между реакцией амплификации требуемого участка гена и его секвенированием. В статье рассмотрены различные способы разделения аллелей генов, а также упрощенный вариант анализа вариабельности ГКГ на основе содержащихся в нем микросаттеллитных локусов. Несмотря на высокую информативность главного комплекса гистосовместимости, его использование еще не получило распространения в зоологических работах. На примере хищных млекопитающих семейства кошачьих, в котором немало видов, находящихся в неблагополучном состоянии, показано, что большинство работ о ГКГ диких кошек носят описательный характер и только некоторые содержат сравнительный анализ генов нескольких видов кошачьих. Увеличение интереса к исследованиям главного комплекса гистосовместимости немодельных видов может помочь не только в решении фундаментальных вопросов эволюции и филогенетической структуры семейства, но и в планировании мер по охране редких и исчезающих видов, подвергающихся разнообразному антропогенному давлению.
Главный комплекс гистосовместимости что это
Иммунная система — совокупность органов, тканей и клеток, обеспечивающих структурное и генетическое постоянство клеток организма; образует вторую линию защиты организма. Функции первого барьера на пути чужеродных агентов выполняют кожа и слизистые оболочки, жирные кислоты (входящие в состав секрета сальных желёз кожи) и высокая кислотность желудочного сока, нормальная микрофлора организма, а также клетки, выполняющие функции неспецифической защиты от инфекционных агентов.
Иммунная система способна распознавать миллионы разнообразных веществ, выявлять тонкие различия даже между близкими по структуре молекулами. Оптимальное функционирование системы обеспечивают тонкие механизмы взаимодействия лимфоидных клеток и макрофагов, осуществляемые при прямых контактах и с участием растворимых посредников (медиаторов иммунной системы). Система обладает иммунной памятью, сохраняя информацию о предыдущих антигенных воздействиях. Принципы поддержания структурного постоянства организма («антигенной чистоты») основаны на распознавании «своего-чужого».
Для этого на поверхности клеток организма имеются гликопротеиновые рецепторы (Аг), составляющие главный комплекс гистосовместимости — МНС [от англ. major histocompatibility complex]. При нарушении структуры этих Аг, то есть изменении «своего» иммунная система расценивает их как «чужое».
Спектр молекул МНС уникален для каждого организма и определяет его биологическую индивидуальность; это и позволяет отличать «своё» (гистосовместимое) от «чужого» (несовместимого). Выделяют гены и Аг двух основных классов МНС.
Главный комплекс гистосовместимости ( МНС первого и второго класса ). Гены MHC I и MHC II.
Молекулы I и II классов контролируют иммунный ответ. Они сочетанно распознаются поверхностными дифференцировочными CD-Ar клеток-мишеней и участвуют в реакциях клеточной цитотоксичности, осуществляемой цитотоксическими Т-лимфоцитами (ЦТЛ).
• Гены MHC I класса определяют тканевые Аг; Аг класса МНС I представлены на поверхности всех ядросодержащих клеток.
• Гены MHC II класса контролируют ответ к тимусзависимым Аг; Аг класса II экспрессируются преимущественно на мембранах иммунокомпетентных клеток, включая макрофаги, моноциты, В-лимфоциты и активированные Т-клетки.
Главный комплекс гистосовместимости что это
В основе неудач по приживлению алло— и ксенотрансплантатов — распознавание «своего» и «чужого» — основополагающий принцип функционирования иммунной системы. Узнавание «своих» клеток обеспечивает система мембранных гликопротеиновых рецепторов, присутствующих на поверхности всех клеток организма. Эти гликопротеины составляют главный комплекс гистосовместимости — МНС [от англ. major histocompatibility complex].
Несовпадение этих гликопротеинов между трансплантатами и клетками организма-реципиента приводит к развитию иммунного ответа, то есть молекулы МНС проявляют свойства Аг. Поэтому их называют Аг гистосовместимости, а кодирующие их гены — генами гистосовместимости. Система МНС обеспечивает биологическую индивидуальность каждого организма и строго контролируется генами гистосовместимости.
У человека комплекс МНС иногда называют HLA [от англ. human leucocyte antigen, Аг лейкоцитов человека]. Б системе HLA известно более 100 Аг, сгруппированных в регионы HLA-A, HLA-B, HLA-C, HLA-D, HLA-DR. Их образование контролирует локус HLA, состоящий из ряда сублокусов, расположенных в хромосоме 6. Экспрессия Аг HLA в различных органах сильно варьирует: она наиболее выражена на лимфоцитах и клетках кожи, меньше — в лёгких, печени, почках, кишках, сердце и сосудах, а в наименьших количествах такие Аг присутствуют на мембранах клеток ЦНС.
Интенсивность, продолжительность и исход реакций отторжения определяются степенью антигенных различий между донором и реципиентом; уровнем реактивности реципиента; характером трансплантата, наличием в нём лимфоидной ткани, удельным содержанием Аг гистосовместимости и т.д.
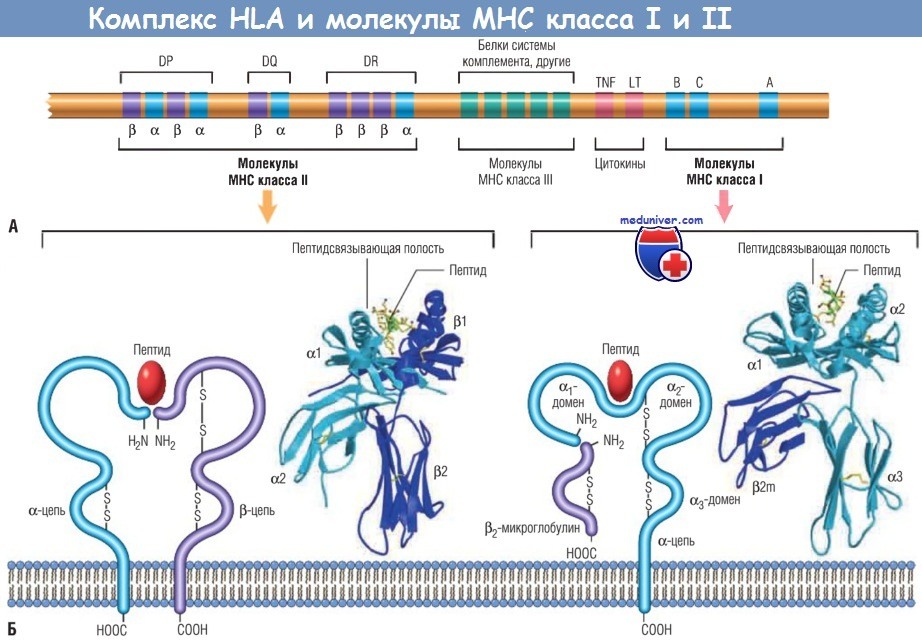
(А) Расположение генов комплекса HLA (положение, величина и расстояния между генами даны в произвольном масштабе).
Гены, кодирующие различные белки, которые участвуют в процессинге антигена (транспортеры, связанные с процессингом антигена компоненты протеасом и HLA-DM), располагаются в области класса II (не показаны).
(Б) Схематическое изображение и кристаллическая структура молекул HLA классов I и II.
LT — липопротеин; МНС — главный комплекс гистосовместимости; TNF — фактор некроза опухоли.
Гены главного комплекса гистосовместимости. Сильные антигены.
Все гены гистосовместимости разделяют на две категории:
Гены главного комплекса гистосовместимости кодируют «сильные» Аг, вызывающие у реципиентов быстрое отторжение трансплантатов. При трансплантации тканей (органа) от индивидуума, несовместимого по «сильным» Аг МНС, трансплантат отторгается в течение 1-2 нед. Повторная трансплантация ткани от того же донора сопровождается ускоренным разрушением трансплантата. Формирование иммунной памяти к данному набору трансплантационных Аг происходит за 4-5 сут и сохраняется на протяжении многих лет.
Гены минорного комплекса гистосовместимости. Слабые антигены.
Гены минорного комплекса гистосовместимости кодируют «слабые» Аг, вызывающие более медленное отторжение трансплантатов.