гормон прегненолон за что отвечает у женщин
Дисфункция надпочечников. Человек Уставший, продолжение.
Дисфункция – это как предболезнь. Заболевание еще не развилось, а жалобы есть, но они стертые, поэтому человеку плохо, но он не может понять, что с ним и с каким органом это состояние связать.
В современном обществе формируется неправильная тенденция социального поведения. Тебя постоянно подгоняют «еще, еще. больше работай, будь успешным, делай карьеру, но не забудь про семью, роди 2-3 детей (надо поднимать демографию страны), имей хобби, выучи языки, имей 2 образования, занимайся спортом, путешествуй, не забывай посещать театр (для кого-то ночной клуб, дискотеку), води машину и т.д.»
И как, скажите мне, человеку выдержать такой прессинг? Ни малейшего времени на передышку, на созерцание. Резервы организма ИМЕЮТ ПРЕДЕЛ, и у каждого свой срок «до срыва». И этим пределом часто является истощение функции надпочечников, одного из важнейших эндокринных органов.
Какими же симптомами дисфункция надпочечников может выражаться: (симптомы могут быть разной степени выраженности от минимальных до максимальных)
Как проверить работу надпочечников?
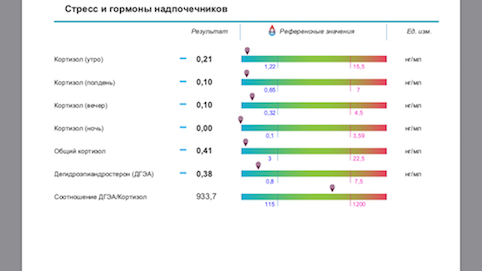
До 2015 года основным способом были: анализ крови на кортизол, АКТГ по часам 8:00- 24:00 (или еще промежуточно 13:00) и сбор суточной мочи на кортизол, кровь на ДГА-С. Это было крайне неудобно. Ни одна лаборатория, кроме расположенных в стационаре, кортизол в 24:00 не брала. А без этого показателя оценить функцию надпочечников правильно не возможно. Собирать суточную мочу не все соглашались, очень трудоемко и может быть не так достоверно.
С 2015-2016 года появился метод оценки кортизола слюны.
Собирается суточный профиль слюны на кортизол по 4 точкам 8:00- 13:00 и 17:00- 24:00.
Ниже привожу материал лаборатории «CHROMOLAB» по исследованию состояния надпочечников и его интерпретации.
«Организм человека постоянно подвергается воздействию различных факторов внешней и внутренней среды. Это могут быть абиотические факторы, такие как холод, жара, атмосферное давление, влажность, недостаток кислорода. Избыток или дефицит поступающих в организм веществ (белков, углеводов, липидов), недостаток витаминов и микроэлементов, вирусная или микробная инфекция, токсины также оказывают определенное влияние. Негативные последствия имеют вредные привычки, физическая перегрузка, переедание, гиподинамия, нарушение ритма сна и бодрствования. Кроме того, к серьезным стрессорам относят техногенные и психологические воздействия: переизбыток компьютерной и телевизионной информации, монотонный труд, конфликты, чрезмерную рабочую нагрузку, эмоциональное истощение, завышенный уровень ответственности, общую неудовлетворенность и прочее. Все эти и многие другие причины ведут к постоянному напряжению физиологических резервов организма, который вынужден приспосабливаться (адаптироваться) к этим факторам или защищаться. Если воздействия носят интенсивный, внезапный или незнакомый («новый») характер, то организм отвечает на них универсальной (в формате «скорой помощи») физиологической реакцией, называемой СТРЕССОМ (стрессорной реакцией). Стрессорная реакция не связана с положительным или отрицательным восприятием внешних раздражителей, с которыми сталкивается человек. Она необходима для скорейшей адаптации организма с целью его защиты от гибели. Стресс – это защитная реакция организма. Однако длительная стрессорная реакция приводит к избыточному нерегулируемому ответу организма на повреждающий фактор и обратному эффекту. Вместо защитных процессов активируются деструктивные, что может стать пусковым механизмом для развития патологических состояний: сахарного диабета, тромбозов, инсультов, инфарктов, аритмии, бесплодия, эректильной дисфункции, аллергии, онкологических заболеваний, иммунодефицитов, ранней менопаузы, остеопороза, гипотиреоза, бессонницы, депрессии, ожирения, анорексии и многого другого. Стресс инициирует различные патологические состояния, и это зависит от провоцирующих факторов внешней и внутренней среды.»
Стадийность стрессорных реакций. Выделяют три стадии стресса (согласно Г. Селье):
Глубокое понимание механизмов регуляции стресса стало возможным благодаря исследованию процессов синтеза, обмена и метаболизма стероидных гормонов коры надпочечников: кортизола и дегидроэпиандростерона (ДГЭА), которые регулируют реализацию стрессорной реакции.
Согласно современным исследованиям, физиологический смысл этого феномена заключается в том, что ДГЭА – это мощный естественный антиглюкокортикоид, противостоящий кортизолу, уровень которого резко повышается при любом стрессе. Известно, что отношение ДГЭА к кортизолу следует рассматривать как ключевой маркер устойчивости организма к любому стрессу, для обеспечения которой в целях адекватной защиты в организме всегда должен превалировать уровень ДГЭА.
Оценку суточного ритма секреции кортизола по его концентрации в слюне (4-кратное определение в течение дня в разных порциях слюны) применяют для отличия стрессорной реакции от иных патологических состояний, связанных с дисфункцией секреции стероидных гормонов.
Оценка проводится только врачом.
Известно, что уровень кортизола – величина непостоянная, и он подвержен колебаниям в течение суток.
С 7 до 9 часов утра концентрация кортизола максимальна, в связи с чем утренний уровень этого гормона считается хорошим индикатором для определения функционального состояния надпочечников.
С 11 часов утра до 13 часов дня концентрация кортизола возвращается к среднему значению, что служит показателем адаптивной функции надпочечников.
С 15 до 17 часов дня уровень кортизола постепенно опускается.
С 22 часов вечера до полуночи концентрация гормона находится на самом низком уровне, что отражает нормальную надпочечниковую функцию.
Такое развернутое исследование надпочечников поможет определиться с диагнозом, нет ли здесь дебюта надпочечниковой недостаточности или это просто дисфункция и определиться с лечебной тактикой. Ведь кому-то надо будет отдохнуть и правильно питаться. А кому-то понадобится подобрать препараты гормонов надпочечников сроком от 1,5-3-х месяцев до пожизненной терапии при выявленной надпочечниковой недостаточности. Радует то, что надпочечниковая недостаточность встречается очень редко.
НО очень часто встречается дисфункция.
Особенную благодарность в идее составления этой статьи выражаю своему учителю Гострому Андрею Владимировичу.
Рэй Пит по-русски
Переведено с разрешения автора © Ray Peat Ph.D.
16 мая 2018 г.
Три гормона молодости — прогестерон, прегненолон и ДГЭА
Прогестерон
Ш естьдесят лет назад было установлено, что прогестерон — это основной гормон, вырабатываемый яичниками. Поскольку он необходим для фертильности и для поддержания здоровой беременности, его назвали «про-гестационным гормоном», и его название иногда наводит людей на мысль, что он не нужен, если вы не хотите забеременеть. В действительности, это самый защитный гормон, производимый организмом. В больших количествах он вырабатывается во время беременности, как результат запроса развивающегося ребенка на защиту от стрессов окружающей среды. Как правило, мозг содержит прогестерон в очень высокой концентрации, что является отражением защитной функции гормона для этого наиболее важного органа. Тимус, ключевой орган нашей иммунной системы, также сильно зависит от прогестерона.
Было установлено экспериментально, что прогестерон является основным гормоном адаптации и устойчивости к стрессу. Надпочечники используют его для производства своих антистрессовых гормонов, и в случае достаточного количества прогестерона, они не должны производить потенциально губительный кортизол. При дефиците прогестерона, мы производим слишком много кортизола, а избыточное количество кортизола вызывает остеопороз, старение кожи, повреждение клеток мозга и накопление жира, особенно на спине и животе.
Эксперименты показали, что прогестерон устраняет тревожное состояние, улучшает память, защищает клетки мозга и даже предотвращает эпилептические припадки. Он содействует дыханию, его используют для коррекции эмфиземы. В кровеносной системе он предотвращает выпячивание вен, увеличивая тонус кровеносных сосудов, и повышает эффективность работы сердца. Он устраняет многие из признаков старения в коже, а также способствует здоровому росту костей. Он может облегчить многие типы артрита, и помогает при различных иммунологических проблемах.
Если прогестерон употреблять растворенным в витамине Е, то он очень эффективно всасывается и быстро распределяется по всем тканям. Если у женщины есть яичники, прогестерон помогает в регуляции их работы и в производстве гормонов. Он помогает восстановлению нормального функционирования щитовидной железы и других желез. Если у женщины яичники были удалены, прогестерон следует принимать регулярно, чтобы заменить утраченный источник. Дефицит прогестерона часто ассоциируется с повышенной восприимчивостью к раку, поэтому прогестерон использовали для лечения некоторых видов рака.
Важно подчеркнуть, что прогестерон — это не только гормон беременности. Представление о том, что прогестерон нужен только для «защиты матки» аналогично идее, согласно которой мужчине, мол, тестостерон не нужен, если в планах нет желания стать отцом. При этом прогестерон имеет значительно более важное и фундаментальное физиологическое значение, чем тестостерон. Хотя мужчины действительно вырабатывают прогестерон естественным путем и иногда могут извлечь пользу от его применения, это не мужской гормон. У некоторых людей возникает такая идея, поскольку иногда врачи рекомендуют комбинировать эстроген с прогестероном или тестостероном, чтобы избежать некоторых побочных эффектов эстрогена. Прогестерон — это естественное комплементарное дополнение организма к эстрогену. Если применять только прогестерон, то часто отпадает необходимость использовать эстроген для устранения приливов жара, бессонницы или других симптомов менопаузы.
Будучи растворенным в витамине Е, прогестерон проникает в кровь практически сразу, как только вступает в контакт с любой мембраной, такой как губы, язык, десна, нёбо, а если его проглотить, то всасывание продолжится в процессе пищеварения. Если употребить его с пищей, то его всасывание будет происходить со скоростью переваривания и всасывания пищи.
Прегненолон
Естественный прегненолон присутствует в очень большой концентрации у молодых людей обоего пола, одна из причин выработки его больших количеств в молодости заключается в том, что прегненолон — один из наших базовых защитников от побочных эффектов, которые могут возникнуть из-за дисбаланса даже наших естественных гормонов. Избыточные естественные кортизон или эстроген могут быть опасными, но изобилие прегненолона их побочные действия предотвращает или минимизирует.
Прием даже больших доз прегненолона на здорового молодого человека или животное не оказывает никакого гормонального или лекарственного действия. И в этом смысле прегненолон уникален. Ведь если животное или человек находятся в состоянии стресса и вырабатывают больше кортизона, чем обычно, прием прегненолона вызывает снижение кортизона до нормального уровня. После 40 или 45 лет, похоже, каждый человек живет в состоянии постоянного «стресса», что является нормальной составляющей процесса старения. Это совпадает с уменьшенной способностью организма производить много прегненолона.
Когда стареющим крысам дают прегненолон дополнительно, это сразу улучшает их память и вообще жизнедеятельность. Исследования 1940-х годов на людях также показали, что улучшалось выполнение обычных задач. Сегодня известно, что прегненолон в мозге — один из основных гормонов. Его вырабатывают определенные клетки мозга, также он поступает в мозг с кровью. Он защищает клетки мозга от повреждения, вызванного утомлением, адекватное его количество оказывает успокаивающее действие на эмоции, частично по этой причине он защищает нас от такой реакции на стресс, которая ведет к чрезмерной выработке кортизона. Люди чувствуют в настроении силу и способность противостоять вызовам.
Главный «антистрессовый» гормон организма
Дегидроэпиандростерон или ДГЭА — является гормоном с андрогенной активностью. ДГЭА отвечает за развитие вторичных половых признаков, поддержание половой функции, а также обладает анаболическим действием. 90% гормона образуется в коре надпочечников, остальные 10% синтезируется у мужчин в семенниках, у женщин в яичниках.
Предшественником ДГЭА является холестерин. В свою очередь, ДГЭА преобразуется в другие стероидные гормоны. В организме мужчин ДГЭА конвертируется в более сильные андрогены: тестостерон и андростендион; у женщин — эстроген и прогестерон. Производство гормона происходит под контролем АКТГ.
Уровни ДГЭА достигают пика в юношеском возрасте, а затем постепенно снижаются. В 70–80 лет значения ДГЭА составляют лишь 10–20% от пикового значения в пубертатном периоде.
ДГЭА во многом работает как синергетический близнец другого гормона стресса — кортизола. Это помогает организму более эффективно адаптироваться к стрессовому воздействию. Стресс может быть любым: физическим, психическим и эмоциональным, но его воздействие всегда происходит длительно. Например, учеба, которая дается человеку с трудом или изнуряющие условия на работе — могут стать источником серьезных проблем для здоровья.
Исследования показали, что снижение уровня ДГЭА связано с аллергией, воспалением, усталостью, аутоиммунными проблемами, сексуальной дисфункцией, инфекциями, бессонницей, снижением когнитивных функций, сердечно-сосудистыми заболеваниями, потерей массы костной ткани, депрессией и раком.
ДГЭА и кардиоваскулярная патология
ДГЭА оказывает защитное действие по отношению к заболеваниям сердечно-сосудистой системы. Результаты исследования, опубликованные в 2014 г в журнале Американского колледжа кардиологов, показали, что низкий уровень ДГЭА в крови связан с риском развития коронарной болезни сердца у пожилых мужчин. Ученые из Гарвардской школы общественного здравоохранения обнаружили связь между низкими уровнями ДГЭА и высоким риском развития инсульта у пожилых женщин.
ДГЭА и остеопороз
ДГЭА улучшает минеральную плотность костной ткани и тормозит остеопороз. Особенно это важно для женщин, которые находится в постменопаузе и страдают от дефицита женских половых гормонов.
ДГЭА и сексуальное поведение
Здоровые уровни ДГЭА поддерживают здоровую сексуальную жизнь. ДГЭА улучшает либидо у мужчин и женщин в равной степени.
ДГЭА и когнитивные функции
Исследования показали, что ДГЭА поддерживает здоровые когнитивные функции и настроение. Гормон поддерживает производство и функционирование нейротрансмиттеров в мозге — химических веществ, которые влияют на память и настроение.
Было обнаружено, что ДГЭА обладает регенеративной активностью по отношению к тканям мозга. Люди, страдающие от болезни Альцгеймера, имеют низкий уровень факторов роста, жизненно необходимых для нервной ткани. ДГЭА может защитить тонкие ткани мозга, сохранив их.
Люди с низким уровнем ДГЭА более восприимчивы к тревоге и депрессии.
ДГЭА и метаболический ответ на инсулин
ДГЭА предотвращает развитие сахарного диабета. Гормон позволяет клеткам более эффективно усваивать глюкозу, тем самым снижая резистентность тканей к инсулину. Как известно, это ведущая причина развития сахарного диабета 2-го типа.
ДГЭА и здоровье иммунной системы
ДГЭА имеет решающее значение для укрепления иммунной системы. При хроническом стрессе уровень кортизола падает, и иммунная система оказывается подавленной. Но здоровые уровни ДГЭА могут уравновесить это состояние.
Некоторыми исследователями было продемонстрировано, что ДГЭА играет определенную роль в борьбе с аутоиммунными состояниями, особенно с красной волчанкой.
Недостаток ДГЭА способствует ряду заболеваний и состояний, поэтому для поддержания оптимального сердечно-сосудистого здоровья и жизнеспособности на протяжении всей жизни важно следить за уровнем ДГЭА. Возможно определение гормона в образцах крови, а также в образцах слюны.
Поскольку для хорошего здоровья имеет значение правильный баланс гормонов, поэтому уровень ДГЭА сопоставляют с уровнем кортизола.
Тестирование уровня ДГЭА и сохранение гормонального баланса между стресс-гормонами является ключом успеха на пути к долголетию. Хороший уровень ДГЭА поможет почувствовать себя моложе, сильнее и увереннее.
Аллопрегнанолон и нейровоспаление
Стероиды, синтезируемые из предшественников в центральной или периферической нервной системе, привлекают значительное внимание многих исследователей в последние годы. Гематоэнцефалический барьер (BBB) является проницаемым для стероидов, вырабатываемых гонадой и надпочечниками, а точная нейроанатомическая сегрегация локально синтезированных стероидов, то есть нейростероидов, дает им явное преимущество перед периферическими стероидами с точки зрения оказания специфических для мозга эффектов в нервной системе. В дополнение к связыванию с внутриклеточными стероидными рецепторами некоторые нейростероиды взаимодействуют с рецепторами нейротрансмиттеров, таким образом влияя на биологию отдельных типов нервных клеток.
Восстановление локально синтезированного или периферического производного прогестерона до дегидропрогестерона (DHP) и тетрагидропрогестерона (THP) является одним из широко изученных факторов пути синтеза нейростероидов. В то время как прогестерон и DHP могут связываться с внутриклеточными стероидными рецепторами, преобладающая форма THP, аллопрегнанолон, может взаимодействовать только с рецепторами GABA-A на клеточной поверхности и передавать по ним сигналы.
Производное прогестерона аллопрегнанолон (АLLО) является одним из наиболее широко изученных соединений среди нейростероидов. Было показано, что посредством взаимодействия с рецепторами GABA-А, экспрессируемыми нейронами и глиальными клетками, ALLO влияет на различные аспекты физиологии нервных клеток, включая пролиферацию и выживание клеток, миграцию и экспрессию генов. Последние данные указывают на важную роль ALLO в различных нейродегенеративных заболеваниях, включая болезнь Альцгеймера, болезнь Паркинсона и рассеянный склероз (РС). О нарушении регуляции в путях биосинтеза ALLO сообщалось в ткани мозга пациентов с РС, а также в ткани центральной нервной системы (ЦНС), полученной на моделях животных с РС. Было показано, что введение аллопрегнанолона уменьшает нейроповеденческий дефицит вместе с воспалением в ЦНС животных с аутоиммунной демиелинизацией.
Эти результаты согласуются с сообщениями, указывающими на стимулирующее рост и дифференцировку действие ALLO на нейроны и глиальные клетки, а также на его нейропротекторное эффекты в контексте других заболеваний ЦНС. Эти результаты также повысили вероятность того, что ALLO может влиять на биологию лейкоцитов и связанные с ней нейровоспалительные механизмы независимо от его нейрорегенеративных свойств.
Локализованная и четко разграниченная природа патологии при РС заставляет задуматься о том, может ли очаговая дисрегуляция в микросреде ЦНС способствовать процессу заболевания в дополнение к инфильтрации миелин-реактивных Т-клеток и других лейкоцитов. Многочисленные исследования показали связь между рассеянным склерозом и стероидными гормонами.
После открытия нейростероидов в ЦНС были предприняты попытки выяснить роль этих соединений и их потенциальную дисрегуляцию в контексте рассеянного склероза и нейровоспаления.
Роль прогестерона и его потенциальных производных в демиелинизирующих заболеваниях изучалась в течение многих лет (Shuster, 2008 ). До идентификации путей синтеза нейростероидов в головном мозге сообщалось, что лечение мышей с экспериментальным аутоиммунным энцефаломиелитом прогестинами улучшало течение заболевания (Arnason and Richman,1969). Более поздние исследования дополнительно подчеркнули защитную и противовоспалительную роль прогестерона при аутоиммунном энцефалите (Garay et al., 2007 ). Было показано, что обработка прогестероном нейроантиген-реактивных CD4 + T-клеток, выделенных от пациентов с рассеянным склерозом, влияет на их выработку цитокинов. Прогестерон и его восстановленная форма дегидропрогестерон (DHP) могут связываться с внутриклеточными рецепторами прогестерона и оказывать геномные эффекты посредством измененной экспрессии генов, чувствительных к прогестерону. Однако у ALLO нет этой способности, и он может оказывать свое влияние только через взаимодействие с рецепторами ГАМК-А. Учитывая, что экзогенно вводимый прогестерон может быть легко восстановлен до ALLO в разных клетках, защитные эффекты, о которых сообщалось в отношении прогестерона, вероятно, были следствием как геномной регуляции, так и путей, опосредованных GABA-A-рецептором.
Последующие исследования предоставили более конкретные доказательства, подтверждающие роль ALLO в патогенезе рассеянного склероза. В исследовании, проведенном на вскрытии ткани головного мозга человека, группа авторов показала, что уровни ALLO были значительно снижены в белом веществе мозга, полученном от пациентов с РС, по сравнению с контрольными индивидуумами. Снижение было связано с уменьшением уровней двух важнейших вышеперечисленных ферментов, которые участвуют в превращении прогестерона в ALLO, то есть 5-α-редуктазы и AKR1C1 / C2, в белом веществе мозга пациентов с РС. Уровни дальнейшего восходящего фермента, 3-α-HSD, который участвует в превращении прегненолона в прогестерон, в мозге МС не изменялись. Интересно, что анализ уровней 3α, 5β-THP, минорной изоформы THP, не выявил каких-либо изменений в тех же тканях головного мозга, что указывает на специфическое подавление в 3α, 5α-ALLO изоформе. Подобный анализ тканей спинного мозга, полученных от мышей EAE, показал снижение уровней ALLO, но не изоформ минорной THP у мышей EAE по сравнению с контрольными животными. Опять же, подавление ALLO было связано с пониженными уровнями РНК и белка мышиных изоформ ферментов AKR1, akr1c14 и akr1e1.
Со времени открытия дисрегуляции ALLO при некоторых неврологических расстройствах, ALLO и его синтетические аналоги рассматривались на предмет их потенциальных терапевтических или модифицирующих заболевание эффектов при заболеваниях головного мозга.
Гормон прегненолон за что отвечает у женщин
Определение в крови концентрации одного из предшественников стероидных гормонов прегненолона, используемое для диагностики адреногенитального синдрома.
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Прегненолон – это один из предшественников синтеза стероидных гормонов, таких как кортизол, альдостерон и половые гормоны (тестостерон и эстрадиол). Его уровень исследуют при подозрении на адреногенитальный синдром.
Адреногенитальный синдром (другое название – врождённая гиперплазия коры надпочечников) – это группа наследственных нарушений синтеза стероидных гормонов, возникающих в результате дефицита одного из ключевых ферментов стероидогенеза. На сегодняшний день выявлено несколько мутаций в различных ферментах, приводящих к адреногенитальному синдрому. Наибольшее клиническое значение имеют следующие ферментопатии:
Хотя указанные ферментопатии имеют некоторые характерные клинические признаки, их дифференциальная диагностика опирается на лабораторное исследование, в ходе которого исследуют концентрацию нескольких стероидных гормонов и их предшественников. Чаще признаки адреногенитального синдрома выявляются в младенчестве или раннем детстве, однако известны случаи более поздней манифестации этой патологии.
На первом этапе подтверждают наличие адреногенитального синдрома и исключают наиболее часто встречающиеся ферментопатии (дефицит 21 и 11-гидроксилаз) с помощью исследования уровня кортизола, андростендиона и 17-гидроксипрогестерона. Если на основании полученных результатов указанные ферментопатии исключаются, переходят ко второму этапу исследования: исключение редких ферментопатий (дефицит 3-бета-гидроксистероиддегидрогеназы и 17-альфа-гидроксилазы) с помощью тестов на прегненолон и 17-гидроксипрегненолон. На основании результатов этих исследований и клинической картины удается установить точный диагноз. Характерные концентрации стероидных гормонов и некоторые другие диагностические признаки разных ферментопатий представлены в таблице:
21-гидроксилаза
11-бета-гидроксилаза
17-альфа-гидроксилаза
3-бета-гидроксистероиддегидрогеназы