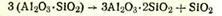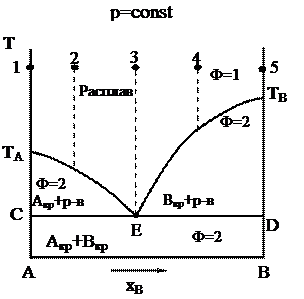Что характеризует диаграмма состояния системы na2o sio2
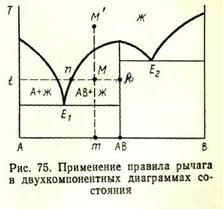
Применение правила рычага в двухкомпонентных системах



Для двухкомпонентных систем применение правила рычага сводится к рассмотрению соответствующих коннод, концы которых показывают точки составов фаз, находящихся в равновесии, при-
чем сама коннода вертикалью исходного состава делится на два отрезка, длины которых (в обратной пропорциональности) характеризуют количества равновесных фаз. Предположим, что исходный расплав состава М’ (рис. 75) охлажден до температуры t.При этой температуре в равновесии находятся жидкая фаза, состав которой выражается точкой n, и твердая фаза (кристаллы соединения АВ), состав которой выражается точкой k, лежащей на вертикали состава соединения АВ. Исходный состав можно выразить точкой М, лежащей на пересечении конноды nkс вертикалью исходного состава М’т(составы М’иМ одинаковы). По правилу рычага содержание при температуреtжидкой фазы (точка п) и кристаллической фазы АВ (точка k) определится из выражений:
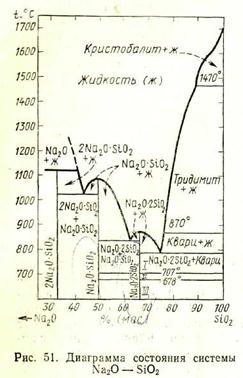
На рис. 51 изображена наиболее полно изученная часть диаграммы состояния системы Na2O—SiO2 по Ф. Крачеку, начиная с составов, содержащих менее
70% (мас.) Na2O. В этой части системы существуют следующие двойные соединения: ортосиликат натрия 2Na2·SiO2, метасиликат натрия Na2O·SiO2 и дисиликат натрия Na2O·2SiO2. Ортосиликат натрия плавится инконгруэнтно при 1118°С, разлагаясь на жидкость состава 59,3% (мас.) Na2O и 40,7% (мас.) SiO2 и кристаллы Na2O, мета- и дисиликаты натрия плавятся конгруэнтно: первый при 1089°С и второй при 874°С. Дисиликат натрия имеет несколько полиморфных разновидностей: на диаграмме состояния они обозначены /, //и/// с температурами полиморфных превращений 707°С и 678°С. Кроме этих полиморфных превращений Ф. Крачеком были обнаружены также полиморфные переходы дисиликата натрия при температурах 593, 573 и 549°С. Таким образом, по Ф. Крачеку, Na2O·2SiO2 имеет шесть полиморфных разновидностей.
Существуют и несколько иные данные относительно указанной части диаграммы состояния системы Na2O—SiO2. В частности, некоторые авторы относят 2Na2O·SiO2 к соединениям, плавящимся конгруэнтно при 1083°С и имеющим полиморфное превращение при 960°С. Имеются также данные о существовании других кристаллических силикатов натрия, кроме приведенных на диаграмме, в частности, 3Na2O·2SiO2 с температурой конгруэнтного плавления 1122°С и трисиликата натрия Na2O·3SiO2 с температурой плавления 750°С.
Соединения системы Na2O—SiО2 по сравнению с большинством других силикатных соединений весьма легкоплавкие. Диаграмма Na2O—SiO2 является ярким примером того, насколько сильно
может понижаться температура плавления смесей за счет образования эвтектик. Например, температура ликвидуса снижается от 1728°С для чистого SiO2 до 790 °С для эвтектики между SiO2 и Na2O·2SiO2, содержащей 73,9% (мас.) SiO2 и 26,1% (мас.) Na2O, т. е. почти на 1000 °С. Этим объясняется характерный для этой диаграммы резкий подъем кривой ликвидуса от эвтектики между SiO2 и Na2O·2SiO2 к температуре плавления кристобалита. Это позволяет получать в этой системе различные легкоплавкие стекла.
Система Na2O—SiO2 является частной по отношению ко многим поликомпонентным системам большого прикладного значения, например, по отношению к системам Na2O— MgO—SiO2 и Na2O—CaO— SiO2, важным для стеклоделия, к системе Na2O—Fe2O3—SiO2, имеющей значение для объяс-
нения процессов магматической дифференциации и т. д. Двухком-
понентная система Na2O—SiO2 имеет специальное значение для
технологии изготовления натриевых растворимых (жидких) стекол,
представляющих собой стеклообразные силикаты натрия перемен
ного состава с общей формулой mNa20-n Si02.
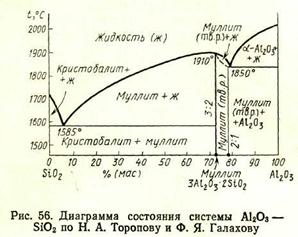
Система AI2O3—SiO2 (рис. 55) впервые была детально изучена Н. Боуэном и Д. Грейгом, по данным которых в системе существует только одно бинарное соединение — муллит, состав которого соответствует формуле ЗА12Оз·2 SiO2. По Н. Боуэну и Д. Грейгу, муллит плавится инконгруэнтно при 1810°С, разлагаясь на корунд а-А12Оз и жидкость состава
Более поздние исследования, проведенные советским учеными Н. Д. Тороповым и Ф. Я. Галаховым, позволили внести существенные изменения в диаграмму состояния системы А12Оз—SiO2. Прежде всего было показано, что выделение корунда при плавлении

Диаграмма состояния системы А12Оз—SiO2 по Н. А. Торопову и Ф. Я. Галахову представлена на рис. 56. Согласно этой диаграмме муллит плавится конгруэнтно при 1910°С и образует две эвтектики: одну с SiO2 при 1585°С и вторую (в виде твердого раствора) с А12О3 при 1850°С, соответствующую содержанию 79% (мас.) А12Оз и 21% (мас.) SiO2. Область твердых растворов муллита с корундом простирается от состава муллита (3:2), соответствующего содержанию 71,8% (мас.) А12О3 и 28,2% (мас.) SiO2, до предельного состава (2 : 1), соответствующего содержанию
78% (мае.) А12О3 и 22% (мае.) SiO2. Дальнейшие исследования П. П. Будникова, С. Г. Тресвятского и В. И. Кушаковского, а также С. Арамаки и Р. Роя подтвердили принципиальную правильность диаграммы состояния А12Оз—SiO2, предложенную Н. А. Тороповым и Ф. Я. Галаховым. Некоторые указывают также на возможность образования ограниченных твердых растворов между муллитом и SiO2.
Рассмотрим некоторые особенности системы А12О3—SiO2. Прежде всего нужно обратить внимание на то, что на диаграмме состояния этой системы отсутствует какой-либо максимум на кривой ликвидуса, который бы соответствовал соединению Al2O3-SiO2 [62,9% (мас.) А12О3 и 37,1% (мас.) SiO2], распространенному в природе в виде минералов группы силлиманита (силлиманит и его разновидности — кианит и андалузит). Это объясняется тем, что при обычном давлении, при котором построены приведенные диаграммы, соединение А12О3·SiO2 не имеет области устойчивого равновесного состояния. Однако, как показывают некоторые исследования, при высоких давлениях такие области на диаграмме состояния системы Al2O3·SiO2 появляются. Так, например, при давлении 2520 МПа устойчивым бинарным соединением в этой системе является уже не муллит, а кианит, плавящийся инконгруэнтно
1500°С. В природе минералы группы силлиманита образовались из каолинита Al2O3·2SiO2·2H2O в специфических условиях под воздействием высоких температур и давлений. Синтетически же при обычном давлении их получить не удается, так как при нагревании они необратимо переходят в муллит и коистобалит:
Другая особенность диаграммы состояния системы А12О3—SiO2, оказывающая большое влияние на практическое применение некоторых технических продуктов, состав которых лежит в этой системе, состоит в весьма пологом характере кривой ликвидуса в области кристаллизации муллита, лежащей влево от его состава. Такой пологий ход кривой ликвидуса обусловливает очень быстрое нарастание содержания жидкой фазы при нагревании смесей, содержащих от 5,5% (мас.) (эвтектика при 1585°С) до —72% (мас.) А12О3. Отсюда следует, что при температурах выше 1600°С для составов, содержащих указанное количество А12О3, содержание жидкой фазы в системе будет очень сильно зависеть от соотношения в образцах А12О3 и SiO2.
Система А12О3—SiO2 имеет особенно большое значение для технологии производства различных алюмосиликатных огнеупоров и изделий тонкой керамики и интерпретации процессов, протекающих при их обжиге, а также для понимания явлений, происходящих при взаимодействии алюмосиликатных огнеупоров с различными агрессивными средами.
Диаграммы плавкости двухкомпонентных систем



Диаграммы плавкости двухкомпонентных систем.
Для двухкомпонентных гомогенных (однофазных) систем (Ф = 1) по правилу фаз Гиббса имеем:
f = K + 2 – Ф = 2 + 2 – 1 = 3, (1)
т. е. для описания состояния таких систем достаточно трёх переменных: давления, температуры и концентрации. Следовательно, для их графического изображения надо использовать объёмную (трёхмерную) диаграмму. Чтобы свести её к плоской, необходимо сократить число переменных. Поэтому при изучении конденсированных систем чаще всего строят диаграммы «точка кристаллизации (плавления) – состав» при постоянном давлении (обычно р = 1 атм.), благодаря чему диаграмма становится плоской.
Рассмотрим некоторые двойные системы различных типов.
1. Системы с неограниченной взаимной растворимостью компонентов в твердом и жидком состоянии (изоморфные смеси).
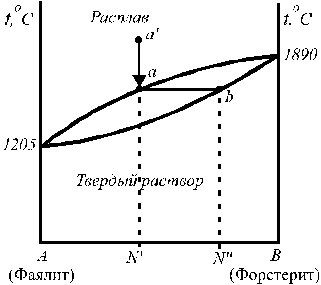 |
На диаграмме, представленной на рис. 1, верхняя кривая (ликвидус) описывает зависимость температуры кристаллизации (плавления) от состава жидкого раствора (расплава), нижняя кривая (солидус) — зависимость температуры плавления от состава твердого раствора. Такие системы обычно образуют вещества, которые имеют одинаковый тип и близкие параметры кристаллической решетки (например, системы: медь – никель, золото – серебро) Состав выпадающих кристаллов не совпадает с составом равновесной с ними жидкости. В случае значительных отклонений от идеальности жидкого раствора на диаграмме состояния появляются экстремумы (например, для системы Сu – Au на диаграмме состояния есть минимум Тпл).
2. Плоская диаграмма плавкости (р = const) двухкомпонентных систем с неограниченной растворимостью компонентов в жидком состоянии и взаимной нерастворимостью в твердом состоянии (без образования химических соединений).
Такие диаграммы называют диаграммами эвтектического типа.
Особенностью диаграммы эвтектического типа является то, что при кристаллизации смеси состава (3) происходит одновременное выпадение кристаллов А и В.
Эвтектика – это не твердый раствор, а микрогетерогенная смесь кристаллов.
Жидкость, которая находится в равновесии с двумя кристаллическими фазами одновременно, называется эвтектической жидкостью, ее состав – эвтектическим составом, температура, при которой существует такое равновесие, называется температурой эвтектики (эвтектической температурой).
Линия ТАЕТВ называется линией ликвидуса, она показывает зависимость температуры начала кристаллизации расплава от состава расплава.
Линия CED называется линией солидуса, она показывает зависимость температуры конца кристаллизации расплава от его состава.
Выше линии ликвидуса система находится в жидком состоянии, а ниже линии солидуса – в твердом состоянии.
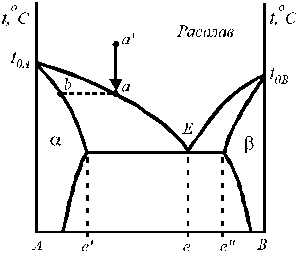 |
Рис. 2. Диаграмма состояния системы с ограниченной растворимостью в твердой фазе.
4. Системы, образующие устойчивые химические соединения, плавящиеся конгруэнтно.
На рисунке изображена типичная диаграмма плавкости системы, состоящей из компонентов А и В, образующих устойчивое химическое соединение АmBn, не способное образовывать твердый раствор с этими компонентами.
Точки плавления химических соединений, в которых состав твёрдой фазы одинаков с составом расплава, называются конгруэнтными (совпадающими).
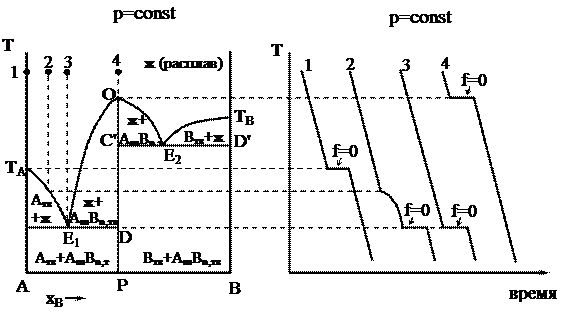 |
Эту диаграмму можно рассматривать как сочетание двух диаграмм плавкости систем с одной эвтектикой (т.е. системы A-AmBn и AmBn-B), рассмотренных нами ранее. Фигуративная точка О характеризует температуру плавления (кристаллизации) химического соединения АmBn.
В точке О – состав однокомпонентный; k = 1.
fО = 1 – 2 + 1 = 0 – система нонвариантная.
Если химическое соединение при температуре плавления частично диссоциирует по схеме: АmBn 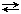
6. Диаграмма состояния бинарных систем с образованием химического соединения с инконгруэнтной точкой плавления.
Во многих случаях химическое соединение распадается до того, как будет достигнута его точка плавления.
Плавление соединения, в ходе которого состав кристаллической фазы не совпадает с составом расплава, называется инконгруэнтным.
На рисунке приведена диаграмма плавкости для системы, в которой оба компонента (А и В) образуют одно химическое соединение АmBn, плавящееся инконгруэнтно.
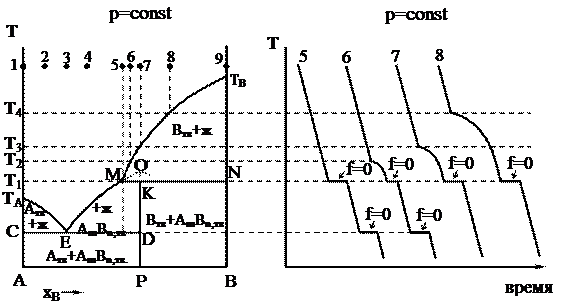 |
Точка М называется переходной или перитектической точкой.
В процессе распада химического соединения расплав находится в равновесии с двумя твердыми фазами: кристаллами химического соединения АmBn и кристаллами компонента В, поэтому система – нонвариантная, так как f = 2 – 3 + 1 = 0.
Области диаграммы плавкости и равновесные фазы системы указаны на рисунке. Процессы охлаждения смесей составов 1–4, 9 не отличаются от рассмотренных ранее.
После исчезновения всех кристаллов компонента В система становится двухфазной (f = 2 – 2 + 1 = 1), следовательно, температура начнет падать (независимый параметр), и состав расплава при дальнейшей кристаллизации соединения АmBn будет изменяться по кривой МЕ (зависимый параметр). При эвтектической температуре ТЕ будет кристаллизоваться эвтектика, состоящая из кристаллов АmBn и чистого твердого компонента А (f = 0). Таким образом, в перитектической точке, как и в эвтектической, в равновесии находятся раствор и две твердые фазы. Однако процессы охлаждения этих трехфазных систем существенно различаются между собой: в эвтектической точке одновременно выпадают две твердые фазы, а в перитектической точке – одна твердая фаза выпадает, а другая – растворяется.
Кремнеземистые огнеупоры
Это главным образом динасовые и кварцевые (из плавленого кварца) огнеупоры. Для нас практический интерес представляют динасовые изделия. Их основу составляет кремнезем, содержание которого в зависимости от назначения и сорта изделия колеблется в пределах 93 98 %.
Кремнезем существует в виде трех основных модификаций: кварц, тридимит, кристобалит. Всего же насчитывается более 15 модификаций, большинство из которых метастабильны. Названные устойчивые модификации тоже имеют метастабильные фазы в виде 






При переходе из одной модификации в другую происходит значительное изменение объема, что необходимо учитывать при разработке технологии производства и условий эксплуатации огнеупора.
Схематически переход можно представить так
По горизонтали отложены стабильные модификации, по вертикали – нестабильные и температуры превращения одной модификации в другую, указаны также изменения объема при превращениях.
Горизонтальные превращения протекают медленно и практически необратимо, превращения в пределах одной модификации (вертикальные) протекают сравнительно легко и являются обратимыми. Как видно, примерно при 600 o С протекают все превращения в метастабильных фазах.
Кремнезем широко распространен в природе (примерно 60 % земной коры состоит из SiO2), однако значительные его части находятся в соединении с другими оксидами, образуя минералы с низкой огнеупорностью. В наиболее чистом виде кремнезем встречается в природе в виде кварца (горного хрусталя). Кварц трудно использовать для изготовления огнеупоров, т.к. он встречается в небольших количествах и для его превращения в более устойчивые модификации (кристобалит и тридимит) требуются высокие температуры. Породы, используемые для изготовления динаса тоже состоят из кварца (т.н. кварциты; укр. – овруч). Но в них он находится в виде мелких кристаллов, сцементированных тонкодисперсным кремнеземом. Это так называемые кварциты. Для изготовления динаса используется также песок с высоким содержанием SiO2, некоторые минералы, например, маршалит и др.
Анализ диаграмм состояния SiO2 – CaO, SiO2 – FeO, (рис. 4.1) показывает, что CaO и FeO в определенных количествах незначительно влияют на температуру плавления SiO2: замена до 30 % SiO2 на CaO и до 40 % SiO2 на FeO незначительно понижают температуру плавления смеси, т.к. в системах при высоких температурах образуется жидкость и твердые кристобалит или тридимит.
Эти диаграммы имеют вид:
Рисунок 4.1 – Диаграмма состояния SiO2 – CaO
Присутствие же в системе небольших количеств других оксидов, особенно Al2O3, ведет к резкому снижению температуры ликвидус (рис. 4.2). Взаимодействие SiO2 и Al2O3 имеет большое практическое значение, т.к. Al2O3 является одной из примесей в кремнеземистом сырье. Наиболее низкая температура плавления в этой системе (1545 o С) – это температура плавления эвтектики, содержащей 5 % Al2O3.
Анализ диаграмм состояния важен не только с точки зрения влияния различных добавок на температуру плавления SiO2. Дело в том, что эти добавки существенно ускоряют полиморфные превращения кварц – тридимит и кварц – кристобалит, в результате которых образуются модификации, имеющие наибольшее значение для качества огнеупоров. Добавки этих веществ, так называемых минерализаторов, позволяют значительно сократить длительность обжига изделий или производить его при более низкой температуре.
Для изготовления динасов применяют кварциты и пески, которые для удаления глинистых фракций промывают водой. Составляют шихту требуемого химсостава, куда входит и бой динаса, и подвергают ее помолу и рассеву. В этом материале не должно быть более 1 % Al2O3 и 0,3 % (Na2O + K2O). После помола и рассева готовят смесь с зерновым составом 45 % крупной фракции (не более 3 мм), 10 % средней и 45 % мелкой (0,09-0,50 мм) фракции.
В эту смесь добавляют пластификатор (гашеную известь) в количестве не более 3,5 % CaO, минерализаторы (оксиды щелочно-земельных металлов и закись железа – по 1,5 %) и ССБ. Все это перемешивают и полученную массу направляют на формование на гидравлических прессах.
ССБ играет роль клеящей добавки, обеспечивающей сырцу необходимую прочность.
Прессование ведут по полусухой технологии (влажность шихты 3-7 %) под давлением до 100 МПа.
Полученные заготовки медленно сушат при температуре не более 150-180 o С в течение 8-10 часов.
Обжиг изделий ведут по сложному режиму с предварительным подогревом. В процессе обжига происходит расширение сырца в результате полиморфных превращений, образование силикатов, тридимита и кристобалита.
Обжиг производится по сложному температурному режиму, учитывающему полиморфные превращения и предусматривающему соответствующие температурные остановки:
В зависимости от длительности обжига изменяется соотношение основных составляющих изделия – кварца, тридимита и кристобалита: уменьшается количество кварца и кристобалита, возрастает тридимитная составляющая. Это может быть продемонстрировано такой диаграммой (рис. 4.3)
Рисунок 4.3 – Изменение соотношение фаз кремнезема в зависимости от количества обжигов динаса: 1 – тридимит; 2 – кристобалит; 3 – кварц; 4 – стекло
С увеличением количества обжигов увеличивается доля тридимитной составляющей и качество динаса, т.к. эта составляющая обладает наименьшим коэффициентом объемного расширения и высокой прочностью при высоких температурах. Из-за медленного нарастания количества жидкой фазы и наличия сростка кристобалита температура разрушения под нагрузкой незначительно отличается от температуры плавления тридимита – 1670 o С.
Термостойкость динаса плохая и не превышает 1 2 водняных теплосмен вследствие кристобалитного эффекта ( 





Динас является материалом кислым, поэтому он хорошо противостоит кислым шлакам. Оксиды железа и кальция интенсивно разрушают динасовый огнеупор, повышение плотности динаса способствует возрастанию его шлакоустойчивости.
Динас используется в воздухонагревателях доменных печей, при кладке кислых мартеновских и электросталеплавильных печей, в элементах нижнего строения основных мартеновских печей, при сооружении коксовых батарей и стекловаренных печей.
В цветной металлургии его используют для сводов руднотермических, отражательных и дуговых печей при производстве меди, никеля и цинка.