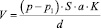диффузия со2 через альвеолярно капиллярную мембрану в раз чем о2
Диффузия со2 через альвеолярно капиллярную мембрану в раз чем о2
2.1. Дыхательные функции легких. Альвеолярное дыхание
Легкие играют важную роль не только в регуляции и обеспечении внешнего дыхания, но выполняют и ряд недыхательных функций. Недыхательные функции легких включают их участие в голосообразовании, регуляции теплоотдачи и кислотно-основного состояния организма, иммунных реакциях, в обеспечении тканевого фагоцитоза, регуляции метаболизма биологически активных прессорных и депрессорных субстанций, прокоагулянтных и антикоагулянтных факторов свертывания крови. В легких инактивируются пептиды, цикличесские нуклеотиды, простагландины, ксенобиотики, а также гистамин, серотонин.
Дыхательная функция легких определяется их участием в обеспечении альвеолярного дыхания, а также в регуляции внешнего дыхания за счет наличия мощных рефлексогенных зон.
Состояние легочной вентиляции определяется глубиной дыхания (дыхательным объемом) и частотой дыхательных движений.
Различают следующие объемы дыхания:
Дыхательный объем – объем вдоха и выдоха при спокойном дыхании.
Резервный объем вдоха и выдоха – количество воздуха, которое человек может дополнительно вдохнуть или выдохнуть при нормальном дыхании.
Остаточный объем – количество воздуха, оставшегося в легких, после максимального выдоха.
Жизненная емкость легких (ЖЁЛ) – наибольшее количество воздуха, которое можно максимально выдохнуть после максимального вдоха (сумма дыхательного объема и резервных объемов вдоха и выдоха)
Функциональная остаточная емкость – количество воздуха, оставшееся в легких после спокойного выдоха.
Жизненную ёмкость легких можно вычислить по формуле ЖЁЛ (л)= 2,5*рост (в м).
ЖЁЛ зависит от роста, возраста человека, рода занятий, особенно велико у пловцов и гребцов (до 8 л).
Легкие плода и новорожденных, не совершивших первый вдох, не содержат воздуха.
Различают анатомическое и функциональное мертвое пространство.
Анатомическое мертвое пространство – это объем невентилируемых воздухоносных путей – трахеи, бронхов и бронхиол.
Функциональное мертвое пространство – более емкое понятие, оно включает не только анатомическое мертвое пространство, а также вентилируемые, но неперфузируемые альвеолы.
Минутный объем дыхания равен произведению дыхательного объема на частоту дыхательных движений. Частота дыхательных движений у детей различна: у новорожденных составляет 40-50 в мин, у грудных детей 30-40 в мин, в детском возрасте 20-30 в мин. У взрослого человека частота дыхательных движений составляет 14 – 18 в мин.
Следует отметить, что диффузионное давление для О2 составляет около 60 мм. рт.ст, а для СО2 около 6 мм.рт.ст. Однако, необходимо учесть, что СО2 значительно быстрее диффундирует через альвеолярно–капиллярную мембрану в связи с тем, что коэффициент его растворимости в биологической среде в 20 раз больше, чем у кислорода.
В легких взрослого человека содержится около 300 млн. альвеол, диаметр которых составляет около 0,2 мм. Две соседние альвеолы отделены друг от друга двумя слоями эндотелия и эпителия, расположенными на базальной мембране. Между этими слоями находится интерстициальное пространство. Альвеолярный эпителий и эндотелий капилляров образуют альвеолярно – капиллярную мембрану, через которую происходит диффузия газов; толщина мембраны составляет от 0,2 мкм до 2 мкм в местах скопления эластических и коллагеновых волокон. Площадь газообмена в легких находится в зависимости от возраста и колеблется от 40 до 140 м 2 (рис.4).
Рис.4. Схема строения альвеолярного дерева
Альвеолярно–капиллярная диффузия во многом зависит от эластичности легочной ткани, обеспечивается в значительной мере продукцией сурфактанта.
Различают два типа эпителия, выстилающего альвеолярные клетки. Клетки I типа – это плоский эпителий, занимает до 95 % площади альвеолярной поверхности, содержит небольшое количество органоидов. Клетки IIтипа крупные, имеют округлую форму, ядра и микроворсинки, синтезируют сурфактант.
Сурфактант легких – это смесь поверхностно-активных веществ (ПАВ), состоящая на 70 – 80% из фосфатидилхолина, фосфатидилглицерола, дипальмитолфосфатидилхолина и белков сурфактанта, продуцируемых альвеолоцитами II типа. Молекулы апопротеинов, фосфолипидов имеют гидрофильный и гидрофобные концы, обращенные соответственно в альвеолярную жидкость и альвеолярный воздух. Белки сурфактанта (SPA, SP-R, SP-C,SP-D) не только способствуют снижению поверхностного натяжения альвеол, обеспечиваемому фосфолипидами, но и обладают защитной функцией.
Система легочного сурфактанта играет многоплановую роль, обеспечивая антиателэктатическую функцию, способствует диффузии О2, участвует в регуляции водного обмена в легких, защищает организм от проникновения вредоносных мелкодисперсных аэрозолей, обладает свойствами антиоксиданта.
Сурфактант, как указывалось выше, уменьшает поверхностное натяжение альвеол в 2 – 10 раз, тем самым, предотвращая спадение альвеол. Сурфактант содержится не только на внутренней поверхности альвеол, но и на плевре, брюшине, перикарде, синовиальных оболочках, слизистой глазных яблок. Сурфактант обеспечивает раскрытое состояние мелких дыхательных путей, усиливает фагоцитирующую активность макрофагов, подавляет выделение медиаторов воспаления, обладает свойствами антиоксиданта, оказывает антибактериальное и противовирусное действие.
При дефиците сурфактанта некоторые альвеолы подвергаются ателектазу, другие – перерастягиваются, вентиляция легких становится негомогенной, нарушается вентиляционно – перфузионное отношение.
При спадении альвеолы концентрация сурфактанта на ее поверхности возрастает, возникает снижение поверхностного натяжения, что повышает их стабильность и препятствует дальнейшему спадению альвеол. Стабильность альвеол обеспечивается и так называемым феноменом «взаимозависимости» альвеол, т.е. их взаимной тяги. У недоношенных новорожденных недостаточность синтеза сурфактанта может быть причиной развития респираторного дистресс – синдрома, характеризующегося ригидными легкими.
Как известно, легкие в отличие от трахеи и бронхов являются мощной рефлексогенной зоной, обеспечивающей регуляцию внешнего дыхания в условиях нормы и патологии.
В паренхиме легких имеются различные высоко- и низкочувствительные рецепторы растяжения альвеол, медленно-адаптирующиеся и быстро-адаптирующиеся к структурным изменениям в легких. Медленно-адаптирующиеся рецепторы растяжения альвеол являются высокочувствительными, низкопороговыми механорецепторами, реагирующими на объем вдыхаемого воздуха. Эти рецепторы являются окончанием толстых миелинизированных волокон n.vagus. Афферентация с этих рецепторов при участии ретикулярной формации ствола мозга переключается на инспираторные нейроны дорзальной дыхательной группы продолговатого мозга, обеспечивая развитие рефлекса Геринга-Брейера. Рефлекс Геринга-Брейера участвует во время сна в смене фаз дыхательного цикла. В условиях патологии при участии этого рефлекса формируются испираторная, экспираторная и смешанная одышки.
Другой группой рецепторов паренхимы легких являются быстроадаптирующиеся рецепторы спадения альвеол и юкстакапилярные рецепторы, реагирующие соответственно на спадение альвеол и возрастание уровня тканевой жидкости. Импульсация с этих рецепторов проводится по мало– и немиелинизированным волокнам n.vagus в продолговатый мозг, вызывая развитие тахипное.
При раздражении С-волокон возникают брадикардия, тахи- и апное, гипер- и диссекреция слизи в воздухоносных путях.
2.2. Кровоснабжение и лимфоснабжение легких
Легкие получают кровь от системы легочных сосудов (малый круг кровообращения) и бронхиальных сосудов (большой круг кровообращения). Основной функцией малого круга кровообращения является оксигенация венозной крови и удаление из нее СО2.
Среднее время прохождения крови через малый круг составляет в среднем 4,5 – 5,0 сек.
В состоянии покоя в сосудах легких находится около 500 мл крови (10 % от общего объема). В условиях нагрузки объем крови в легких может возрастать в 5–6 раз, при этом происходит лишь незначительное увеличение давления в сосудах малого круга кровообращения за счет высокой растяжимости. Давление в артериолах легких составляет в среднем 9 – 15 мм. рт. ст.
В покое кровоток в легких неоднороден, большая часть его направлена в нижние зоны.
Система бронхиальных сосудов снабжает кровью дыхательные пути вплоть до терминальных бронхиол, составляя около 3% от величины легочного кровотока.
Гидродинамические параметры бронхиальных сосудов обеспечивают транспорт воды в интерстиций и последующее лимфообразование. В легких осуществляются анастомозы между сосудами большого и малого круга кровообращения.
Суммарно в легких отношение легочной вентиляции и легочной перфузии составляет примерно 0,8 – 1,0. При вертикальном положении человека снижается интенсивность кровотока у верхушек легких.
Лимфатические сосуды расположены в паренхиме легких и на поверхности висцеральной плевры, впадают в лимфатические узлы, расположенные вокруг крупных воздухоносных путей (ВП) и в средостении. Лимфоидная ткань находится в стенках воздухоносных путей. Терминальные мешки лимфатической системы расположены в субплевральной, перибронхиальной соединительной ткани, а затем поступают в собирательные лимфатические сосуды легких.
Регуляция легочного кровотока обеспечивается за счет влияния вегетативной нервной системы, а также ряда гуморальных факторов; в частности вазодилатирующих простагландина J2 – метаболита арахидоновой кислоты, оксида азота и вазоконстрикторных соединений: эндотелинов, тромбоксана.
Эндотелины продуцируются эндотелиальными клетками легочных сосудов и клетками бронхиального эпителия и вызывают вазоконстрикцию, являются медиаторами легочной гипоксической вазоконстрикции, вызывают сокращения гладкой мускулатуры воздухоносных путей.
Механизмы гипоксии
Noreen R. Henig, David J. Pierson
Статья опубликована в журнале
Respiratory Care Clinics of North America
Volume 6, Number 4, December 2000
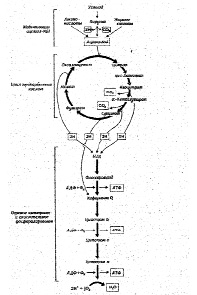
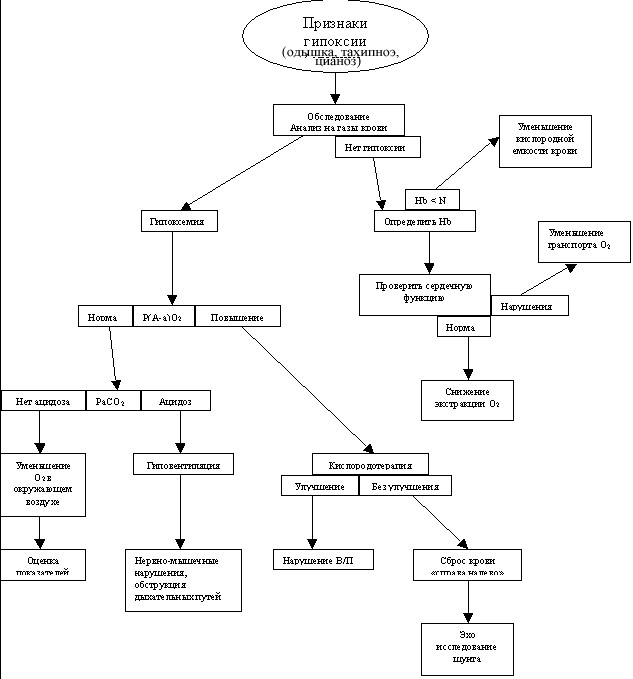
Четырьмя основными механизмами гипоксемии, которые необходимо запомнить каждому студенту медику являются низкий уровень кислорода, гиповентиляция, нарушение соотношения перфузии–вентиляции, сброс крови «справа налево». Если запомнить этот список и понять сами механизмы, то каждый может быстро и легко выявить причину гипоксии у пациента.
Человеческий организм является аэробным. Это значит, что все процессы клеточного метаболизма зависят от уровня молекул кислорода, которые поддерживают основные функции организма. Несмотря на то, что организму необходим кислород, клинически определить субоптимальные потребности очень тяжело и невозможно подсчитать. У пациентов с недостаточной оксигенацией могут наблюдаться цианоз, одышка, сердцебиение, потеря сознания, парестезии, усиление диуреза, гипотермия или боль. pH крови может быть понижен, а уровень лактата повышен в результате анаэробного метаболизма. Все или ни одного из этих признаков могут присутствовать, однако это дело лечащего врача подозревать гипоксию и выявлять ее причину.
В этой статье авторы обсуждают определение гипоксемии, обозревают анатомию легочной системы и этапы доставки кислорода и описывают четыре основные причины гипоксемии с примерами из практики. В заключении будет описан пятый механизм гипоксии, который у человека встречается очень редко. Вследствие того, что поместить кислород в кровоток человека это еще только полдела, авторы описали еще и механизм гипоксии тканей при адекватном обмене кислорода в легких.
Гипоксемия против гипоксии
Гипоксемия – это состояние, при котором парциальное давление кислорода в артериальной крови (РаО2) меньше нормального (менее 60 мм рт. ст.). Если пациент, дышит кислородом, но РаО2 у него ниже, чем ожидается, то необходимо исключить гипоксемию, даже если уровень РаО2 выше 60 мм рт. ст. Гипоксемия возникает вследствие непопадания кислорода в кровь. Гипоксия тканей возникает вследствие того, что клеткам не хватает кислорода для выполнения функции метаболизма. Хотя гипоксемия (слишком маленькое поступление кислорода в кровь) обычно является причиной гипоксии тканей, существуют другие состояния, которые прерывают поступление кислорода в кровь и приводят к гипоксии.
Для того чтобы понять обстоятельства, которые приводят к гипоксемии или гипоксии, необходимо представить путь, который проходят молекулы кислорода из воздуха в ткани, где они используются как топливо для клеток. Во время спонтанного дыхания мозг генерирует сигнал, который ведет к сокращению диафрагмы и расширению грудной клетки. При этом создается отрицательное давление в грудной полости, вследствие чего воздух проникает по дыхательным путям в альвеолы. Молекулы кислорода диффундируют через стенку альвеол в капилляры. В крови большинство кислорода переносится гемоглобином в эритроцитах, в то время как небольшой процент растворяется в плазме. Кровь перекачивается через легкие из правого желудочка сердца и после этого возвращается в левое предсердие и желудочек для того, чтобы оттуда разойтись по телу. По ходу того, как артерии разделяются на более мелкие капилляры, кислород освобождается из гемоглобина и поступает в ткани для питания клеток. Углекислый газ, который является продуктом клеточного метаболизма, диффундирует из тканей в капилляры и проходит по венозной системе в правое сердце. Кровь, насыщенная углекислым газом, проходит в легкие. Таким образом, углекислый газ может диффундировать через альвеолярно–капиллярный барьер, чтобы выйти из организма во время выдоха.
 |
| Рисунок 1. |
Таблица 1. Механизмы гипоксии
Гипоксемия с нормальным Р(А-а)О2
Гипоксемия с увеличением Р(А-а)О2
Гипоксия тканей без гипоксемии
Механизмы гипоксемии
Уменьшение кислорода в окружающем воздухе
Неадекватный транспорт кислорода
Если кислород попал в кровь и связался с гемоглобином, то доставка кислорода к тканям начинает зависеть от сердечного выброса. Отношение сердечного выброса (Qt) и транспорта кислорода (DO2) показано в таблице 2. Уменьшение сердечного выброса может привести к внутренней сердечной дисфункции или внешним сердечным нарушениям. В результате уменьшения или нарушения сердечного выброса развивается гипоксия тканей.
Внутренняя сердечная дисфункция
Первичные заболевания сердца зачастую возникают вследствие патологии коронарных сосудов и ишемической кардиомиопатии. Однако гипертензия, патология клапанов сердца, нарушения ритма и кардиомиопатии неишемической этиологии (алкоголь, вирус) также играют большую роль в дисфункции сердца. У пациентов с признаками гипоксии, при нормальном анализе крови на содержание кислорода, сердечная дисфункция является наиболее частой причиной данного состояния. Хотя при сердечной дисфункции чаще всего пациента госпитализируют, скрытые заболевания сердца часто обостряют основную причину заболевания. Сепсис может ухудшить тканевую гипоксию, связанную с гипотонией. Пациентам необходимо выполнить эхокардиографию, коронарную ангиографию, провести функциональные исследования, такие как стресс тест при подозрении на первичную патологию сердца.
Внешние сердечные нарушения
Неадекватная периферическая экстракция кислорода
Даже если кислород полностью связался с гемоглобином и был доставлен к тканям, то существует два обстоятельства, при которых нарушается утилизация кислорода клетками. Первым является тот факт, что кислород может быть сильно связан с гемоглобином, что препятствует переходу в ткани. Вторым является обстоятельство, при котором происходит интоксикация митохондрий, с помощью которых в клетке происходят процессы метаболизма.
Сродство гемоглобина к кислороду
Сродство гемоглобина к кислороду определяется по форме и позиции кривой диссоциации оксигемоглобина (рис. 6).
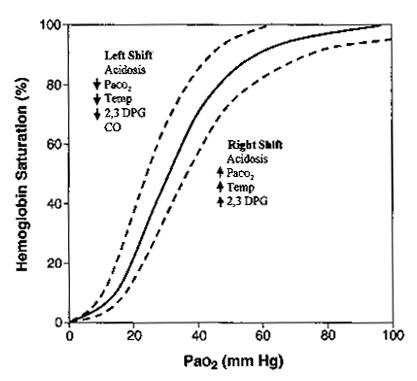 |
| Рисунок 6. Кривая диссоциации гемоглобина. Данная кривая показывает взаимоотношение РаО2 (по горизонтальной оси) с сатурацией гемоглобина (вертикальная ось). Существуют несколько факторов, которые влияют на способность гемоглобина связываться с кислородом. Кривая будет смещаться вправо, указывая на уменьшение связывания кислорода в легких или облегчение отдачи кислорода тканям. Данная картина встречается при ацидозе, гиперкапнии, гипертермии, повышения 2,3-дифосфоглицерата (2,3-ДФГ). Кривая будет отклоняться влево, увеличивая насыщение кислорода в легких и уменьшая отдачу кислорода тканям. Это встречается при алкалозе, гипокапнии, гипотермии, уменьшении 2,3-ДФГ, отравлении угарным газом. |
Когда кривая смещается вправо, сродство снижается и кислорода на грамм гемоглобина становится меньше, хотя на периферии кислород отсоединяется более легко. Когда кривая смещается влево и кверху сродство к кислороду увеличивается. Больше кислорода захватывается в легких где показатель РаО2 высокий, но на уровне тканей, где РаО2 низкий количество доступного кислорода снижается. Алкалоз, гипотермия, гипокапния, уменьшение 2,3-ДФГ приводят к сдвигу кривой влево. При переливании цельной крови происходит уменьшение 2,3-ДФГ, тем самым выражается вредное действие массивных гемотрансфузий. Так как 2,3-ДФГ вырабатывается эритроцитами, эффект обычно кратковременный. Угарный газ не сдвигает кривую влево, но занимает гемоглобиновые мостики и тем самым приводит к гипоксии.
Интоксикация митохондрий
Заключение
Существует большое количество заболеваний, которые могут закончиться гипоксемией. Гипоксемия возникает вследствие одного из этих факторов: снижение кислорода в окружающем воздухе, гиповентиляции, нарушения В/П, сброса крови «справа налево». При обследовании пациента необходимо установить действительно ли у него есть гипоксемия и если это так то необходимо определить Р(А-а)О2. Таким образом, определив газовый состав крови можно провести дифференциальный диагноз и правильно оценить ситуацию. Важно также запомнить, что при подключении более одного механизма необходимо снова и снова оценивать состояние пациента.
Диффузия со2 через альвеолярно капиллярную мембрану в раз чем о2
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит – безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) – основной гемоглобин взрослых содержит 2 – альфа и 2 – бета – цепи, Hb A2 – содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 – в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови – 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной – около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов – температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении – снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 – ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
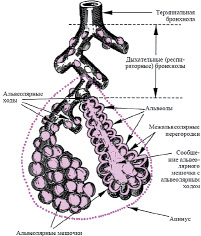
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 – конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов – кислороду.
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность – кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода