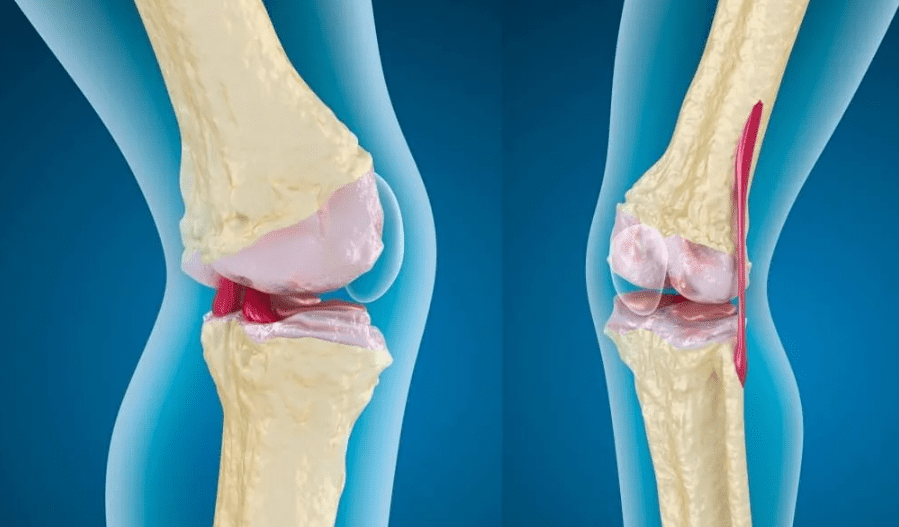
деструкция хряща что это такое
Остеоартроз
Остеоартроз – это хроническое дегенеративное заболевание суставов, при котором происходит постепенное разрушение хрящевой ткани с последующим вовлечением в патологический процесс костей и околосуставных структур. Без лечения патология приводит к полной потере подвижности.
Общая информация
Остеоартроз начинается с микроповреждений хряща на фоне повышенной нагрузки или уменьшенной способности к регенерации. В результате ткань истончается и становится более плотной и менее гладкой. Движение костей друг относительно друга затрудняется, а отдельные участки суставных поверхностей начинают испытывать постоянные перегрузки.
Процесс сопровождается изменением свойств синовиальной жидкости, которая становится более густой. Внутри полости сустава появляются костные разрастания – остеофиты. По мере прогрессирования заболевания их становится все больше, расстояние между костями сокращается. Патологический процесс распространяется на окружающие ткани: связки, мышцы. В конечном итоге все элементы сустава срастаются между собой, а движение полностью блокируется.
Чаще всего заболевание классифицируют в зависимости от локализации патологического процесса. Остеоартроз может быть односторонним и двусторонним и деформировать практически любые суставы:
В зависимости от причины остеоартроз может быть первичным (возникает на самостоятельно) и вторичным (развивается на фоне другой патологии или травмы).
Причины
Развитие остеоартроза может быть спровоцировано любым заболеванием или состоянием, при котором усиливается нагрузка на сустав или ухудшаются процессы его регенерации. Чаще всего патология возникает на фоне:
Существенно повышает риск развития остеоартроза наследственность, а также возраст старше 45 лет.
Степени
Ортопеды выделяют 4 степени заболевания:
Симптомы
Основные признаки остеоартроза развиваются постепенно, усиливаясь по мере прогрессирования заболевания. Большинство больных отмечают:
Поражение крупных суставов значительно меняет образ жизни человека, поскольку он теряет способность к самостоятельному передвижению и самообслуживанию.
Диагностика
При появлении проблем с суставами необходимо обратиться за помощью к ортопеду-травматологу. В его задачи входит выявление симптомов остеоартроза, определение степени заболевания и подбор лечения.
Основным способом визуализации происходящих внутри сустава изменений остается рентгенография. Снимок позволяет увидеть размер суставной щели, количество и величину остеофитов, деформацию костей. При необходимости визуализировать мягкие ткани проводится УЗИ или МРТ. По показаниям проводится артроскопия: прокол суставной сумки с последующим введением в полость миниатюрной камеры, позволяющей увидеть сустав изнутри. Эта методика может быть дополнена введением лекарств.
Лабораторная диагностика носит вспомогательный характер. Общий анализ крови может показать активный воспалительный процесс, если к остеоартрозу присоединился артрит. В случае, если заболевание носит вторичный характер, назначаются анализы, обследования и консультации узких специалистов для диагностики исходной патологии.
Лечение остеоартроза
Лечение остеоартроза суставов требует времени и терпения. На ранней стадии врачи успешно останавливают патологический процесс с помощью медикаментов и физиотерапи, а вот в запущенных случаях справиться с болезнью можно только хирургическим путем. Все методы лечения делятся на:
Медикаментозное лечение направлено на снижение болевого синдрома и восстановление хрящевой ткани. Боль при остеоартрозе значительно снижает качество жизни пациента, мешая свободно двигаться, вот почему анальгетики и противовоспалительные средства занимают первое место в списке назначений. В зависимости от клинической ситуации назначаются препараты из следующих групп:
Препараты этих групп выпускаются в виде мазей для местного применения, таблеток и капсул, свечей или растворов для инъекций. Некоторые вводятся непосредственно в полость сустава, действуя при этом максимально эффективно. Дозу, длительность и кратность приема подбирает только врач, поскольку длительное использование может ускорить разрушение суставов.
Вторая группа средств направлена на восстановление или замедление разрушения хряща. Споры об эффективности хондропротекторов до сих пор не закончены, но на данный момент их назначение обязательно. Препараты на основе хондроитина, глюкозамина или их комбинации используются длительными курсами по 3-6 месяцев.
Дополнительно к базовой терапии врач может назначить средства для улучшения кровообращения и антиферментные препараты. Хороший эффект оказывают разогревающие мази.
Усилить действие препаратов помогают немедикаментозные методы лечения. Они направлены на улучшение микроциркуляции в пораженной области, стимуляцию мышц и снижение нагрузки на сустав. Для этой цели используются:
Помощь хирургов необходима на последних стадиях заболевания, когда препараты уже не могут ни остановить, ни замедлить патологический процесс. Наиболее эффективным методом на данный момент является эндопротезирование. Пострадавший сустав удаляется и замещается современным протезом, способным функционировать десятилетиями. Эта методика особенно часто используется для восстановления коленных и тазобедренных сочленений.
В некоторых случаях проводятся операции для облегчения состояния пациента:
Профилактика
Как и большинство заболеваний, остеоартроз намного проще предупредить, чем вылечить. Простые правила помогут сохранить здоровье суставов и остановить процесс на ранней стадии, если он уже возник:
Диета
Правильное питание – не главный фактор профилактики остеоартроза, но и оно внесет свою лепту в поддержание здоровья суставов. Рекомендуется:
Коллаген и омега-3 кислоты хорошо влияют на состояние хряща, вот почему холодцы и морская рыба и оливковое масло должны всегда присутствовать в рационе.
Последствия и осложнения
Без своевременного лечения остеоартроз способен стать причиной инвалидности, особенно при двустороннем поражении.
Он становится причиной:
При поражении крупных суставов ног у человека настолько меняется походка и осанка, что это неизбежно приводит к проблемам с позвоночником, болям в шее и пояснице.
Лечение в клинике «Энергия здоровья»
Если Вы стали отмечать подозрительный хруст в суставах, не стоит спешно искать в интернете, как лечить остеоартроз народными средствами. Лучше обратиться за помощью к профессионалам из клиники «Энергия здоровья». Мы используем современные средства восстановления хрящевой ткани и предлагаем каждому пациенту:
Преимущества клиники
Приходите к нам, если Вам необходимы:
Остеоартроз – это заболевание, которое начинается исподволь, развивается медленно, но в конечном итоге нередко приводит к инвалидности. Не дайте ему изменить Вашу жизнь, запишитесь на консультацию к ортопедам «Энергии здоровья».
Деформирующий остеоартроз: можно ли остановить разрушение хряща?
Деформирующий остеоартроз – одна из самых распространенных патологий суставов. Около 80 % всех заболеваний ревматического характера приходятся именно на эту болезнь, в основе которой – повреждения хряща. Как правило, заболевание развивается от того, что суставный хрящ подвергается чрезмерной нагрузке и перестает справляться с ней. Почему так происходит и можно ли противостоять этому процессу?
Хрящ – субстанция хрупкая: его нужно беречь
Наиболее частые повреждения хряща
Чаще всего пациенты нуждаются в лечении артроза, остеоартроза и его деформирующей формы после таких травм:
По той или иной причине в организме стремительно снижается количество протеогликанов, повреждаются коллагеновые волокна гиалинового хряща. Это приводит к гибели хондроцитов – хрящ постепенно истончается.
Деформирующий остеоартроз суставов рук – профессиональная болезнь грузчиков и такелажников
Другие причины разрушения хряща
В ряде случаев к недостатку синовиальной жидкости и как следствие трению хрящей приводят другие причины, вызванные патологиями других систем организма.
Как правило, хрящ деформируется под действием сразу нескольких факторов, которые угнетают метаболизм в хондроцитах и замедляют выработку коллагена. Традиционно считается, что причиной артроза являются спортивные травмы, однако на самом деле первоисточником проблемы может быть совершенно другой фактор, не имеющий, на первый взгляд, ничего общего с заболеваниями суставов.
Иногда причиной деформирующего остеоартроза становится повреждение «невидимой» синовиальной оболочки
Причина развития деформирующего артроза – вовсе не отложение солей, как часто считают. Причина – в истирании хряща, и только опытный медик может разобраться, из-за чего развился этот процесс:
Можно ли предупредить разрушения хряща?
В случае с деформирующим остеоартрозом профилактика возможна, только если речь идет о первичной форме заболевания. Если вам еще не назначали лечение артроза, вы можете уделить особое внимание нагрузке на суставы и предупредить возможную проблему. Если по роду службы или в рамках хобби вы регулярно подвергаете суставы микротравматизации, еще не поздно прекратить это и защитить таким образом хрящ от повреждений.
Предупредить развитие так называемого симптоматического остеоартроза, вызванного неполноценностью хряща из-за аномалий других органов, практически невозможно. Если причиной разрушения хрящевой ткани стали врожденные заболевания, нарушение метаболизма, патологические состояния эндокринной системы или периферических нервов, все, что остается, облегчать симптоматику деформирующего остеоартроза, обращаясь к современным терапевтическим методам.
В большинстве случаев справиться с болью и вернуть суставу подвижность позволяют внутрисуставные инъекции «Нолтрекс». Препарат восстанавливает вязкость синовиальной жидкости, прекращает трение хрящей и избавляет от болевых ощущений, чем бы они ни были вызваны – регулярными чрезмерными нагрузками на колено, генетической предрасположенностью или неблагоприятной экологией.
Лечение хряща коленного сустава
Автор статьи
Внутри коленного сустава есть хрящи. Они покрывают суставные поверхности костей: бедренной и большеберцовой. Хрящи смягчают трение. Они обеспечивают сохранность внутрисуставных структур даже на фоне интенсивных физических нагрузок. К сожалению, в силу различных заболеваний возможно истончение или механическое повреждение хрящей. В этом случае пациенту требуется лечение.
Лечение хряща коленного сустава
Принципы лечения
Подходы к лечению зависят от того, по какой именно причине истончился хрящ. Это может произойти в результате:
Лечение может быть направлено на устранение симптомов, замедление дегенеративных процессов, купирование воспаления, усиление регенераторных способностей хрящевой ткани. Иногда требуется хирургическое вмешательство. Оно позволяет выполнить замещение дефектов хрящевой поверхности.
Консервативные методы
Если гиалиновый хрящ коленного сустава истончен, лечение начинают консервативными методами. Применяются такие способы терапевтического воздействия:
Коррекция образа жизни
Изначально необходимо устранить все факторы, которые могут провоцировать истончение хряща коленного сустава. Лечение начинают с того, что пациенту рекомендуют отказаться от тяжелой физической работы, спорта. Потому что при продолжающемся механическом раздражении хряща он будет повреждаться, а полноценное восстановление хрящевой ткани невозможно по причине его слабого кровоснабжения.
Физиотерапия
Физиотерапевтическое лечение применяется с целью уменьшения отека, боли. Оно позволяет улучшить кровообращение в той зоне тела, которая находится в непосредственной близости к поврежденным коленным хрящам. В результате улучшается трофика тканей, уменьшаются явления гипоксии, ускоряются регенераторные процессы.
Применяются такие виды физиолечения:
Физиотерапия часто сочетается с медикаментозным лечением. Местные препараты наносятся на кожу. Затем проводится электрофорез или фонофорез для их лучшего проникновения внутрь суставной полости.
Физиотерапия
Лечебная физкультура
Физические тренировки помогают укрепить мышцы, разгрузить коленный сустав. Они также способствуют восстановлению хряща за счет улучшения кровообращения. При нагрузке к мышце приливает кровь. Расширяются сосуды. Поэтому кровоснабжение суставной капсулы возрастает. Улучшается и кровенаполнение тех частей хряща, которые прилегают к капсуле.
Медикаментозная терапия
Применение препаратов остается одним из главных способов лечения. В данный момент не существует лекарственных средств, которые гарантированно восстанавливают хрящи или хотя бы предотвращают их дальнейшее разрушение. Однако ряд лекарственных средств позволяют добиться неплохих результатов за счет усиления регенераторных процессов, снижения воспаления, защиты хряща от сильных механических воздействий.
Препараты могут использоваться такими способами:
Так как в большинстве случаев происходит постепенное разрушение хряща коленного сустава, лечение проводится таблетированными формами препаратов. Они удобнее в использовании и не требуют постоянного участия медицинского персонала в лечебном процессе.
Часто применяются и внутрисуставные инъекции. Они хороши тем, что позволяют после нескольких введений лекарств получить устойчивый длительный результат. Он сохраняется полгода или год. Применение уколов в колено позволяет снизить потребность в медицинских препаратах, которые применяются перорально. Соответственно, уменьшается медикаментозная нагрузка и риск побочных эффектов.
Кремы и гели – это вспомогательное лечение. Оно исключительно симптоматическое. Используется для уменьшения боли, устранения отека. Нет местных препаратов, которые могли бы восстановить суставные хрящи колена или хотя бы замедлить их дегенерацию.
Медикаментозная терапия
Основные группы препаратов, которые применяются для лечения хрящей коленных суставов
НПВС. Эти препараты не могут восстановить хрящи. Но они способны в некоторых случаях замедлить их дегенерацию за счет устранения воспалительного процесса. Кроме того, нестероидные противовоспалительные средства принимаются с целью снижения болевого синдрома, который неизбежно развивается в случае истончения хрящей из-за сильного трения суставных поверхностей во время выполнения любых движений в коленном суставе.
Хондропротекторы. Это препараты хондроитина и глюкозамина. Их получают из хрящей животных. Хондропротекторы вводятся внутрь сустава, инъекционно внутримышечно, наносят на кожу или принимают внутрь.
Только последний способ применения имеет смысл с точки зрения доказательной медицины. Нанесение хондропротекторов на кожу в виде геля не имеет доказанной эффективности. Введение в сустав или внутримышечно приносит пользу, но лечение нужно длительное (от 6 месяцев), а при таком способе введения переносимость терапии значительно ухудшается.
Несмотря на то, что врачи очень часто назначают хондропротекторы внутрь в капсулах, нет доказательств, что они восстанавливают суставной хрящ. Исследования лишь показывают, что при артрозе коленного сустава длительное применение хондроитина в комбинации с глюкозамином позволяет уменьшить симптомы заболевания.
Гиалуронат. Вводится внутрь коленного сустава. Подобные препараты также выпускаются в лекарственных формах для наружного использования или для применения внутрь. Однако такие способы лечения не имеют убедительных доказательств эффективности. Поэтому гиалуронат в таблетках в основном продается как биологически-активные добавки, а не препараты.
Введение гиалуроновой кислоты внутрь сустава позволяет повысить её концентрацию в синовиальной жидкости. Уменьшается трение хрящей, предотвращается их дистрофия. Симптомы уменьшаются или уходят на несколько месяцев. После этого инъекцию гиалуроната можно выполнить повторно.
PRP. Этой аббревиатурой обозначают богатую тромбоцитами плазму. Её получают из собственной крови пациента, центрифугируют, а затем вводят в сустав. Это один из самых эффективных способов усиления регенерации хрящей. Тромбоциты выделяют большое количество факторов роста. В результате репарация хрящевой ткани усиливается. Но восстановление хрящей колена возможно только в случае ранней стадии артроза или при незначительном их травматическом повреждении.
Хирургические методы
При значительных дефектах суставной поверхности восстановление хрящевой ткани возможно только хирургическими методами. Для этого используется множество различных методов. Некоторые из них очень дорого стоят и доступны только за границей (Германия, Швейцария, США). Одни способы появились недавно, другие применяются уже более 50 лет.
Наибольшую эффективность хирургические методы восстановления хряща имеют при:
При других заболеваниях, а также в случае выраженного гонартроза полноценно восстановить хрящевые поверхности часто не удается.
Основные хирургические методы восстановления гиалинового хряща коленного сустава:
Субхондральная туннелизация. Врач просверливает в нескольких местах хрящ и субхондральную костную ткань. Открывается кровотечение. Результатом становится образование на месте искусственно нанесенной травмы волокнистого хряща.
Микрофрактурирование. Усовершенствованная методика, которая постепенно вытесняет туннелизацию. Механизм воздействия аналогичный. Формируются множественные микропереломы субхондральной кости с сохранением её каркаса. Методика более безопасна, потому что исключаются ожоговые повреждения хрящей, неизбежные при сверлении.
Аутотрансплантация хряща. Применяется для закрытия тех дефектов суставной поверхности, которые подвергаются максимальным механическим нагрузкам. Здесь хрящи имеют наибольшую толщину. Для аутотрансплантации берутся хрящи с другого участка тела пациента и подсаживаются в коленный сустав. Недостатками метода является дополнительная травматизация донорских участков и недостаток материала при обширных хрящевых дефектах.
Имплантация аутологичных хондроцитов. Берут маленький фрагмент хряща, затем культивируют. Фактически, для пациента выращивается новый хрящ. Его закрепляют на матрице, придавая нужную форму, и имплантируют в сустав. Метод максимально эффективен у пациентов до 55 лет, при дефекте хрящевой поверхности до 10 квадратных сантиметров. Недостатки: высокая стоимость и необходимость проведения двух операций (для забора хряща, а затем для его имплантации в колено).
При появлении признаков повреждения суставных хрящей человек должен обращаться к врачу как можно быстрее. Есть немало способов восстановления суставных поверхностей колена, однако большинство из них становятся малоэффективными в запущенных клинических случаях.
Остеоартроз: причины, симптомы, лечение
Остеоартроз: что это?
Боль в суставах – это одна из наиболее частых причин обращения к врачу, особенно среди пациентов в возрасте 50 лет и старше. Во многих случаях боль, тугоподвижность и деформация суставов вызваны дегенеративно-дистрофическими изменениями суставных тканей или остеоартрозом. Многие не связанные с медициной люди путают этот термин с артритом. Но это два совершенно разных заболевания.
Остеоартрозом называется невоспалительное заболевание, характеризующееся разрушением хрящевой ткани. Повреждение хряща приводит к болезненности, отеку и тугоподвижности суставов. Остеоартроз может поражать любые суставы, но чаще всего страдают локти, запястья, колени и бедренные суставы. Заболеванию больше подвержены люди старше 50 лет, чаще женщины. Болезнь начинается постепенно и со временем прогрессирует. Но есть способы, которые помогают предотвратить или минимизировать боль, а также сохранить мобильность.
Симптомы остеоартроза
Симптомы заболевания не проявляются внезапно, а носят прогрессирующий характер. К ним относятся:
Боль, снижение подвижности, побочные эффекты от лекарств и другие факторы, связанные с остеоартритом, могут привести к негативным последствиям для здоровья:
Причины появления остеоартроза
Как лечить остеоартроз?
Основная цель лечения – сохранение и, по возможности, улучшение функции суставов, а также облегчение симптомов. Многие пациенты не знают, какой врач лечит остеоартроз. Сначала нужно обратиться к своему семейному доктору. После первичной диагностики он или назначит лечение, или направит вас к специалисту узкого профиля – ортопеду, ревматологу, артрологу.
Полный текст:
Аннотация
В статье обсуждаются механизмы деструктивных процессов при ревматоидном артрите (РА). На овременном этапе в задачи лечения РА, помимо подавления воспаления, входит и предупреждение деструкции хряща и кости пораженных суставов. Прогнозирование деструктивных процессов при РА играет важную роль, так как необратимость функциональных изменений при РА напрямую коррелирует с выраженностью повреждения сустава. В статье обсуждаются механизмы разрушения суставного хряща и кости, значение различных биохимических маркеров для оценки степени повреждения и прогноза дальнейшего прогрессирования деструкции в мелких суставах кистей и стоп. При РА выделяют не только клинические (показатели активности), но и биологические (маркеры повреждения кости, хряща и синовиальной оболочки) предикторы повреждения суставов: СТХII – маркер деградации хряща (коллаген II типа) и CTXI – маркер деградации кости (коллаген I типа) и их динамика за 4–12 нед и более. Хотя появление эрозий считается основным признаком прогрессирования деструкции суставов при РА, показано, что в ранних стадиях болезни функциональная активность в большей степени зависит от счета сужения суставной щели (деградация хряща), чем от счета эрозий при оценке деструкции модифицированным методом Шарпа. В нескольких рандомизированных плацебоконтролируемых исследованиях (РКПИ) была оценена связь функциональной способности больных раздельно с сужением суставной щели и с числом эрозий. Было показано, что при РА деградация хряща играет большую роль в необратимой потере функции, чем деструкция кости.
Возможность подавления деградации хряща, показанная в РКПИ эффективности адалимумаба, коррелирует с лучшим функциональным исходом у больных РА. Сывороточные маркеры обмена хряща могут не только быть предикторами дальнейшего рентгенологического прогрессирования, но и использоваться для оценки эффективности терапии.
Ключевые слова
Об авторе
Литература
1. Welsing PM, van Gestel AM, Swinkels HL, et al. The relationship between disease activity, joint destruction, and functional capacity over the course of rheumatoid arthritis. Arthritis Rheum. 2001;44:2009–17. DOI: http://dx.doi.org/10.1002/1529-0131(200109)44:9 3.0.CO;2-L.
2. Drossaer-Bakker KW, de Buck M, van Zeben D, et al. Long-term course and outcome of functional capacity in rheumatoid arthritis: the effect of disease activity and radiologic damage over time. Arthritis Rheum. 1999;42:1854–60. DOI: http://dx.doi.org/10.1002/1529-0131(199909)42:9 3.0.CO;2-F.
3. Aletaha D, Smolen J, Ward MM. Measuring function in rheumatoid arthritis: identifying reversible and irreversible components. Arthritis Rheum. 2006;54:2784–92. DOI: http://dx.doi.org/10.1002/art.22052.
4. Radner H, Smolen J, Aletaha D. Impact of comorbidity on physical function in patients with rheumatoid arthritis. Ann Rheum Dis. 2010;69:536–41. DOI: http://dx.doi.org/10.1136/ard.2009.118430.
5. Smolen JS, Aletaha D, Bijlsma JW, et al. T2T Expert Committee. Treating rheumatoid arthritis to target: recommendations of an international force. Ann Rheum Dis. 2010;69:631–7. DOI: http://dx.doi.org/10.1136/ard.2009.123919.
6. McGanagle D. The history of erosions in rheumatoid arthritis: are erosions history? Arthritis Rheum. 2010;62:312–5.
7. Carson DA, Haneji N. Fitting arthritis with a senescence gene. Nat Med. 1999;5:731–2. DOI: http://dx.doi.org/10.1038/10447.
8. Sharp JT, Lidsky MD, Collins LC, Moreland J. Methods of scoring the progression of radiologic changes in rheumatoid arthritis. Arthritis Rheum. 1971;14:706–20. DOI: http://dx.doi.org/10.1002/art.1780140605.
9. Van der Heijde DM. Plain X-rays in rheumatoid arthritis overview of scoring methods, their reliability and applicability. Baillieres Clin Rheum. 1996;10:435–53. DOI: http://dx.doi.org/10.1016/S0950-3579(96)80043-4.
10. Van der Heijde D. How to read radiographs according to the Sharp/van der Heijde method. J Rheumatol. 1999;26:743–5.
11. Arnett FC, Edworthy SM, Bloch DA, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum. 1988;31:315–24. DOI: http://dx.doi.org/10.1002/art.1780310302.
12. Aletaha D, Neogi T, Silman AJ, et al. 2010 rheumatoid arthritis classification criteria an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis. 2010;69:1580–8. DOI: http://dx.doi.org/10.1136/ard.2010.138461.
13. Van der Heijde D, van der Helm-van Mil AHM, Aletaha D, et al. EULAR definition of erosive disease in light of the 2010 ACR/EULAR rheumatoid arthritis classification criteria. Ann Rheum Dis. 2013;72:479–81. DOI: http://dx.doi.org/10.1136/annrheumdis-2012-202779.
14. De Rooy DP, van der Linden MP, Knevel R, et.al. Predicting arthritis outcomes – what can be learned from the Leiden Early Arthritis Clinic? Rheumatology (Oxford). 2011;50:93–100.
15. Combe B, Benessiano J, Berenbaum F, et al. The ESPOIR cohort: a ten-year followup of early arthritis in France: methodology and baseline characteristics of the 813 included patients. Joint Bone Spine. 2007;74:440–5. DOI: http://dx.doi.org/10.1016/j.jbspin.2007.06.001.
16. Gravallese EM, Harada Y, Wang JT, et al. Identification of cell types responsible for bone resorbtion in rheumatoid arthritis and juvenile arthritis. Am J Pathol. 1998;152:943–51.
17. Redlich K, Hayer S, Ricci R, et al. Osteoclasts are essential for TNF-alphamediated joint destruction. J Clin Invest. 2002;11:1419–27. DOI: http://dx.doi.org/10.1172/JCI0215582.
18. Karsdal M, Woodworth T, Henriksen K, et al. Biochemical markers of ongoing joint damage in rheumatoid arthritis – current and future applications, limitations and opportunities. Arthritis Res Ther. 2011;13:215–24. DOI: http://dx.doi.org/10.1186/ar3280.
19. Goldring SR. Pathogenesis of bone and cartilage destruction in rheumatoid arthritis. Rheumatology (Oxford). 2003;42 (Suppl 2):ii11–6.
20. Milner JM, Cawston TE. Matrix metalloproteinase knockout studies and the potential use of matrix metalloproteinase inhibitor in the rheumatic diseases. Curr Drug Targets Inflamm Allergy. 2005;4:363–75. DOI: http://dx.doi.org/10.2174/1568010054022141.
21. Jenkins JK, Hardy KJ, McMurray RW. The pathogenesis of rheumatoid arthritis: a guide to therapy. Am J Med Sci. 2002;323:171–80. DOI: http://dx.doi.org/10.1097/00000441-200204000-00002.
22. Choy EH, Panayi GS. Cytokine pathways and joint inflammation in rheumatoid arthritis. N Engl J Med. 2001;344:907–16. DOI: http://dx.doi.org/10.1056/NEJM200103223441207.
23. Viette D, Setladi H, Wautier MP, et al. Identification of on endothelial cell growthinhibitory activity produced by human monocytes. Exp Cell Res. 1990;188:219–25. DOI: http://dx.doi.org/10.1016/0014-4827(90)90163-5.
24. Kraan MC, Versendaal H, Jonker M, et al. Asymptomatic synovitis precedes clinically manifest arthritis. Arthritis Rheum. 1998;41:1481–8. DOI: http://dx.doi.org/10.1002/1529-0131(199808)41:8 3.0.CO;2-O.
25. Gamero P, Geusens P, Landewe R. Biochemical markers of joint tissue turnover in early rheumatoid arthritis. Clin Exp Rheumatol. 2003;21(5 Suppl 31):S54–8.
26. Stenger AA, van Leeuwen MA, Houtman PM, et al. Early effective suppression of inflammation in rheumatoid arthritis reduces radiographic progression. Br J Rheumatol. 1998;37:1157–63. DOI:http://dx.doi.org/10.1093/rheumatology/37.11.1157.
27. Schaller S, Hervilsen K, Hoegh-Andersen P, et al. In vitro, ex vivo, and in in vivo methodological approaches for studying therapeutic targets of osteoporosis and degenerative join diseases: how biomarkers can assist? Assay Drug Dev Technol. 2005;3:553–80. DOI: http://dx.doi.org/10.1089/adt.2005.3.553.
28. Hashimoto S, Creighton-Achermann L, Talahashi K, et al. Development and regulation of osteophyte formation during experimental osteoarthritis. Osteoarthritis Cartilage. 2002;10:180–7. DOI: http://dx.doi.org/10.1053/joca.2001.0505.
29. Dam EB, Loog M, Christiansen C, et al. Identification of progressors in osteoarthritis by combining biochemical and MRI-based markers. Arthritis Res Ther. 2009;11:R115. DOI: http://dx.doi.org/10.1186/ar2774.
30. Billinghurst RC, Mwale F, Hollander A, et al. Immunoassays for collagens in chondrocyte and cartilage explant cultures. Methods Mol Med. 2004;100:251–74.
31. Nemorovskiy OV, Sunyer T, Aggarwal P, et al. Discovery and development of the Nterminal procollagen type II (NPII) biomarker: a tool for measuring collagen II synthesis. Osteoarthritis Cartilage. 2008;16;1494–500. DOI: http://dx.doi.org/10.1016/j.joca.2008.04.021.
32. Billinghurst RC, Danlberg L, Ionescu M, et.al. Enhanced cleavage of type II collagen by collagenases in osteoarthritis articular cartilage. J Clin Invest. 1997;99:1534–45. DOI: http://dx.doi.org/10.1172/JCI119316.
33. Risteli J, Niemi S, Trivedi P, et al. Rapid equilibrium radioimmunoassay for the amino-terminal propeptide of human type III procollagen. Clin Chem. 1988;34:715–8.
34. Klareskog L, van der Heijde D, de Langer JP, et al. TEMPO (Trial of Etanercept and Methotrexate with Radiographic Patients Outcomes) study investigators: therapeutic effect of the combination etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: a double-blind randomised controlled trial. Lancet. 2004;363:675–81. DOI: http://dx.doi.org/10.1016/S0140-6736(04)15640-7.
35. Schurigt U, Stopfel N, Huckel M, et al. Local expression of matrix metalloproteases, cathepsins, and their inhibitors during the development of murine antigen-induced arthritis. Arthritis Res Ther. 2005;7:R174–88. DOI: http://dx.doi.org/10.1186/ar1466.
36. Gineyts E, Garnero P, Delmas PD. Urinare excretion of glucosil-galastosyl pyridinoline: a specific biochemical marker of synovium degradation. Rheumatology (Oxford). 2001;40:315–23. DOI: http://dx.doi.org/10.1093/rheumatology/40.3.315.
37. Johansen JS, Jensen HS, Price PA. A new biochemical marker for joint injury. Analysis of YKL-40 in serum and synovial fluid. Br J Rheumatol. 1993;32:949–55. DOI: http://dx.doi.org/10.1093/rheumatology/32.11.949.
38. Delaisse JM, Andersen TL, Engsig MT, et al. Matrix metalloproteinases (MMP) and cathepsin K contribute differently to osteoclastic activities. Micros Res Tech. 2003;61:504–13. DOI: http://dx.doi.org/10.1002/jemt.10374.
39. Chopin F, Garnero P, le Henanff A, et al. Long-term effects of infliximab on bone and cartilage turnover markers in patients with rheumatoid arthritis. Ann Rheum Dis. 2008;67:353–7. DOI: http://dx.doi.org/10.1136/ard.2007.076604.
40. Munoz-Torres M, Reyes-Garcia R, Mezquita-Raya P, et al. Serum cathepsin K as marker of bone metabolism in postmenopausal women treated with alendronate. Maturitas. 2009;64:188–92. DOI: http://dx.doi.org/10.1016/j.maturitas.2009.09.011.
41. Janckila AJ, Neustadt DH, Yam LT. Significant of serum TRAPC in rheumatoid arthritis. J Bone Miner Res. 2008;23:1287–95. DOI: http://dx.doi.org/10.1359/jbmr.080329.
42. Syversen SW, Haavardsholm EA, Bayersen P, et al. Biomarkers in early rheumatoid arthritis: longitudinal associations with inflammation and joint destruction measured by magnetic resonance imaging and conventional radiographs. Ann Rheum Dis. 2010;69:845–50. DOI: http://dx.doi.org/10.1136/ard.2009.122325.
43. Garnero P, Peterfy C, Zaim S, Schoenharting M. Bone marrow abnormalities on magnetic resonance imaging are associated with type II collagen degradation in knee osteoarthritis: a three-month longitudinal study. Arthritis Rheum. 2005;52:2822–9. DOI: http://dx.doi.org/10.1002/art.21366.
44. Fujikawa K, Kawakami A, Tamai M, et al. High serum cartilage oligometric matrix protein determines the subset of patients with early-stage rheumatoid arthritis with high serum C-reactive protein, matrix metalloprotase-3, and MRI-proven bone erosion. J Rheumatol. 2009;36:1126–9. DOI: http://dx.doi.org/10.3899/jrheum.080926.
45. Knudsen LS, Klarlund M, Skjadt H, et al. Biomarkers of inflammation in patients with unclassified polyarthritis and early rheumatoid arthritis. Relationship to disease activity and radiographic outcome. J Rheumatol. 2008;35:1277–87.
46. Aletaha D, Funovits J, Smolen JS. Physical disability in rheumatoid arthritis is associated with cartilage damage rather than bone destruction. Ann Rheum Dis. 2011;70:733–9. DOI: http://dx.doi.org/10.1136/ard.2010.138693.
47. Lipsky PE, van der Heijde DM, St Clair EW, et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis/ Anti-Tumor-Necrosis-Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group. N Engl J Med. 2000;343:1594–602. DOI: http://dx.doi.org/10.1056/NEJM200011303432202.
48. St Clair EW, van der Heijde DM, Smolen JS, et al. Combination of infliximab and methotrexate therapy for early rheumatoid arthritis: a randomized, controlled trial. Arthritis Rheum. 2004;50:3432–43. DOI: http://dx.doi.org/10.1002/art.20568.
49. Keystone EC, Kavanaugh AF, Sharp JT, et al. Radiographic, clinical, and functional outcomes of treatment with adalimumab (a human anti-tumor necrosis factor monoclonal antibody) in patients with active rheumatoid arthritis receiving concomitant methotrexate therapy: a randomized, placebo-controlled 52-week trial. Arthritis Rheum. 2004;50:1400–11. DOI: http://dx.doi.org/10.1002/art.20217.
50. Breedveld FC, Weisman MH, Kavanaugh AF, et al. The PREMIER study: a multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum. 2006;54:26–37. DOI: http://dx.doi.org/10.1002/art.21519.
51. Smolen JS, Kalden JR, Scott DL, et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicenter trial. European Leflunomide Study Group. Lancet. 1999;353:259–66. DOI: http://dx.doi.org/10.1016/S0140-6736(98)09403-3.
52. Scott DL, Smolen JS, Kalden JR, et al. Treatment of active rheumatoid arthritis with leflunomide: two year follow up of a double blind, placebo controlled trial versus sulphasalazine. Ann Rheum Dis. 2001;60:913–23. DOI: http://dx.doi.org/10.1136/ard.60.10.913.
53. Emery P, Breedveld FC, Lemmel EM, et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology (Oxford). 2000;39:655–65. DOI: http://dx.doi.org/10.1093/rheumatology/39.6.655.
54. Smolen JS, Breedveld FC, Schiff MH, et al. A simplified disease activity index for rheumatoid arthritis for use in clinical practice. Rheumatology (Oxford). 2003;42:244–57. DOI: http://dx.doi.org/10.1093/rheumatology/keg072.
55. Balsa A, de Muguel E, Castillo C, et al. Superiority of SDAI over DAS28 in assessment of remission in rheumatoid arthritis using power Doppler ultrasonography as a gold standard. Rheumatology (Oxford). 2010;49:683–90. DOI: http://dx.doi.org/10. 1093/rheumatology/kep442.
56. Aletaha D, Smolen J, Ward MM. Measuring function in rheumatoid arthritis. Identifying reversible and irreversible components. Arthritis Rheum. 2006;54:2784–92. DOI: http://dx.doi.org/10.1002/art.22052.
57. Kanbe K, Chiba J, Nakamura A. Decrease of CD 68 and MMP-3 expression in synovium by treatment of adalimumab for rheumatoid arthritis. Intern J Rheum Dis. 2011;14:262–6. DOI: http://dx.doi.org/10.1111/j.1756-185X.2011.01643.x.
58. Mamehara A, Sugimoto T, Sugiyama D, et al. Serum matrix metalloproteinase-3 as predictor of joint destruction in rheumatoid arthritis, treated with non-biological disease modifying anti-rheumatic drugs. Kobe J Med Sci. 2010;56:98–107.
59. Garnero P, Thompson E, Woodworth T, et al. Rapid and sustained improvement in bone and cartilage turnover markers with the anti-interleukin-6 receptor inhibitor tocilizumab plus methotrexate in rheumatoid arthritis patients with an inadequate response to methotrexate: results from a substudy of the multicenter double-blind placebo-controlled trial of tocilizumab in inadequate responders to methotrexate alone. Arthritis Rheum. 2010;62:33–43. DOI: http://dx.doi.org/10.1002/art.25053.
60. Urata Y, Uesato R, Tanaka D, et al. Treating to target matrix metalloproteinase 3 normalisation together with disease activity score below 2.6 yields better effects than each alone in rheumatoid arthritis patients: T-4 Study. Ann Rheum Dis. 2012;71:534–40. DOI: http://dx.doi.org/10 1136/annrheumdis-2011-200108.
61. Breedveld FC, Weisman MH, Kavanaugh AF, et al. The PREMIER study: a multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum. 2006;54:26–37. DOI: http://dx.doi.org/10.1002/art.21519.
62. Smolen JS, van der Heijde DM, Keystone EC, et al. Association of joint space narrowing with impairment of physical function and work ability in patients with early rheumatoid arthritis: protection beyond disease control by adalimumab plus methotrexate. Ann Rheum Dis. 2013;72:1156–62. DOI: http://dx.doi.org/10.1136/annrheumdis-2012-201620.
63. Fujikawa K, Kawakami A, Tamai M, et al. High serum cartilage oligometric matrix protein determines the subset of patients with early-stage rheumatoid arthritis with high serum C-reactive protein, matrix metalloprotease-3, and MRI-proven bone erosion. J Rheumatol. 2009;36:1126–9. DOI:http://dx.doi.org/10.3899/jrheum.080926.
64. Tamai M, KawakamiA, Ueani M, et al. Bone edema determined by magnetic resonance imaging reflects severe disease status in patients with early-stage rheumatoid arthritis. J Rheumatol. 2007;34:2154–7.
65. Lindvist E, Eberhardt K, Bendzen K, et al. Prognostic laboratory markers of joint damage in rheumatoid arthritis. Ann Rheum Dis. 2005;64:196–201. DOI: http://dx.doi.org/10.1136/ard.2003.019992.
66. Den Broeder AA, Joosten LA, Saxne T, et al. Long-term anti-tumour necrosis factor alpha monotherapy in rheumatoid arthritis: effect on radiological course and prognostic value of markers of cartilage turnover and endothelial activation. Ann Rheum Dis. 2002;61:311–8. DOI: http://dx.doi.org/10.1136/ard.61.4.311.
67. Keystone EC, van der Heijde D, Kavanaugh A, et al. Clinical, functional, and radiographic benefits of longterm adalimumab plus methotrexate: Final 10-year data in longstanding rheumatoid arthritis. J Rhematol. 2013;40:1487–97. DOI: http://dx.doi.org/10.3899/jrheum.120964.
Для цитирования:
For citation:
Chichasova N.V. Cartilage destruction in rheumatoid arthritis, its association with functional impairments. Modern Rheumatology Journal. 2014;8(4):60-71. (In Russ.) https://doi.org/10.14412/1996-7012-2014-4-60-71